System der
Lebewesen (Stefan Hintsche,
2024)
Letztes Update
23.02.2024
Cetartiodactyla
> Artiofabula
> Cetruminantia
> Whippomorpha
> Cetacea
> Odontoceti
> Delphinida > Inioidea > Iniidae
|
Iniidae |
|
|
|
|
Familia
Iniidae Gray, 1846 (Familie
Amazonas-Flussdelfine/Amazon River Dolphins):
· 4 Arten.
· Taxonomie/Phylogenie: Nominotypische Gattung Inia d‘Orbigny, 1834; nominotypische Art Inia boliviensis d‘Orbigny, 1834.
· Identifizierung/Beschreibung: Flügelbeine reduziert, wodurch Gaumenbein und Keilbeinflügelknochen sichtbar sind. Der Verdauungstrakt besteht nach der Speiseröhre (Oesophagus) aus einem muskulösen Vormagen, einem drüsigen Hauptmagen und dem muskulösen Pylorusmagen. Nahrung kann den Hauptmagen zuerst erreichen oder Vor- und Hauptmagen gleichzeitig.
·
Bestand: 2 Arten Stark
gefährdet; 2 Arten Nicht bewertet; Gefährdung durch Fischfangnetze,
Tötung für die Verarbeitung zu Fischködern und traditionelle Medizin, das
Aufstauen von Flüssen und Umweltverschmutzung (v.a. Schwermetalle und
Organochlorine).
· Verbreitung: Südamerika. Ursprung für die Besiedelung der südamerikanischen Flusssysteme ist noch unklar. Diskutiert werden eine Einwanderung von pazifischer Seite, eine Einwanderung aus der Karibik, über das Mündungsgebiet des Amazonas oder über eine Verbindung von Paraná- und Amazonasbecken. Für die letzte Theorie spricht, dass im Umfeld des La-Plata-Ästuars, das zum Paraná-Becken gehört, der nächste rezente Verwandte der Familie Iniidae lebt, der La-Plata-Delfin (Familie Pontoporiidae). Zudem wurden an den Ufern des Paraná fossile Vertreter der zur Familie Iniidae zählenden Gattungen Saurocetes Burmeister, 1871 und Ischyrorhynchus Ameghino, 1891 gefunden.
· Literatur: Ameghino (1891); Burmeister (1871); Cozzuol (2010); Da Silva et al. (2023); Da Silva & Martin (2014, 2020); D‘Orbigny (1834); Gray (1846); Ruiz-García et al. (2018).
Genus Inia d‘Orbigny, 1834 (Gattung Botos/Botos):
· 4 Arten.
· Taxonomie/Phylogenie/Etymologie: Generotypus Inia boliviensis d‘Orbigny, 1834. Stammbaum orientiert sich an den Ergebnissen von Hrbek et al. (2014) und Gonçalves Farias (2015). Zunächst unter Delphinus geführt, wurden die Amazonas-Flussdelfine von d’Orbigny (1834) in die von ihm neu geschaffene Gattung Inia gestellt. Der Gattungsname Inia entspricht der von den im bolivianischen Tiefland beheimateten Stämmen der Guarayos verwendeten Bezeichnung für die Flussdelfine. Lange wurde die Gattung Inia als monotypisch mit nur einer Art, Inia geoffrensis gesehen. Nach genetischen Untersuchungen von Hrbek et al. (2014) spaltete sich boliviensis vor ca. 2,9 Millionen Jahren ab, während araguaiaensis sich vor rund 2 Millionen Jahren isolierte. Die Trennung von Flussdelfinen des mittleren bis unteren Orinokos und einer Klade aus Flussdelfinen des oberen Orinokos und des Amazonas fand nach Gonçalves Farias (2015) vor fast 1,7 Millionen Jahren statt, während sich die Flussdelfine des oberen Orinokos und des Amazonas sich schließlich vor ca. 354.000 Jahren trennten. Vsl. existieren folglich fünf Entwicklungslinien, wobei für die beiden Linien im Orinoko-System noch genauere Untersuchungen notwendig sind und diese hier noch unter dem Taxon humboldtiana zusammengefasst werden. Auch wenn es morphologische, genetische und akustische Unterschiede zwischen den Formen gibt, ist die Unterteilung in Arten bzw. Unterarten allgemein noch umstritten. So äußeren Ruiz-García et al. (2018) trotz der in ihren Untersuchungen festgestellten Differenzen zwischen den verschiedenen Inia-Taxa Zweifel am Artstatus von boliviensis, humboldtiana und araguaiaensis. Nach Siciliano et al. (2016) unterscheidet sich boliviensis von humboldtiana in der mitochondriellen Kontrollregion durchschnittlich um 7,6%, von geoffrensis um 5,1-6,1% und von araguaiaensis um 4,0%, während sich araguaiaensis von humboldtiana um 6,1% und von geoffrensis um 4,3-4,7% unterscheidet, was durchaus üblichen Differenzwerten zwischen Arten entspricht. Bei humboldtiana und geoffrensis beträgt die durchschnittliche Differenz 1,8-2,3% und liegt somit im Grenzbereich zwischen Unterarten und Arten. Aufgrund der verhältnismäßig langen zeitlichen Trennung, v.a. was die Populationen im Unterlauf des Orinokos betrifft, und aufgrund der diagnostizierbaren Unterschiede in Morphologie und Lautäußerung werden humboldtiana und geoffrensis hier als separate Arten betrachtet.
· Identifizierung/Beschreibung: Die Flussdelfine in den Flusssystemen Südamerikas sind die größten Süßwasserdelfine, wobei ein Sexualdimorphismus vorliegt. Männchen sind im Schnitt 16% länger und 55% schwerer als Weibchen. Der Kopf ist dick und kräftig mit einer wulstigen, weichen Melone und einem langen zylindrischen Rostrum. Der Kopf ist außerdem gut beweglich, da die Halswirbel im Gegensatz zu anderen Walen nicht miteinander verschmolzen sind. Neugeborene sind dunkelgrau und werden mit zunehmenden Alter hellgrau, später rosa, was vermutlich auf einen fortschreitenden Verlust dunkler Pigmentierung mit dem Alter zurückzuführen ist. Rosafärbungen sind bei Männchen verbreiteter als bei Weibchen. Chromosomen 2n = 44.
· Verbreitung: Südamerika.
· Literatur: Da Silva et al. (2023); Da Silva & Martin (2014, 2020); D‘Orbigny (1834); Gonçalves Farias (2015); Hrbek et al. (2014); Melo et al. (2021); Ruiz-García et al. (2018); Siciliano et al. (2016).
Artiofabula
> Cetruminantia
> Whippomorpha
> Cetacea
> Odontoceti
> Delphinida > Inioidea > Iniidae > Inia
Genus Inia d‘Orbigny, 1834 (Gattung Botos/Botos):
·
4 Arten.
·
Taxonomie/Phylogenie/Etymologie: Generotypus Inia boliviensis d‘Orbigny,
1834. Stammbaum orientiert sich an den Ergebnissen von Hrbek et al. (2014) und Gonçalves
Farias (2015). Zunächst
unter Delphinus geführt, wurden die Amazonas-Flussdelfine von d’Orbigny (1834) in die von ihm
neu geschaffene Gattung Inia
gestellt. Der Gattungsname Inia
entspricht der von den im bolivianischen Tiefland beheimateten Stämmen der
Guarayos verwendeten Bezeichnung für die Flussdelfine. Lange wurde die Gattung Inia als monotypisch mit nur einer Art, Inia geoffrensis gesehen. Nach
genetischen Untersuchungen von Hrbek et al.
(2014) spaltete sich boliviensis
vor ca. 2,9 Millionen Jahren ab, während araguaiaensis
sich vor rund 2 Millionen Jahren isolierte. Die Trennung von Flussdelfinen des
mittleren bis unteren Orinokos und einer Klade aus Flussdelfinen des oberen
Orinokos und des Amazonas fand nach Gonçalves Farias
(2015) vor fast 1,7 Millionen Jahren statt, während sich die
Flussdelfine des oberen Orinokos und des Amazonas sich schließlich vor ca.
354.000 Jahren trennten. Vsl. existieren folglich fünf Entwicklungslinien,
wobei für die beiden Linien im Orinoko-System noch genauere Untersuchungen
notwendig sind und diese hier noch unter dem Taxon humboldtiana zusammengefasst werden. Auch wenn es morphologische,
genetische und akustische Unterschiede zwischen den Formen gibt, ist die
Unterteilung in Arten bzw. Unterarten allgemein noch umstritten. So äußeren Ruiz-García et
al. (2018) trotz der in ihren Untersuchungen festgestellten
Differenzen zwischen den verschiedenen Inia-Taxa
Zweifel am Artstatus von boliviensis,
humboldtiana und araguaiaensis. Nach Siciliano et al. (2016)
unterscheidet sich boliviensis von humboldtiana in der mitochondriellen
Kontrollregion durchschnittlich um 7,6%, von geoffrensis um 5,1-6,1% und von araguaiaensis
um 4,0%, während sich araguaiaensis
von humboldtiana um 6,1% und von geoffrensis um 4,3-4,7% unterscheidet,
was durchaus üblichen Differenzwerten zwischen Arten entspricht. Bei humboldtiana und geoffrensis beträgt die durchschnittliche Differenz 1,8-2,3% und
liegt somit im Grenzbereich zwischen Unterarten und Arten. Aufgrund der
verhältnismäßig langen zeitlichen Trennung, v.a. was die Populationen im
Unterlauf des Orinokos betrifft, und aufgrund der diagnostizierbaren
Unterschiede in Morphologie und Lautäußerung werden humboldtiana und geoffrensis
hier als separate Arten betrachtet.
·
Identifizierung/Beschreibung: Die Flussdelfine
in den Flusssystemen Südamerikas sind die größten Süßwasserdelfine, wobei ein
Sexualdimorphismus vorliegt. Männchen sind im Schnitt 16% länger und 55%
schwerer als Weibchen. Der Kopf ist dick und kräftig mit einer wulstigen,
weichen Melone und einem langen zylindrischen Rostrum. Der Kopf ist außerdem
gut beweglich, da die Halswirbel im Gegensatz zu anderen Walen nicht
miteinander verschmolzen sind. Neugeborene sind dunkelgrau und werden mit
zunehmenden Alter hellgrau, später rosa, was vermutlich auf einen
fortschreitenden Verlust dunkler Pigmentierung mit dem Alter zurückzuführen
ist. Rosafärbungen sind bei Männchen verbreiteter als bei Weibchen. Chromosomen
2n = 44.
·
Verbreitung: Südamerika.
·
Literatur: Da Silva et al. (2023);
Da Silva & Martin (2014, 2020);
D‘Orbigny (1834); Gonçalves Farias (2015); Hrbek et al. (2014); Melo et al. (2021);
Ruiz-García
et al. (2018); Siciliano et al. (2016).
Inia boliviensis d‘Orbigny,
1834 (Bolivianischer
Flussdelfin/Bolivian River Dolphin):
· Holotypus/Terra typica: Weibchen gesammelt im Rio Guaporé (in Bolivien Río Iteñez), in der Nähe von Príncipe da Beira, Brasilien.
· Taxonomie/Phylogenie/Etymologie: Ursprünglich als eigene Art beschrieben, wird die Form teilweise noch als Unterart oder Synonym von geoffrensis behandelt, lässt sich aber sowohl morphologisch (Emin-Lima et al., 2022) als auch genetisch (Siciliano et al., 2016; Banguera-Hinestroza et al., 2002) gut von den anderen Inia-Taxa unterscheiden. Die Trennung zwischen boliviensis und geoffrensis erfolgte vor knapp 2,9 Millionen Jahren, wobei im Madeira unterhalb der Stromschnellen und des Teotônio-Wasserfalls, die eigentlich eine Barriere zwischen beiden Arten bilden, auch eine Hybridzone existiert. Diese entstand vermutlich dadurch, dass Tiere bei Hochwasser gelegentlich die Barriere doch überwinden konnten. Da die genetischen Muster auf eine bereits langanhaltende Existenz der Hybridpopulation hindeuten (evtl. mehr als 120.000 Jahre), könnte sich aus dieser Population langfristig eine neue Art entwickeln. Durch den Bau von zwei Staudämmen (Jirau- und Santo-Antonio-Wasserkraftwerke) ist künftig auch kein genetischer Austausch mehr möglich. Der wissenschaftliche Name boliviensis leitet sich von Bolivien ab und bezieht sich auf den Fundort.
· Synonyme: Delphinus inia von Rapp, 1837.
· Identifizierung/Beschreibung: Gesamtlänge ♂ bis 236 cm, ♀ 208-239 cm. Oberkiefer 31-35 Zähne pro Reihe, Unterkiefer 29-34 Zähne pro Reihe, davon sowohl im Ober- als auch im Unterkiefer 9-11 backenzahnähnliche Zähne pro Reihe. Der Bolivianische Flussdelfin hat einen grazileren Schädel (kleinere Gehirnkapsel und schmälere Schnauze) und ist auch allgemein kleiner als der Amazonas-Flussdelfin, besitzt aber mehr Zähne, ein längeres Rostrum (73% der Schädellänge) und einen robusteren Körperbau als dieser. Zudem sind im Verhältnis zur Gesamtlänge die Flipper größer und der Schwanz länger.
· Biologie: Die Art bevorzugt klares, sedimentreiches Weißwasser in Überflutungsgebieten, Zusammenflüssen, und Seen, meidet hingegen Schwarzwasser. Meist werden die Tiere einzeln oder in kleinen Gruppen bis zu vier Tieren gesichtet, wobei größere Ansammlungen in Buchten und Einmündungsbereichen angetroffen werden können. Die Abundanz liegt bei 0,2-5,8 Individuen pro Kilometer. Aus Beobachtungen und Untersuchungen des Mageninhalts ist bekannt, dass auf jeden Fall Echte Dornwelse (Doradidae), Falsche Dornwelse (Auchenipteridae), Siebenflossenwelse (Heptapteridae), Beilbauchsalmler (Gasteropelecidae) und Echte Salmler (Characidae) zur Nahrung gehören. Pilleri (1977) berichtet bei einem 1968 gefangenen Exemplar des Bolivianischen Flussdelfins von dem Befall des linken Auges durch einen Parasiten, bei dem es sich wohl um einen Saugwurm handelte. Eine genaue Identifizierung der Art war aber nicht möglich.
· Bestand: Stark gefährdet; von der IUCN noch als Unterart von geoffrensis gewertet; Population ca. 4.000 Tiere und abnehmend, was Zählungen in den Flüssen Mamoré, Ibare und Tijamuchi belegen. Durch das verhältnismäßig kleine Verbreitungsgebiet im Becken des Madeira-Flusses ist von einer stärkeren Gefährdung als bei I. geoffrensis auszugehen. Zu den wichtigsten Gefährdungsursachen gehören der Beifang beim Fischfang, die gezielte Jagd für die Verarbeitung zu Fischködern und die umfangreiche Gewässerverschmutzung. Zwar wird der Bufeo, wie der Flussdelfin in Bolivien auch genannt wird, nicht zum Verzehr gefangen, doch findet sich sein Fett bzw. Öl regelmäßig auf einheimischen Märkten, da es traditionell zur Behandlung von Atemwegserkrankungen verwendet wird. Auch die Zerstörung von Habitaten durch die Abholzung von Wäldern und die Ausbreitung der kommerziellen Landwirtschaft sowie Unfälle mit Booten und die Isolierung von Populationen durch Staudammprojekte stellen eine Bedrohung dar. In einigen Bereichen ist zum Schutz dringend ein Fischereimanagement mit Einschränkungen bestimmter Fangtechniken während der Fortpflanzungszeit und in sensiblen Lebensräumen notwendig. Außerdem muss durch Untersuchungen geklärt werden, wie sich Staudämme (z.B. Jirau-Wasserkraftwerk) auf die Population auswirken und mögliche negative Folgen minimiert werden können. Allgemein ist zu befürchten, dass durch die starken anthropogenen Eingriffe in die Gewässersysteme Notumsiedelungen, wie sie bei 26 im Pailas-Fluss festsitzenden Flussdelfinen durchgeführt wurden, zukünftig häufiger notwendig sind. Natürliche Schwankungen wurden unter anderem im Zusammenhang mit atypischen El-Niño- und La-Niña-Phänomenen festgestellt.
· Verbreitung: Südamerika (Bolivien; Brasilien).
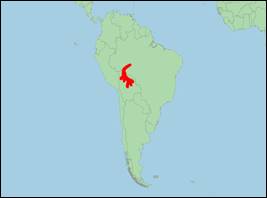
· Literatur: Aliaga-Rossel (2002, 2003, 2010); Aliaga-Rossel, Beerman & Sarmiento (2010); Aliaga-Rossel & Escobar-Ww (2020); Aliaga-Rossel et al. (2012); Aliaga-Rossel & Guizada (2017); Aliaga-Rossel & Guizada Duran (2020); Aliaga-Rossel, McGuire & Hamilton (2006); Aliaga-Rossel & Quevedo A. (2011); Banguera-Hinestroza et al. (2002); Da Silva et al. (2018, 2023); Da Silva & Martin (2014, 2020); D‘Orbigny (1834); Emin-Lima et al. (2022); Gravena et al. (2014, 2015); Guizada & Aliaga-Rossel (2016); Hrbek et al. (2014); Martínez-Agüero, Flores-Ramírez & Ruiz-García (2010); McGuire & Aliaga-Rossel (2010); Pivari et al. (2021); Ruiz-García (2010); Ruiz-García, Banguera & Cardenas (2006); Siciliano et al. (2016); Vianna et al. (2010).
Inia
araguaiaensis Hrbek,
Farias, Dutra & da Silva, 2014 (Araguaia-Flussdelfin/Araguaian
River Dolphin):
· Holotypus/Terra typica: INPA MA 144 (Säugetiersammlung am Nationalinstitut für Amazonien-Forschung Manaus), adultes Männchen, gesammelt von Claryana Costa Araújo am 21. September 2009 im Fluss Araguaia, nahe der Mündung in den Jurumirim-See, Goiás-Staat, Brasilien.
· Taxonomie/Phylogenie/Etymologie: Individuen im Fluss Araguaia, nach dem das Taxon araguaiaensis benannt ist, wurden vorher der Art geoffrensis zugeschrieben. Genetische Untersuchungen stützen den Artstatus (Hrbek et al., 2014; Siciliano et al., 2016) und postulieren eine Trennung von geoffrensis und araguaiaensis vor rund zwei Millionen Jahren. Die morphologischen Unterschiede sind nach bisherigen Erkenntnissen eher schwach ausgeprägt. So ließen sich bei den morphometrischen Schädelanalysen von Emin-Lima et al. (2022) die beiden Arten nicht eindeutig unterscheiden. Allerdings lässt sich araguaiaensis anhand der produzierten Klicklaute deutlich unterscheiden, was auch ein Hinweis auf anatomische Unterschiede ist (Melo et al., 2021). Es gibt Hinweise auf Hybride zwischen araguaiaensis und geoffrensis im Amazonas-Pará-Delta.
· Identifizierung/Beschreibung: Gesamtlänge ♂ ca. 236 cm, ♀ ca. 201 cm. 24-28 Zähne pro Reihe, davon sowohl im Ober- als auch im Unterkiefer 6-8 backenzahnähnliche Zähne pro Reihe. Wie I. geoffrensis besitzt I. araguaiaensis einen robusteren Schädel als die Arten I. boliviensis und I. humboldtiana. Die Hirnschale ist leicht schmaler als bei geoffrensis. Das Rostrum macht bei Männchen 68% und bei Weibchen 66% der Gesamtschädellänge aus, ist also im Verhältnis minimal länger als bei geoffrensis. Die durchschnittliche Spitzenfrequenz von Klicklauten des Araguaia-Flussdelfins liegt bei 49 kHz.
· Biologie: Meist werden einzelne Individuen oder kleine Gruppen von 3-4 Tieren gesichtet. Aus dem Zeitraum Juli bis September liegen einige Sichtungen von säugenden Weibchen vor. Bisher liegen nicht viele Informationen zur Ernährung vor. Aus Beobachtungen sind Wolfssalmler (Cynodontidae, Gattung Hydrolycus), Antennenwelse (Pimelodidae, Gattung Pimelodus) und Echte Dornwelse (Doradidae, Gattung Oxydoras) als Beutetiere bekannt. Dabei werden Fische durchaus auch aus Netzen und von Haken gepflückt. Berichten zufolge kommt es bei der Verfolgung von Fischschwärmen auch zu kooperativem Verhalten zwischen den Tieren. So werden Fische vor allem bei Niedrigwasser auf Sandbänke oder in sehr flaches Wasser getrieben. Akustische Untersuchungen haben gezeigt, dass Araguaia-Flussdelfine mindestens 237 verschiedene Lauttypen erzeugen, hauptsächlich gepulste, aber auch tonale Laute. Selten werden sich wiederholende Sequenzen von Abwärtspfiffen produziert, die immer in sozialen Gruppen auftraten. Dies deutet auf eine Verwendung der Geräusche in bestimmten Verhaltenskontexten hin. Statische Zusammenhänge mit bestimmten sozialen Verhaltensparametern konnten aber bisher nicht nachgewiesen werden.
· Bestand: Nicht bewertet; etwas über 1.000 Tiere; Population abnehmend. Erhebungen von Paschoalini et al. (2020) ergaben Dichten von 0,23 bis 5,7 Individuen pro km2, wobei die Abundanz nach Norden Richtung Tucuruí-Staudamms und danach stark abnimmt.
· Verbreitung: Südamerika (Brasilien). Während bei araguaiaensis zunächst von eine Verbreitung in den Flüssen Araguaia und Tocatins südlich des Tucuruí-Staudamms ausgegangen wurde, lassen Funde angespülter Tiere aus der Marajó-Bucht eine Verbreitung bis zur Mündung des Pará-Flusses vermuten. Neuere Informationen deuten daraufhin, dass im Bereich um die Marajó-Insel wahrscheinlich araguiaensis und geoffrensis vorkommen und gelegentlich hybridisieren.
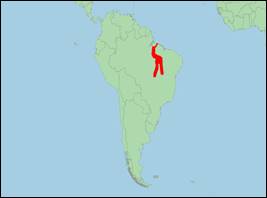
· Literatur: Araújo (2010); Araújo & da Silva (2014); Araújo & Wang (2012); Da Silva et al. (2023); Da Silva & Martin (2014, 2020); Emin-Lima et al. (2022); Hrbek et al. (2014); Melo et al. (2021); Melo-Santos et al. (2019, 2020); Paschoalini et al. (2020); Pivari, Pacca & Sebrian (2017); Siciliano et al. (2016).
Inia geoffrensis (de
Blainville, 1817) (Amazonas-Flussdelfin/Amazon River
Dolphin):
· Holotypus/Terra typica: Das Typusexemplar stammt möglicherweise aus dem oberen Lauf des Amazonas, Brasilien.
· Taxonomie/Phylogenie/Etymologie: Zunächst als Delphinus geoffrensis beschrieben, wurde die nach dem französischen Naturforscher Étienne Geoffroy Saint-Hilaire benannte Art schließlich von Gervais (1855) in die Gattung Inia überführt.
· Synonyme: Delphinus frontatus Cuvier, 1823; Delphinus amazonicus von Spix & von Martius, 1831.
· Identifizierung/Beschreibung: Gesamtlänge ♂ 219-255 cm, ♀ 182-225 cm; Gewicht ♂ 113,5-207 kg, ♀ 72-154 kg. Oberkiefer 23-35 Zähne pro Reihe, Unterkiefer 24-35 Zähne pro Reihe, davon sowohl im Ober- als auch im Unterkiefer 7-9 backenzahnähnliche Zähne pro Reihe. Das Rostrum macht 65% der Schädellänge aus, ist also im Verhältnis kürzer als bei I. boliviensis. Klicklaute 40-80 kHz, durchschnittliche Spitzenfrequenz 45,5 kHz.
· Biologie: Bei männlichen Tieren wurde festgestellt, dass sie gelegentlich Objekte wie Stöcke, Äste oder Grasbüschel tragen und diese immer wieder auf die Wasseroberfläche werfen. Dieses Verhalten wurde auch bei Orinoko-Flussdelfinen in Haltung beobachtet. Es wird davon ausgegangen, dass es sich um ein sozio-sexuelles Imponiergehabe handelt. Auch aggressives Verhalten von Männchen gegenüber Neugeborenen wurde beobachtet, wenngleich nach bisherigen Erkenntnissen kein gezielter Infantizid stattfindet. Weibchen versuchen ihr Jungtier bei Attacken durch Männchen zu schützen. Bei der ersten Schwangerschaft sind weibliche Flussdelfine durchschnittlich 9,7 Jahre alt und 180 bis 200 cm lang. Tragzeit 12-13 Monate. Es wird ein Jungtier geboren, wobei das Geburtsgewicht 10-13 kg und die Länge 78-90 cm beträgt. Geburten finden über das ganze Jahr statt, wobei eine Häufung bei niedrigen Wasserständen zu beobachten ist, was vermutlich auf erleichterte Jagdbedingungen durch eine höhere Fischkonzentration zurückzuführen ist. Weibchen können gleichzeitig trächtig und säugend sein. Die Laktation kann zwischen 1,5 und 5,8 Jahren schwanken. Die Lebenserwartung ist unbekannt, aber das älteste Weibchen in einer Population im zentralen Amazonas wurde auf 32,3 Jahre geschätzt. Weibchen mit über 25 Jahren waren auch noch reproduktivfähig. Die Generationszeit wird auf 22 Jahre geschätzt. Durch das heterodonte Gebiss mit backenzahnähnlichen Zähnen können auch gepanzerte Beutetiere wie Panzerwelse, Krebse und gelegentlich kleinere Schildkröten (z.B. Höcker-Schienenschildkröte) gefangen und zermalmt werden. Nahrung suchen die Flussdelfine sowohl am Gewässergrund (Benthos) als auch im offenen Wasser (Pelagial) und im Uferbereich (Litoral). Dabei schwimmen die Botos, wie sie in vielen Gegenden Südamerikas auch genannt werden, auch in nur 1-2 m tiefe Gewässerabschnitte. Mit dem sehr wendigen Körper und den großen, beweglichen Flippern können sie geschickt im flachen Wasser und zwischen der Vegetation von überfluteten Waldflächen manövrieren. Als Beutetiere, deren Größe von 5 bis 80 cm (durchschnittlich 20 cm) Länge reichen kann, dominieren Fische. Bisher konnten Exemplare von über 50 verschiedenen Fischarten aus mehr als 20 Familien als Nahrung nachgewiesen werden, darunter Süßwasser-Umberfische (Plagioscion sp.), Sägesalmler (Serrasalmidae), Echte Salmler (Characidae), Antennenwelse (Pimelodidae). An Parasiten wurde bei geoffrensis die Saugwurmart Hunterotrema macrosoma Dailey, 1971 nachgewiesen.
· Bestand: Stark gefährdet; Population abnehmend. Ein großes Problem ist die Verschmutzung der Gewässer. So konnten in Flussdelfinen teilweise hohe Konzentrationen von Quecksilber, DDT und PCB nachgewiesen werden.
· Verbreitung: Südamerika (Peru; Ekuador; Brasilien).
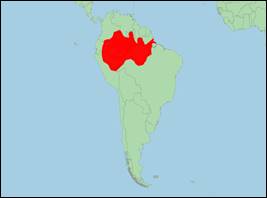
· Literatur: Best (1984); Best & da Silva (1993); Bowler et al. (2018); Castellanos-Mora, Trujillo & Ruiz-García (2010); Cuvier (1823); Dailey (1971); Da Silva et al. (2018, 2023); Da Silva & Martin (2014, 2020); De Blainville (1817); Martin & da Silva (2018); Martin, da Silva & Rothery (2008); Martínez-Agüero, Flores-Ramírez & Ruiz-García (2010); McGuire & Aliaga-Rossel (2010); Melo et al. (2021); Ruiz-García (2010a, b); Ruiz-García, Banguera & Cardenas (2006); Smith & Burrows (2010); Vianna et al. (2010); von Spix & von Martius (1831).
Inia
humboldtiana Pilleri
& Gihr, 1977 (Orinoko-Flussdelfin/Orinoco
River Dolphin):
· Holotypus/Terra typica: MBUCV 1-135 (Museum für Naturwissenschaft Caracas), Weibchen, gesammelt von F. Trebbau am 14. Mai 1966 im Río Apure bei San Fernando de Apuré, Venezuela.
· Taxonomie/Phylogenie/Etymologie: Ursprünglich als Unterart von geoffrensis beschrieben, wird der Orinoko-Flussdelfin auch heute noch meist als Unterart oder teilweise auch als Synonym von geoffrensis betrachtet (da Silva & Martin, 2014, 2020), da Orinoko und Amazonas über den Casiquiare-Kanal verbunden sind und zumindest theoretisch ein Austausch zwischen beiden Populationen stattfinden kann. Genetische Analysen sprechen auf jeden Fall für eine eigenständige evolutionäre Entwicklung der Flussdelfine im Orinoko, die mindestens als Unterart (Siciliano et al., 2016) gewertet werden können. Gonçalves Farias (2015) konnte bei seinen Analysen sogar zwei unterschiedliche Linien im Orinoko feststellen. Eine bewohnt den oberen und mittleren Orinoko und trennte sich vor ca. 354.000 Jahren von den Flussdelfinen im Amazonas. Die zweite Klade lebt im mittleren und unteren Orinoko und spaltete sich schon vor 1,66 Mio. Jahren von den Flussdelfinen im Oberlauf des Orinokos und des Amazonas ab. Es handelt sich also wahrscheinlich um zwei verschiedene Taxa, wobei der Name humboldtiana die Population im oberen Orinoko-System bezeichnet, während für die Tiere im Unterlauf vsl. ein anderer Name gefunden werden muss. Da aber erst noch weitere Analysen notwendig sind, werden hier noch beide Entwicklungslinien des Orinoko-Beckens unter humboldtiana zusammengefasst. Die Ergebnisse der morphologischen Untersuchungen von Cañizales (2020) und Emin-Lima et al. (2022) unterstützen ebenfalls eine Klassifizierung der Orinoko-Flussdelfine als eigenständige Art. Cañizales (2020) identifizierte zehn Schädelmerkmale, wodurch sich die Orinoko-Flussdelfine von Amazonas-Flussdelfinen unterscheiden lassen. Der wissenschaftliche Name humboldtiana verweist auf den preußischen Naturforscher und Entdecker Friedrich Wilhelm Heinrich Alexander von Humboldt.
· Identifizierung/Beschreibung: Gesamtlänge 184-227 cm; Gewicht bis 200 kg; 24-26 Zähne pro Reihe. Ähnlich wie I. boliviensis besitzt der Orinoko-Flussdelfin einen grazileren Schädel als I. geoffrensis. Im Gegensatz zur bolivianischen Art ist bei humboldtiana aber der Schädel allgemein kleiner. Möglicherweise handelt es sich um ein pädomorphes Taxon, d.h. juvenile Entwicklungsmerkmale bleiben im adulten Stadium erhalten. Auch insgesamt sind im Durchschnitt die Flussdelfine aus dem Orinoko kleiner als jene im Amazonas. Die von I. humboldtiana produzierten Klicklaute unterscheiden sich von jenen der Arten araguaiaensis und geoffrensis, wobei die Unterschiede zwischen Orinoko- und Amazonas-Flussdelfinen geringer sind als zwischen geoffrensis bzw. humboldtiana zu araguaiaensis (Melo et al., 2021). Die durchschnittliche Spitzenfrequenz von humboldtiana liegt bei 44 kHz.
· Biologie: Über die Fortpflanzung und Lebenserwartung ist wenig bekannt. Es liegen hauptsächlich Daten aus Haltung in menschlicher Obhut vor. Der Beginn sexueller Aktivitäten konnte im Aquarium von Valencia (Venezuela) bei Männchen im Alter von 9 bzw. 10 Jahren und einer Länge von 195 bzw. 210 cm beobachtet werden. Masturbation und Paarungen fanden das ganze Jahr über statt. Auch bei anderen Zahnwalarten sind Masturbation und Paarung üblich und wohl unabhängig von der hormonellen Aktivität. Aus dem Zoo Duisburg sind auch homosexuelle Verhaltensweisen bekannt, die vermutlich wie bei anderen Zahnwalen dominanzbezogen sind. Ein Weibchen in Valencia begann bereits mit zwei Jahren und einer Länge von 134 cm zu kopulieren. Üblicherweise beginnt die sexuelle Aktivität bei Weibchen wohl ähnlich wie bei geoffrensis ab einer Länge von 180-200 cm, wenngleich bei Tieren aus nordamerikanischer Haltung (1960-1969) für Weibchen eine sexuelle Reife ab 175-180 cm dokumentiert wurde. In Valencia erreichte ein Weibchen mit 9,3 Jahren, einer Länge von 179 cm und einem Gewicht von 75 kg die Geschlechtsreife, zwei weitere Weibchen mit 192 bzw. 198 cm Länge und 67,5 bzw. 81,5 kg Gewicht. Ca. 15 Tage vor der Geburt sind die vergrößerten Brustdrüsen erkennbar. Die Geburt dauerte im Aquarium durchschnittlich 2,75 Stunden. Die Nachgeburt erfolgte nach etwa drei Stunden. Die Neugeborenen waren zwischen 80 und 83,5 cm lang sowie 6,9-10 kg schwer. Häufig unterstützt das Muttertier nach der Geburt ihr Junges beim Erreichen der Wasseroberfläche, damit dieses mit dem Atmen beginnen kann. Nach ca. 30 Minuten begannen die Neugeborenen nach den Brustdrüsen zu suchen. Kleine Mengen Fisch wurden in Haltung ab einem Alter von fünf Monaten aufgenommen. Mit 15-18 Monaten (Körperlänge ca. 120-125 cm) war ein vollständiges Gebiss vorhanden. Die Überlebensrate von Kälbern lag im Aquarium von Valencia in den Jahren 1994-2009 bei 57%, was ähnlichen Werten entspricht, wie sie von anderen Zahnwalarten in der Natur bekannt sind. Die Todesfälle der Neugeborenen in Valencia waren auf unangemessenes mütterliches Verhalten zurückzuführen, wodurch es bei einem Jungtier zum Ertrinken kam und die anderen nicht ausreichend gesäugt wurden. In den ersten Jahrzehnten der Haltung von Flussdelfinen starben viele Tiere früh, da die hygienischen und technischen Bedingungen nicht optimal waren und es an Fachwissen fehlte. Mit heutigen Haltungsstandards ist ein hohes Alter möglich. So wurde ein Exemplar des Orinoko-Flussdelfins im Zoo Duisburg über 45 Jahre alt.
· Bestand: Nicht bewertet; von der IUCN noch als Synonym von geoffrensis gewertet; Population abnehmend.
· Verbreitung: Südamerika (Kolumbien; Venezuela).
·
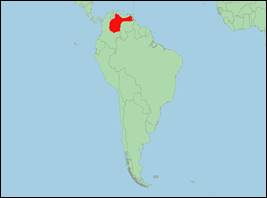
· Literatur: Boede et al. (2018); Cañizales (2020); Da Silva et al. (2023); Da Silva & Martin (2014, 2020); Emin-Lima et al. (2022); Gonçalves Farias (2015); Harrison & Brownell (1971); Martínez-Agüero, Flores-Ramírez & Ruiz-García (2010); McGuire & Aliaga-Rossel (2010); Melo et al. (2021); Pilleri & Gihr (1977); Ruiz-García, Banguera & Cardenas (2006); Siciliano et al. (2016); Sylvestre (1985); Vianna et al. (2010).
Referenzen:
1)
Agnarsson,
I.
& May-Collado, L. J. (2008).
The phylogeny of Cetartiodactyla: the importance of dense taxon sampling,
missing data, and the remarkable promise of cytochrombe b to provide reliable
species-level phylogenies. Molecular
Phylogenetics and Evolution 48
(3): 964-985.
2) Aliaga-Rossel,
E. (2002). Distribution and abundance of the
river dolphin (Inia geoffrensis) in
the Tijamuchi River, Beni, Bolivia. Aquatic
Mammals 28 (3): 312-323.
3) Aliaga-Rossel,
E. (2003). Current situation of the river dolphin (Inia geoffrensis) in Bolivia. Ecología en Bolivia 38 (2): 167-177.
4) Aliaga-Rossel,
E. (2010). Conservation of the River Dolphin (Inia boliviensis) in Bolivia. S. 55-70
in: Ruiz-Garcia, M. & Shostell, J. M.
(Hrsg.) (2010). Biology, Evolution and Conservation of River Dolphins within
South America and Asia. Nova Science
Publishers, New York.
5) Aliaga-Rossel,
E., Beerman, A. S. & Sarmiento, J. (2010). Stomach content of a juvenile Bolivian river
dolphin (Inia geoffrensis boliviensis)
from Upper Madeira Basin, Bolivia. Aquatic
Mammals 36 (3): 284-287.
6) Aliaga-Rossel,
E. & Escobar-Ww, M. (2020). Translocation of trapped Bolivian river
dolphins (Inia boliviensis). Journal of Cetacean Research and Management
21 (1): 17-23.
7) Aliaga-Rossel,
E. & Guizada, L. (2017). Encounter rates of the Bolivian river dolphin (Inia boliviensis) in northeastern
Bolivia. Latin American Journal of
Aquatic Mammals 12 (1-2): 45-49.
8) Aliaga-Rossel,
E., Guizada, L., Beerman, A. S., Alcocer, A. & Morales, C. (2012). Distribution and population status of the Bolivian river dolphin (Inia boliviensis) in four tributary
rivers of the Mamore River sub basin. Ecología
en Bolivia 47 (2): 134-142.
9) Aliaga-Rossel,
E. & Guizada Duran, L. A. (2020). Four decades of research on
distribution and abundance of the Bolivian river dolphin Inia geoffrensis boliviensis. Endangered
Species Research 42: 151-165.
10) Aliaga-Rossel,
E., McGuire, T. L. & Hamilton, H. (2006). Distribution
and encounter rates of the river dolphin (Inia
geoffrensis boliviensis) in the central Bolivian Amazon. Journal of Cetacean Research and Management
8 (1): 87-92.
11) Aliaga-Rossel,
E. & Quevedo A., S. (2011). The Bolivian river dolphin in the Tijamuchi and Ibare rivers
(Upper Madeira Basin) during the rainy season in “La Niña” event. Mastozoología Neotropical 18 (2): 293-299.
12) Ameghino, F.
(1891).
Caracteres diagnósticos de cincuenta especies nuevas de mamiferos fósiles
argentinos. Revista Argentina de Historia
Natural 1 (3): 129-167.
13) Araújo, C.
C. (2010). Distribuição e estimativas populacionais do
boto Inia geoffrensis (de Blainville, 1817) (Iniidae) no médio
Rio Araguaia (Brasil Central). MSc
Thesis, Instituto Nacional de Pesquisas da Amazônia, Manaus.
14)
Araújo, C. C. & da Silva, V. M. F. (2014).
Spatial distribution of river dolphins, Inia
geoffrensis (Iniidae), in the Araguaia River (central Brazil). Mammalia 78 (4): 481-486.
15) Araújo, C.
C. & Wang, J. Y. (2012). Botos (Inia geoffrensis) in
the upper reaches of the Tocantins River (Central Brazil) with observations of
unusual behavior, including object carrying. Aquatic Mammals 38 (4):
435-440.
16) Banguera-Hinestroza,
E., Cárdenas, H., Ruiz-García, Marmontel, M., Gaitán, E., Vázquez, R. &
García-Vallejo, F. (2002). Molecular identification
of evolutionarily significant units in the Amazon River dolphin Inia sp. (Cetacea: Iniidae). Journal of Heredity 93 (5): 312-322.
17)
Best, R. C. (1984). The aquatic mammals and reptilies of the Amazon. S. 371-412 in: Sioli, H. (Hrsg.) (1984). Monographiae
Biologica Volume 56: The Amazon – Limnology and landscape ecology of a mighty
tropical river and its basin. Dr. W. Junk
Publishers, Dordrecht.
18)
Best, R. C. & da Silva, V. M. F. (1993). Inia geoffrensis. Mammalian
Species 25 (426): 1-8.
19)
Boede, E. O., Mujica-Jorquera, E., Boede, F. &
Varela, C. (2018). Reproductive management of the Orinoco river
dolphin Inia geoffrensis humoldtiana
in Venezuela. International Zoo Yearbook
52: 245-257
20)
Bowler, M. T., Griffiths, B. M., Gilmore, M. P.,
Wingfield, A. & Recharte, M. (2018). Potentially infanticidal behavior in
the Amazon river dolphin (Inia geoffrensis). Acta
Ethologica 21 (2): 141-145.
21)
Burmeister, H. (1871). On Saurocetes argentinus, a new type of Zeuglodonitdae. Annals and Magazine of Natural History, 4th
Series 7 (37): 51-55.
22) Cañizales,
I. (2020). Morphology of the skull of Inia geoffrensis humboldtiana Pilleri & Gihr, 1977 (Cetacea:
Iniidae): A morphometric and taxonomic analysis. Graellsia 76 (2):
e115:1-22.
23) Castellanos-Mora,
L. F., Trujillo, F. & Ruiz-García, M. (2010). The Application of Equation Models to Determine the Age of Pink
River Dolphin Skulls. S. 83-99 in: Ruiz-Garcia,
M. & Shostell, J. M. (Hrsg.) (2010). Biology, Evolution and
Conservation of River Dolphins within South America and Asia. Nova Science Publishers, New York.
24)
Cozzuol, M. A. (2010). Fossil Record and the Evolutionary
History of Iniodea. S. 193-217 in: Ruiz-Garcia, M. & Shostell, J. M.
(Hrsg.) (2010). Biology, Evolution and Conservation of River Dolphins within
South America and Asia. Nova Science
Publishers, New York.
25) Cuvier, G. (1812). Rapport sur divers cetacés. Annales
du Musée d’Histoire Naturel de Paris 19:
10.
26) Cuvier, G. (1823). Recherches sur les ossements fossils, où l’on retablit les
caracteres de plusieurs animaux don’t les resolutions du globe ont detruit les
espéces. Tome Cinquième. G. Dufour et E.
D’Ocagne Libraires, Paris.
27) Daily, M. D.
(1971). A new species of Hunterotrema
(Digena: Campulidae) from the Amazon river dolphin (Inia geoffrensis). Bulletin of the Southern California Academy of Sciences 70 (2): 79-80.
28) Da Silva, V.
M. F., Brum, S. M., de Mello, D. M. D., Amaral, R. S., Gravena, W., Campbell,
E., Gonçalves, R. da S. & Mintzer, V J. (2023). The Amazon river dolphin, Inia geoffrensis: What have we learned
in the last two decades of research? Latin
American Journal of Aquatic Mammals 18
(1): 139-157.
29)
Da Silva, V. M. F. & Martin, A. R. (2014). Family Iniidae (Amazon River
Dolphins). S. 364-379 in: Wilson, D. E.
& Mittermeier, R. A. (Hrsg.) (2014). Handbook of the Mammals of the
World Volume 4 – Sea Mammals. Lynx
Edicions, Barcelona.
30)
Da Silva, V. M. F. & Martin, A. R. (2020). Family Iniidae (Amazon River
Dolphins). S. 290-291 in: Burgin, C. J., Wilson,
D. E. & Mittermeier, R. A., Rylands, A. B., Lacher, T. E. & Sechrest,
W. (Hrsg.) (2020). Illustrated Checklist of the Mammals of the World
Volume 2 – Eulipotyphla to Carnivora. Lynx
Edicions, Barcelona.
31) Da Silva,
V., Trujillo, F., Martin, A., Zerbini, A. N., Crespo, E., Aliaga-Rossel, E.
& Reeves, R. (2018). Inia geoffrensis. The IUCN Red List of Threatened Species 2018:
e.T10831A50358152.
http://dx.doi.org/10.2305/IUCN.UK.2018-2.RLTS.T10831A50358152.en. Stand 10.
Februar 2023.
32) De
Blainville, H. M. D. (1817). Dauphin de Geoffroy, Delphinus geoffrensis. Nouveau Dictionnaire d’Histoire Naturelle,
Appliquée aux Arts, à l’Agriculture, à l’Économie Rurale et Domestique, à la
Médecine, etc. 9: 151-152.
33)
Decker, J. E., Pires, J. C., Conant, G. C., McKay, S.
D., Heaton, M. P., Chen, K., Cooper, A., Vilkki, J., Seabury, C. M., Caetano,
A. R., Johnson, G. S., Brenneman, R. A., Hanotte, O., Eggert, L. S., Wiener,
P., K. J.-J., Kim, K. S., Sonstegard, T. S., Tassell, C. P., Neibergs, H. L.,
McEwan, J. C., Brauning, R., Coutinho, L. L., Babar, M. E., Wilson, G. A.,
McClure, M. C., Rolf, M. M., Kim, JW., Schnabel, R. D. & Taylor, J. F. (2009). Resolving the evolution of
extant and extinct ruminants with high-troughput phylogenomics. Proceedings of the National Academy of
Sciences 106 (44): 18644-18649.
34)
D’Orbigny, M. (1834). Notice sur un nouveau genre
de cetacé, des rivières du centre de l’Amerique meridionale. Nouveau Annales du Muséum d’Historie
Naturelle, Paris 3: 28-36.
35) Emin-Lima,
R., Machado, F. A., Siciliano, S., Gravena, W., Aliaga-Rossel, E., de Sousa e
Silva, J. Jr., Hingst-Zaher, E. & de Oliveira, L. R. (2022). Morphological disparity in the skull of Amazon River dolphins of
the genus Inia (Cetacea, Iniidae) is
inconsistent with a single taxon. Journal
of Mammalogy 103 (6): 1278-1289.
36)
Gervais, M. P. (1855). Description des trois
species de dauphins qui vivent dans la region du haut Amazone. S. 89-92 in: De Castelnau, F. (Hrsg.) (1855),
Expedition dans les parties centrales de l’Amerique du Sud, de Rio de Janeiro a
Lima et de Lima au Pará, Tome 7, Zoologie. P.
Bertrand Libraire-Éditeur, Paris.
37) Gonçalves Farias, J. (2015).
Filogeografía e genética de populações de Inia geoffrensis
(Cetartiodactyla: Iniidae) nos rios Negro e Branco e evidência de linhagem
evolutiva independente na bacia do Orinoco. PhD Thesis, Universidade Federal do
Amazonas, Manaus.
38)
Gravena, W., da Silva, V. M. F., da Silva, M. N. F.,
Farias, I. P. & Hrbek, T. (2015). Living between rapids:
Genetic structure and hybridization in botos (Cetacea: Iniidae: Inia spp.) of the Madeira River, Brazil.
Biological Journal of the Linnean Society
114 (4): 764-777.
39) Gravena, W.,
Farias, I. P., da Silva, M. N. F., da Silva, V. M. F. & Hrbek, T. (2014). Looking to the past and the future: Were the Madeira River
rapids a geographical barrier to the boto (Cetacea: Iniidae)? Conservation Genetics 15 (3): 619-629.
40)
Guizada, L. & Aliaga-Rossel, E. (2016). Abundance of the Bolivian
river dolphin (Inia boliviensis) in
Mamore River, Upper Madeira Basin. Aquatic
Mammals 42 (3): 330-338.
41)
Harrison, R. J. & Brownell, R. L. Jr. (1971). The gonads of the South
American dolphins Inia geoffrensis, Pontoporia blainvillei and Sotalia fluviatilis. Journal of Mammalogy 52 (2): 413-419.
42) Hrbek, T.,
da Silva, V. M. F., Dutra, N., Gravena, W., Martin, A. R. & Farias, I. P. (2014). A new species of river dolphin from Brazil or: How little do we
know our biodiversity. PLoS ONE 9 (1): e83623: 1-12. Doi
10.1371/journal.pone.0083623.
43) Martin, A.
R. & da Silva, V. M. F. (2008). Sexual dimorphism and body
scarring in the boto (Amazon river dolphin) Inia
geoffrensis. Marine Mammal Science
22 (1): 25-33.
44) Martin, A.
R. & da Silva, V. M. F. (2018). Reproductive parameters of the Amazon river dolphin or boto Inia geoffrensis (Cetacea: Iniidae); an evolutionary outlier bucks
no trends. Biological Journal of the
Linnean Society 123 (3):
666-676.
45) Martin, A.
R., da Silva, V. M. F. & Rothery, P. (2008). Object carrying as socio-sexual display in an
aquatic mammal. Biology Letters 4 (3): 243-245.
46) Martínez-Agüero,
M., Flores-Ramírez, S. & Ruiz-García, M. (2010). Amazon River Dolphin Polymorphism
and Population Differentiation of MHC Class II Peptides. S. 117-130 in: Ruiz-Garcia, M. & Shostell, J. M.
(Hrsg.) (2010). Biology, Evolution and Conservation of River Dolphins within
South America and Asia. Nova Science
Publishers, New York.
47) McGuire, T.
& Aliaga-Rossel, E. (2010). Seasonal Ecology of Inia in Three River Basins of South America
(Orinoco, Amazon, and Upper Madeira). S. 29-53 in: Ruiz-Garcia, M. & Shostell, J. M. (Hrsg.) (2010).
Biology, Evolution and Conservation of River Dolphins within South America and
Asia. Nova Science Publishers, New
York.
48)
Melo, J. F., Amorim, T. O. S., Paschoalini, M. &
Andriolo, A. (2021). The biosonar of the boto: Evidence of differences among species
of river dolphins (Inia spp.) from
the Amazon. PeerJ 9: e11105: 1-21. Doi
10.7717/peerj.11105.
49) Melo-Santos,
G., Figueiredo Rodrigues, A. L., Tardin, R. H., de Sá Maciel, I., Marmontel,
M., Da Silva, M. L., MayCollado, L. J. (2019). The newly described Araguaian river dolphins, Inia araguaiaensis (Cetartiodactyla,
Iniidae), produce a diverse repertoire of acoustic signals. PeerJ 7: e6670: 1-20. Doi 10.717/peerj.6670.
50) Melo-Santos,
G., Walmsley, S. F., Marmotel, M., Oliveira-da-Costa, M., Janik, V. M. (2020). Repeated downsweep vocalizations of the Araguaian river dolphin,
Inia araguaiensis. The Journal of the Acoustical Society of
America 147 (2): 748-756.
51) Paschoalini,
M., Almeida, R. M., Trujillo, F., Melo-Santos, G., Marmontel, M., Pavanato, H.
J., Mosquera Guerra, F., Ristau, N. & Zerbini, A. N. (2020). On the brink of isolation: Population estimates of the
Araguaian river dolphin in a human-impacted region in Brazil. PLoS ONE 15 (4): e0231224: 1-17. Doi 10.1371/journal.pone.0231224.
52)
Pilleri, G. (1977). Trematodes in the eye of Inia boliviensis? Investigations on Cetacea 8:
255-256.
53) Pilleri, G.
& Gihr, M. (1977). Observations on the Bolivian
(Inia boliviensis d’Orbigny, 1834) and the Amazonian bufeo
(Inia geoffrensis de Blainville, 1817), with description
of a new subspecies (Inia geoffrensis
humboldtiana). Investigations on
Cetacea 8: 11-76.
54) Pivari, D.,
Pacca, H. M., Sebrian, T. d. C. G. (2017). Occurrence of
boto-de-Araguaia (Inia araguaiaensis)
in a region of the Araguaia River, Brazil, documented for an environmental
impact study for a hydroelectric dam. Aquatic
Mammals 43 (5): 530-536.
55)
Pivari, D., Pagliani, B., Lemos, L., Lima, D.,
Gravena, W. (2021). Monitoring a critical
population of the Bolivian river dolphin, Inia
boliviensis, before and after closing the floodgates of a hydroelectric dam
in the Amazon Basin, Brazil: A quantitative analysis. Journal for Nature Conservation 64: 126082: 1-8.
56)
Price, S. A., Bininda-Emonds, O. R. P. &
Gittleman, J. L.
(2005). A complete phylogeny of the whales, dolphins
and even-toed hoofed mammals (Cetartiodactyla). Biological Reviews 80
(3): 445-473.
57)
Prothero, D. R. & Foss, S. E. (2007). The evolution of
Artiodactyls. The John Hopkins University
Press, Baltimore.
58)
Ropiquet, A., Li, B. & Hassanin, A. (2009). SuperTRI: A new approach based on branch
support analyses of multiple independent data sets for assessing reliability of
phylogenetic inferences. Comptes Rendus
Biologies 332 (9): 832-847.
59)
Ruiz-García, M. (2010). Micro-Geographical Genetic
Structure of Inia geoffrensis in the
Napo-Curaray River Basin by Means of Chesser’s Models. S. 131-160 in: Ruiz-Garcia, M. & Shostell, J. M.
(Hrsg.) (2010). Biology, Evolution and Conservation of River Dolphins within
South America and Asia. Nova Science
Publishers, New York.
60)
Ruiz-García, M. (2010). Changes in the Demographic Trends
of Pink River Dolphin (Inia) at the
Microgeographical Level in Peruvian and Bolivian Rivers and Within the Upper
Amazon: Microsatellites and MtDNA Analyses and Insights into Inia’s Origin. S. 161-192 in: Ruiz-Garcia, M. & Shostell, J. M.
(Hrsg.) (2010). Biology, Evolution and Conservation of River Dolphins within
South America and Asia. Nova Science
Publishers, New York.
61)
Ruiz-García, M., Banguera, E. & Cardenas, H. (2006). Morphological analysis of
three Inia (Cetacea: Iniidae)
populations from Colombia and Bolivia. Acta
Theriologica 51 (4): 411-426.
62)
Ruiz-García, M., Escobar-Armel, P., De Thoisy, B.,
Martínez-Agüero, M., Pinedo-Castro, M. & Shostell, J. M. (2018). Biodiversity in the Amazon:
Origin hypotheses, intrinsic capacity of species colonization, and comparative
phylogeography of river otters (Lontra
longicaudis and Pteronura
brasiliensis, Mustelidae, Carnivora) and pink river dolphins (Inia sp., Iniidae, Cetacea). Journal of
Mammalian Evolution 25 (2): 213-340.
63) Siciliano,
S., Valiati, V. H., Emin-Lima, R., Costa, A. F., Sartor, J., Dorneles, T., de
Sousa e Silva, J. Jr. & de Oliveira, L. R. (2016). New genetic data extend the range of river dolphins Inia in the Amazon Delta. Hydrobiologia 777: 255-269.
64) Smith, T. D.
& Burrows, A. M. (2010). Mobility of the Axial
Regions in a Captive Amazon River Dolphin (Inia
geoffrensis). S. 71-81 in: Ruiz-Garcia,
M. & Shostell, J. M. (Hrsg.) (2010). Biology, Evolution and
Conservation of River Dolphins within South America and Asia. Nova Science Publishers, New York.
65) Sylvestre,
J.-P. (1985). Some observations on behaviour of two Orinoco dolphins (Inia geoffrensis humboldtiana, Pilleri and Gihr 1977), in captivity, at
Duisburg Zoo. Aquatic Mammals 11 (2): 58-65.
66) Vianna, J.
A., Hollatz, C., Marmontel, M., Redondo, R. A. F. & Santos, F. R. (2010). Amazon River Dolphin: High Phylopatry Due to Restricted
Dispersion at Large and Short Distances. S. 101-116 in: Ruiz-Garcia, M. & Shostell, J. M. (Hrsg.) (2010).
Biology, Evolution and Conservation of River Dolphins within South America and
Asia. Nova Science Publishers, New
York.
67)
Von Spix, J. B. & von Martius, C. F. (1831). Reise in Brasilien auf
Befehl Seiner Majestät Maximilian Joseph I., Königs von Baiern, in den Jahren
1817 bis 1820. Dritter und letzter Theil. Dr.
C. F. P. von Martius, München.
Letztes Update
23.02.2024