System der
Lebewesen (Stefan Hintsche
2023)
Choanata > Tetrapoda > Amniota > Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia
|
|
|
|
|
|
|
Dasyuromorphia
|
|
|||
|
|
|
|||
|
|
|
|||
|
|
|
|||
|
|
|
|
|
Ordo Dasyuromorphia Gill, 1872 (Ordnung Raubbeutlerartige):
· 86 Arten, davon eine ausgestorben. Der Stammbaum basiert auf den Ergebnissen von Westerman et al. (2016).
· Synonyme: Dasyuroidea; Dasyuriformes; Creatophaga.
· Literatur: Gill (1872); Westerman et al. (2016).
†Familia
Thylacinidae C.
L. Bonaparte, 1838 (Familie
Beutelwölfe):
· Eine ausgestorbene Art; nominotypische Gattung Thylacinus Temminck, 1824; nominotypische Art Thylacinus cynocephalus (Harris, 1808).
· Literatur: Bonaparte (1838); Groves (2005); Harris (1808); Jackson & Groves (2015).
Familia Dasyuridae Goldfuß, 1820
(Familie Raubbeutler):
· 84 Arten; nominotypische Gattung Dasyurus É. Geoffroy Saint-Hilaire, 1796; nominotypische Art Dasyurus maculatus (Kerr, 1792). Der Stammbaum basiert auf den Ergebnissen von Westerman et al. (2016).
· Taxonomie: Der ursprüngliche Name Dasyurini/Dosyurini wurde von Waterhouse (1838) in Dasyuridae umgewandelt. Es findet sich in der neueren Literatur entweder eine Einteilung in die zwei Unterfamilien Dasyurinae und Sminthopsinae mit jeweils zwei Gattungsgruppen Dasyurini und Phascogalini bzw. Sminthopsini und Planigalini (Kealy & Beck, 2017; Westerman et al., 2016) oder eine Einteilung in die vier Unterfamilien Dasyurinae, Phascogalinae, Planigalinae und Sminthopsinae ohne eine weitere Unterteilung in Gattungsgruppen (AMTC, 2022; Jackson & Groves, 2015). Nach molekularbiologischen Analysen von Westerman et al. (2016) splitteten sich die Raubbeutler vor ca. 29,3 Millionen Jahren in eine Flachkopf-/Schmalfußbeutelmäuse-Linie und eine Beutelmarder/Breitfußbeutelmäuse-Linie. Beutelmarder und Breitfußbeutelmäuse trennten sich dann vor ca. 24,5 Millionen Jahren, Flachkopfbeutelmäuse und Schmalfußbeutelmäuse vor ca. 24,1 Millionen Jahren. Mitchell et al. (2014) und Kealy & Beck (2017) kommen bei ihren Untersuchungen im Schnitt zu etwas kürzer zurückliegenden Divergenzzeitpunkten. Trotzdem liegt nach bisherigen Erkenntnissen eine im Vergleich zu anderen Säugetierfamilien frühzeitige Aufspaltung vor, besonders bei Berücksichtigung der Generationszeiten der in den Dasyuridae enthaltenen Arten, weshalb hier der Einteilung in vier Unterfamilien gefolgt wird.
· Literatur: AMTC (2022); Geoffroy Saint-Hilaire (1796); Goldfuß (1820); Jackson & Groves (2015); Kealy & Beck (2017); Mitchell et al. (2014); Waterhouse (1838); Westerman et al. (2016).
Familia Myrmecobiidae Waterhouse, 1841
(Familie Ameisenbeutler):
· 1 Art; nominotypische Gattung Myrmecobius Waterhouse, 1836; nominotypische Art Myrmecobius fasciatus Waterhouse, 1836.
· Literatur: Waterhouse (1836, 1841).
Amniota > Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Thylacinidae > Thylacinus
|
†Thylacinidae |
|
†Thylacinus |
|
|
|
|
|
†Familia
Thylacinidae C.
L. Bonaparte, 1838 (Familie
Beutelwölfe):
· Eine ausgestorbene Art; nominotypische Gattung Thylacinus Temminck, 1824; nominotypische Art Thylacinus cynocephalus (Harris, 1808).
· Literatur: Bonaparte (1838); Groves (2005); Harris (1808); Jackson & Groves (2015).
†Genus
Thylacinus Temminck, 1824 (Gattung Tasmanische Beutelwölfe):
· Eine ausgestorbene Art; Generotypus Thylacinus cynocephalus (Harris, 1808).
· Synonyme: Lycaon Wagler, 1830 (von Thomas (1888) synonymisiert); Paracyon Gray, 1843 (von Waterhouse (1846) synonymisiert); Peralopex Gloger, 1841 (von Thomas (1888) synonymisiert).
· Literatur: Gloger (1841); Gray (1843); Groves (2005); Harris (1808); Jackson & Groves (2015); Temminck (1824); Thomas (1888); Wagler (1830); Waterhouse (1846).
†Thylacinus cynocephalus (Harris, 1808) (Tasmanischer Beutelwolf/Tasmanian Wolf):
· Holotypus/Terra typica: Männchen, gesammelt nahe des höchsten Bereichs des Berglands von Tasmanien (damalige Bezeichnung Van-Diemen-Land), Australien.
· Taxonomie/Etymologie: Ursprünglich als Didelphis cynocephala beschrieben und von J. Fischer (1829) in die Gattung Thylacinus gestellt. Das Artepitheton leitet sich von den beiden griechischen Wort κύων für „Hund“ und κεφαλή für „Kopf“ ab und bezieht sich auf die hundeähnliche Kopfform des Beutelwolfs. Die Art gilt als monotypisch.
· Synonyme: Thylacinus breviceps Krefft, 1868 (Terra typica: Ouse-Fluss, Tasmanien, Australien; von Thomas (1888) synonymisiert); Thylacinus communis Anon, 1859 (von Mahoney & Ride (1988) synonymisiert); Thylacinus harrisii Temminck, 1824 (Terra typica: Tasmanien, Australien; von Waterhouse (1941) synonymisiert; Dasyurus lucocephalus Grant, 1831 (Terra typica: Tasmanien, Australien; von Thomas (1888) synonymisiert); Thylacinus major Owen, 1877 (Terra typica: Wellington-Höhlen, bei Wellington, Neusüdwales, Australien; von Dawson (1982) synonymisiert); Thylacinus rostralis De Vis, 1893 (Terra typica: Ellangowan, nahe Cambooya, Queensland, Australien; von Dawson (1982) synonymisiert); Thylacinus spelaeus Owen, 1845 (Terra typica: Wellington-Tal, Neusüdwales, Australien; von Lydekker (1887) synonymisiert; Thylacinus striatus Warlow, 1833 (Terra typica: Tasmanien, Australien; von Thomas (1888) synonymisiert).
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge 85-130 cm; Schwanzlänge 33-65 cm; Gewicht 15-45 kg; 46 Zähne (I 4/3 C 1/1 P 3/3 M 4/4).
· Biologie: Fortpflanzung fand ganzjährig statt. Nach einer Tragzeit von einem Monat wurden 2-3 Jungtiere, selten 4 geboren und dann für ca. drei Monate im Beutel getragen. Beutelwölfe wurden entweder einzeln oder in kleine Gruppen, die aus einem Paar und ihrem Nachwuchs bestanden, gesichtet. Die Nahrung bestand hauptsächlich aus Kleinsäugern und Vögeln.
· Bestand: Ausgestorben (seit ca. 1936). Vor mindestens 2.000 Jahren auch in Neuguinea und Australien ausgestorben, vermutlich aufgrund Konkurrenz und Prädation durch Dingos.
· Verbreitung: Ozeanien (ehemals Australien: Tasmanien).
· Literatur: Anon (1859); Baker & Gynther (2023); Burbidge & Woinarski (2016); Dawson (1982); De Vis (1893, 1894); Fischer (1829); Grant (1831); Groves (2005); Harris (1808); Helgen & Veatch (2015); Hughes (2000); Jackson & Groves (2015); Krefft (1868); Mahoney & Ride (1988); Owen (1845, 1877); Temminck (1824); Thomas (1888); Warlow (1833); Waterhouse (1941).
Tetrapoda > Amniota > Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
||
|
Dasyuridae |
|
|
|
|
|
|
|
|
||
|
|
|
|
||
|
|
|
|
||
|
|
|
|
|
Familia Dasyuridae Goldfuß, 1820
(Familie Raubbeutler):
· 84 Arten; nominotypische Gattung Dasyurus É. Geoffroy Saint-Hilaire, 1796; nominotypische Art Dasyurus maculatus (Kerr, 1792). Der Stammbaum basiert auf den Ergebnissen von Westerman et al. (2016).
· Taxonomie: Der ursprüngliche Name Dasyurini/Dosyurini wurde von Waterhouse (1838) in Dasyuridae umgewandelt. Es findet sich in der neueren Literatur entweder eine Einteilung in die zwei Unterfamilien Dasyurinae und Sminthopsinae mit jeweils zwei Gattungsgruppen Dasyurini und Phascogalini bzw. Sminthopsini und Planigalini (Kealy & Beck, 2017; Westerman et al., 2016) oder eine Einteilung in die vier Unterfamilien Dasyurinae, Phascogalinae, Planigalinae und Sminthopsinae ohne eine weitere Unterteilung in Gattungsgruppen (Baker & Gynther, 2023; Jackson & Groves, 2015). Nach molekularbiologischen Analysen von Westerman et al. (2016) splitteten sich die Raubbeutler vor ca. 29,3 Millionen Jahren in eine Flachkopf-/Schmalfußbeutelmäuse-Linie und eine Beutelmarder/Breitfußbeutelmäuse-Linie. Beutelmarder und Breitfußbeutelmäuse trennten sich dann vor ca. 24,5 Millionen Jahren, Flachkopfbeutelmäuse und Schmalfußbeutelmäuse vor ca. 24,1 Millionen Jahren. Mitchell et al. (2014) und Kealy & Beck (2017) kommen bei ihren Untersuchungen im Schnitt zu etwas kürzer zurückliegenden Divergenzzeitpunkten. Trotzdem liegt nach bisherigen Erkenntnissen eine im Vergleich zu anderen Säugetierfamilien frühzeitige Aufspaltung vor, besonders bei Berücksichtigung der Generationszeiten der in den Dasyuridae enthaltenen Arten, weshalb hier der Einteilung in vier Unterfamilien gefolgt wird.
· Literatur: Baker & Gynther (2023); Geoffroy Saint-Hilaire (1796); Goldfuß (1820); Jackson & Groves (2015); Kealy & Beck (2017); Mitchell et al. (2014); Waterhouse (1838); Westerman et al. (2016).
Subfamilia Dasyurinae Goldfuß, 1820
(Unterfamilie Beutelmarder):
· 25 Arten; nominotypische Gattung Dasyurus É. Geoffroy Saint-Hilaire, 1796; nominotypische Art Dasyurus maculatus (Kerr, 1792). Stammbaum basiert auf den Ergebnissen von Westerman et al. (2016), Westerman, Young & Krajewski (2007) und Westerman, Loke & Tan (2022).
· Taxonomie: Die ursprüngliche Bezeichnung Dasyurini/Dosyurini wurde von Thomas (1888) als Unterfamilie Dasyurinae verwendet. Zum Teil wird die Unterfamilie in zwei Gattungsgruppen Dasyurini und Phascogalini unterteilt. Die Phascogalini sind hier aber im Rang einer eigenen Unterfamilie Phascogalinae eingestuft.
· Literatur: Geoffroy Saint-Hilaire (1796); Goldfuß (1820); Kerr (1792); Thomas (1888); Westerman et al. (2016); Westerman, Loke & Tan (2022); Westerman, Young & Krajewski (2007).
Subfamilia Phascogalinae Gill, 1872 (Unterfamilie Breitfußbeutelmäuse):
· 29 Arten; nominotypische Gattung Phascogale Temminck, 1824; nominotypische Art Phascogale tapoatafa (F. Meyer, 1793), ursprünglich Phascogale penicillata (Shaw, 1800), gilt aber als Synonym von tapoatafa. Der Stammbaum basiert auf den Ergebnissen von Westerman et al. (2016).
· Literatur: Gill (1872); Meyer (1793); Shaw (1800); Temminck (1824); Westerman et al. (2016).
Subfamilia Planigalinae Archer,
1982 (Unterfamilie
Flachkopfbeutelmäuse):
· 5 Arten.
· Literatur: Archer (1982).
Subfamilia Sminthopsinae Archer, 1982 (Unterfamilie Schmalfußbeutelmäuse):
· 26 Arten. Der Stammbaum basiert auf den Ergebnissen von Westerman et al. (2016).
· Literatur: Archer (1982); Westerman et al. (2016).
Amniota > Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Dasyurinae
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||
|
|
|||||||
|
|
|
||||||
|
|
|
|
|
||||
|
Dasyurinae |
|
|
|
|
|||
|
|
|
||||||
|
|
|
|
|
|
|||
|
|
|
|
|||||
|
|
|
||||||
|
|
|
|
|
||||
|
|
|
|
|
|
|||
|
|
|
|
|||||
|
|
|
|
|||||
|
|
|
|
|||||
|
|
|
|
|||||
|
|
|
|
|||||
|
|
|
|
|||||
|
|
|
|
|
|
|
|
Subfamilia Dasyurinae Goldfuß, 1820
(Unterfamilie Beutelmarder):
· 25 Arten; nominotypische Gattung Dasyurus É. Geoffroy Saint-Hilaire, 1796; nominotypische Art Dasyurus maculatus (Kerr, 1792). Stammbaum basiert auf den Ergebnissen von Westerman et al. (2016), Westerman, Young & Krajewski (2007) und Westerman, Loke & Tan (2022).
· Literatur: Geoffroy Saint-Hilaire (1796); Goldfuß (1820); Kerr (1792); Westerman et al. (2016); Westerman, Loke & Tan (2022); Westerman, Young & Krajewski (2007).
Genus Dasyurus
É. Geoffroy, 1796 (Gattung Echte Beutelmarder):
· 6 Arten; Generotypus Dasyurus maculatus (Kerr, 1792). Der Stammbaum orientiert sich an den Ergebnissen von Woolley, Krajewski & Westerman (2015) und Firestone (2000).
· Literatur: Firestone (2000); Geoffroy Saint-Hilaire (1796); Kerr (1792); Woolley, Krajewski & Westerman (2015).
Genus Sarcophilus
F. G. Cuvier, 1837 (Gattung Beutelteufel):
· 1 Art; Generotypus Sarcophilus harrisii (Boitard, 1841).
· Taxonomie: Die Gattung Sarcophilus bildet nach genetischen Analysen das Schwestertaxon zu den Beutelmardern der Gattung Dasyurus.
· Literatur: Boitard (1841); Cuvier (1837).
Genus Neophascogale
Stein, 1933 (Gattung Spitzhörnchenbeutler):
· 1 Art; Generotypus Neophascogale lorentzi (Jentink, 1911).
· Literatur: Jentink (1911); Stein (1933).
Genus Phascolosorex
Matschie, 1916 (Gattung Streifenbeutelmäuse):
· 3 Arten.
Genus Pseudantechinus
Tate, 1947
(Gattung Fettschwanzbeutelmäuse):
· 5 Arten; Generotypus Pseudantechinus macdonnellensis (Spencer, 1895). Stammbaum nach den Ergebnissen von Umbrello, Woolley & Westerman (2018) und Westerman, Young & Krajewski (2007).
· Literatur: Spencer (1895); Tate (1947); Umbrello, Woolley & Westerman (2018); Westerman, Young & Krajewski (2007).
Genus Dasycercus
Peters, 1875
(Gattung Kammschwanz-Beutelmäuse):
· 2 Arten; Generotypus Dasycercus cristicauda (Krefft, 1867).
· Synonyme: Chaetocercus Krefft, 1867.
· Literatur: Krefft (1867); Peters (1875).
Genus Dasyuroides
Spencer, 1896 (Gattung Doppelkammbeutelmäuse):
· 1 Art.
Genus Dasykaluta
Archer, 1982 (Gattung Rote Breitfußbeutelmäuse):
· 1 Art.
Genus Myoictis
Gray, 1858 (Gattung Streifenbeutelmarder):
· 4 Arten.
Genus Parantechinus
Tate, 1947 (Gattung Sprenkelbeutelmäuse):
· 1 Art.
Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Dasyurinae > Dasyurus
|
|
|
|
|
|
|
|
|
|
Dasyurus |
|
|
|
||||
|
|
|
|
|
|
|
||
|
|
|
|
|||||
|
|
|
|
|
|
|
||
|
|
|
|
|||||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
Genus Dasyurus
É.
Geoffroy Saint-Hilaire, 1796 (Gattung
Echte Beutelmarder):
· 6 Arten; Generotypus Dasyurus maculatus (Kerr, 1792). Der Stammbaum orientiert sich an den Ergebnissen von Kealy & Beck (2017), Woolley, Krajewski & Westerman (2015) und Firestone (2000).
· Taxonomie: Die Gattung Dasyurus bildet nach genetischen Analysen das Schwestertaxon zu den Beutelteufeln (Sarcophilus).
· Literatur: Firestone (2000); Geoffroy Saint-Hilaire (1796); Kealy & Beck (2017); Kerr (1792); Woolley, Krajewski & Westerman (2015).
Dasyurus hallucatus Gould, 1842 (Zwergbeutelmarder/Northern
Quoll):
· Alternative Bezeichnung: Nördlicher Beutelmarder.
· Bestand: Stark gefährdet; Population abnehmend.
· Verbreitung: Ozeanien (Australien: Westaustralien, Nördliches Territorium, Queensland).
· Literatur: Baker (2015, 2020); Gould (1842); Oakwood (2000); Oakwood, Woinarski & Burnett (2016).
Dasyurus maculatus (Kerr,
1792) (Riesenbeutelmarder/Tiger
Quoll):
· Alternative Bezeichnung: Fleckenbeutelmarder.
· Terra typia: Port Jackson, Neusüdwales, Australien.
· Taxonomie/Etymologie: Zunächst als Viverra maculata beschrieben und von Fischer von Waldheim (1813) schließlich in die Gattung Dasyurus gestellt. Die Gültigkeit der gelisteten Unterart gracilis ist fraglich und konnte in den Analysen von Firestone (1999) und Firestone et al. (1999) nicht bestätigt werden. Stattdessen scheint die Population auf Tasmanien eine eigene Unterart oder Art darzustellen. Möglicherweise wäre dann für die tasmanische Form Dasyurus bowlingi Spencer & Kershaw, 1910 der zu verwendende Artname. Dieses Taxon wurde zwar anhand von subfossilem Schädelmaterial auf der King-Insel zunächst als eigene Art beschrieben, aber von Hope (1972) bzw. Marshall & Hope (1973) mit Dasyurus maculatus synonymisiert. Das aus dem Latein stammende Artepitheton maculatus bedeutet „gefleckt“ und bezieht sich auf das oberseits gefleckte Fell der Tiere.
·
Unterarten:
1. D. maculatus maculatus (Kerr, 1792) (Westlicher Fleckenbeutelmarder/Western Spotted-tailed
Quoll).
2. D. maculatus gracilis Ramsay, 1888 (Queensland-Fleckenbeutelmarder/Queensland Spotted-tailed Quoll).
· Bestand: Potenziell gefährdet (Vorwarnliste); Population abnehmend.
· Verbreitung: Ozeanien (Australien: Queensland, Neusüdwales, Viktorien, Tasmanien).
· Literatur: Baker (2015, 2020); Belcher (1995); Burnett & Dickman (2018); Firestone (1999); Firestone et al. (1999); Fischer von Waldheim (1813); Glen & Dickman (2006a, b); Hope (1972); Jones, Rose & Burnett (2001); Kerr (1792); Marshall & Hope (1973); Ramsay (1888); Spencer & Kershaw (1910).
Dasyurus viverrinus (Shaw,
1800) (Tüpfelbeutelmarder/Eastern
Quoll):
· Taxonomie/Etymologie: Ursprünglich als Didelphis viverrina beschrieben, überführte É. Geoffroy Saint-Hilaire (1804) die Art in die Gattung Dasyurus. Das Artepitheton viverrinus leitet sich vom wissenschaftlichen Namen Viverra für die Gattung der Asiatischen und bedeutet dementsprechend „Zibetkatzen-ähnlich“.
· Bestand: Stark gefährdet; Population abnehmend.
· Verbreitung: Ozeanien (Australien: Tasmanien, in Neusüdwales, Südaustralien und Viktorien ausgestorben).
· Literatur: Baker (2015, 2020); Burbidge & Woinarski (2016); Dorph & McDonald (2017); Geoffroy Saint-Hilaire (1804); Shaw (1800).
Dasyurus albopunctatus Schlegel, 1880 (Neuguinea-Beutelmarder/New
Guinean Quoll):
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge 231-298 mm; Schwanzlänge 221-290 mm; Hinterfußlänge 43-54 mm; Gewicht 580-710 g.
· Biologie: Geburten finden das ganze Jahr über statt, Wurfgröße 4-6 Jungen.
· Bestand: Potenziell gefährdet (Vorwarnliste); Population abnehmend.
· Synonyme: Dasyurus fuscus Milne-Edwards, 1880; Dasyurus daemonellus O. Thomas, 1904.
· Verbreitung: Ozeanien (Indonesien: Westpapua, Yapen, auf den Aru-Inseln evtl. eingeführt; Papua-Neuguinea).
· Literatur: Baker (2015, 2020); Flannery (1995); Lavery & Flannery (2023); Schlegel (1880); Woolley et al. (2016).
Dasyurus geoffroii Gould, 1841 (Schwarzschwanz-Beutelmarder/Western
Quoll):
· Holotypus/Terra typica: Liverpool-Ebene, Neusüdwales, Australien.
·
Unterarten:
1. D. geoffroii geoffroi Gould, 1841
(Geoffroy-Beutelmarder/Goeffroy’s Quoll).
2. D. geoffroi fortis Thomas, 1906 (Westlicher Beutelmarder/Southwestern Quoll). Holotypus/Terra typica: Gesammelt am Arthur-Fluss, nahe Wagin, Westaustralien, Australien.
· Bestand: Potenziell gefährdet (Vorwarnliste); Population stabil.
· Verbreitung: Ozeanien (Australien: Westaustralien).
· Literatur: Baker (2015, 2020); Glen et al. (2009); Gould (1841); Serena & Soderquist (1989); Soderquist & Serena (2000); Strahan (1983); Thomas (1906); Van Dyck, Gynther & Baker (2013); Woinarski & Burbidge (2019).
Dasyurus spartacus Van Dyck, 1988 (Bronzefarbener
Beutelmarder/Bronze Quoll):
· Alternative Bezeichung: Bronzequoll.
· Holotypus/Terra typica: PM22000 (Nationalmuseum und Kunstgalerie Papua-Neuguinea Boroko), adultes Männchen, gesammelt am 11. April 1973 von J. Waithman am Morehead, Trans-Fly-Ebene, Papua-Neuguinea.
· Taxonomie/Etymologie: Nach morphologischen Merkmalen bestehen Ähnlichkeiten mit der Art D. albopunctatus, die ebenfalls auf Neuguinea vorkommt. Genetische Analysen legen hingegen eine enge Verwandtschaft zu geoffroii nahe (Firestone, 2000). Nach den Ergebnissen von Woolley, Krajewski & Westerman (2015) ist geoffroi bzgl. spartacus sogar paraphyletisch. Zur Klärung sind weitere Untersuchungen notwendig. Die Art wurde nach dem thrakischen Gladiator Spartacus benannt, da sie nach der Meinung von Van Dyck die Eigenschaften Kraft, zäher Kampfgeist und die Fähigkeit Blut zu vergießen mit Spartacus teilt.
· Bestand: Potenziell gefährdet (Vorwarnliste); Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Indonesien: Westpapua; Papua-Neuguinea).
· Literatur: Baker (2015, 2020); Firestone (2000); Flannery (1995); Leary et al. (2016); Van Dyck (1988); Woolley, Krajewski & Westerman (2015).
Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Dasyurinae > Sarcophilus
|
Sarcophilus |
|
|
|
|
Genus Sarcophilus
F. G. Cuvier, 1837 (Gattung Beutelteufel):
· 1 Art; Generotypus Sarcophilus harrisii (Boitard, 1841).
· Taxonomie: Die Gattung Sarcophilus bildet nach genetischen Analysen das Schwestertaxon zu den Beutelmardern der Gattung Dasyurus.
· Literatur: Boitard (1841); Cuvier (1837).
Sarcophilus harrisii (Boitard,
1841) (Tasmanischer
Beutelteufel/Tasmanian Devil):
· Holotypus/Terra typica: Tasmanien, Australien.
· Taxonomie/Etymologie: Die Art wurde bereits von Harris (1808) als Didelphis ursina beschrieben. Da aber der Wombat zu diesem Zeitpunkt bereits den Namen Didelphis ursina Shaw, 1800 innehatte, wurde stattdessen auf den von Boitard (1841) verwendeten Namen Ursinus harrisii ausgewichen.
· Synonyme: Didelphis ursina Harris, 1808 (Terra typica: Tasmanien, Australien).
· Bestand: Stark gefährdet; Population abnehmend; Europäisches Erhaltungszuchtprogramm (EEP) koordiniert vom Zoo Kopenhagen.
· Verbreitung: Ozeanien (Australien: Tasmanien).
· Literatur: Baker (2015, 2020); Boitard (1841); Harris (1808); Hawkins et al. (2008); Shaw (1800).
Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Dasyurinae > Neophascogale
|
Neophascogale |
|
|
|
|
Genus Neophascogale
Stein, 1933 (Gattung Spitzhörnchenbeutler):
· 1 Art; Generotypus Neophascogale lorentzi (Jentink, 1911).
· Literatur: Jentink (1911); Stein (1933).
Neophascogale lorentzi (Jentink, 1911) (Neuguinea-Spitzhörnchenbeutler/Speckled
Dasyure):
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Indonesien: Westpapua; Papua-Neuguinea).
· Literatur: Baker (2015, 2020); Jentink (1911); Woolley et al. (2016).
Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Dasyurinae > Phascolosorex
Genus Phascolosorex
Matschie, 1916 (Gattung Streifenbeutelmäuse):
· 3 Arten.
· Literatur: Matschie (1916).
Phascolosorex doriae (Thomas, 1886) (Orangebauch-Streifenbeutelmaus/Red-bellied Marsupial Shrew):
· Alternative Bezeichnung: Rotbauch-Streifenbeutelmaus.
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Indonesien: Westpapua).
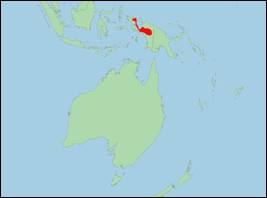
· Literatur: Flannery (1995); Thomas (1886); Westerman, Loke & Tan (2022); Woolley et al. (2016).
Phascolosorex brevicaudata Rothschild
& Dollman, 1932 (Kurzschwanz-Streifenbeutelmaus/Short-tailed
Marsupial Shrew):
· Taxonomie: Ursprünglich als separate Art beschrieben, wird das Taxon meist als Unterart oder Synonym von P. dorsalis gelistet, Helgen (2007a, b) wertet brevicaudata hingegen als eigenständige Art mit dem Taxon whartoni als Unterart und laut Baker (2015) scheinen genetische und morphologische Studien dies auch zu unterstützen.
·
Unterarten:
1. P. brevicaudata brevicaudata Rothschild & Dollman, 1932
(Westliche Kurzschwanz-Streifenbeutelmaus/Western Short-tailed Marsupial
Shrew).
2. P. brevicaudata whartoni (Tate & Archbold, 1936) (Östliche Kurzschwanz-Streifenbeutelmaus/Eastern Short-tailed Marsupial Shrew). Holotypus/Terra typica: AMNH 104046 (Amerikanisches Museum für Naturgeschichte New York), adultes Männchen, gesammelt am 23. Mai 1932 von Richard Archbold und A. L. Rand am Osthang des Bergs Tafa (Höhe 2.070 m), Zentralprovinz von Papua-Neuguinea. Ursprünglich als Phascogale (Phascolosorex) dorsalis whartoni beschrieben. Das Unterartepitheton leitet sich von der Wharton-Gebirgskette ab, in der Exemplare der Art gesammelt wurden.
· Bestand: Nicht bewertet; von IUCN noch als Synonym von Phascolosorex dorsalis behandelt.
· Verbreitung: Ozeanien (Indonesien: Westpapua; Papua-Neuguinea).
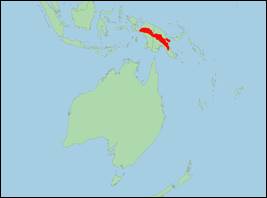
· Literatur: Baker (2015, 2020); Helgen (2007a, b); Rothschild & Dollman (1932); Tate & Archbold (1936); Woolley et al. (2016).
Phascolosorex dorsalis (Peters
& Doria, 1876) (Braunbauch-Streifenbeutelmaus/Narrow-striped
Marsupial Shrew):
· Alternative Bezeichnung: Schmalstreifen-Streifenbeutelmaus.
· Taxonomie: Zunächst als Phascogale dorsalis beschrieben.
· Bestand: Nicht gefährdet; Population stabil.
· Verbreitung: Ozeanien (Indonesien: Arfakgebirge in Westpapua).
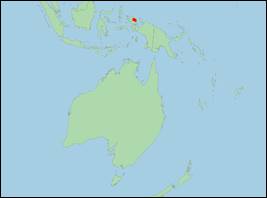
· Literatur: Flannery (1995); Peters & Doria (1876); Woolley et al. (2016).
Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Dasyurinae > Pseudantechinus
|
|
|
|
|
|
|
|
|
Pseudantechinus |
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
||||
|
|
|
|
|
|
||
|
|
|
|
||||
|
|
|
|
|
|
||
|
|
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
Genus Pseudantechinus
Tate, 1947
(Gattung Fettschwanzbeutelmäuse/False
Antechinus):
· 5 Arten; Generotypus Pseudantechinus macdonnellensis (Spencer, 1895). Stammbaum nach den Ergebnissen von Umbrello, Woolley & Westerman (2018) und Westerman, Young & Krajewski (2007).
· Literatur: Spencer (1895); Tate (1947); Umbrello, Woolley & Westerman (2018); Westerman, Young & Krajewski (2007).
Pseudantechinus bilarni (Johnson,
1954) (Harney-Fettschwanzbeutelmaus/Sandstone
False Antechinus):
· Taxonomie/Etymologie: Zunächst als Antechinus bilarni beschrieben. Archer (1982) stellte die Art später in die Gattung Parantechinus, während Kitchener & Caputi (1988) sie schließlich in die Gattung Pseudantechinus überführten. Nach den Analysen von Umbrello, Woolley & Westerman (2018) nimmt bilarni wie woolleyae eine eher basale Stellung in der Gattung Pseudantechinus ein und trennte sich vor rund 11 Millionen Jahren von den restlichen Arten.
· Bestand: Nicht gefährdet; Population abnehmend.
· Literatur: Archer (1982); Johnson (1954); Kitchener & Caputi (1988); Umbrello, Woolley & Westerman (2018); Woinarski & Burbidge (2016).
Pseudantechinus woolleyae Kitchener
& Caputi, 1988 (Woolley-Fettschwanzbeutelmaus/Woolley’s
False Antechinus):
· Holotypus/Terra typica: WAM M14740 (Westaustralisches Museum Perth), erwachsenes Männchen, tot aufgesammelt am 31. Juli 1976 von Jim Daly nahe der Bohrungsstelle Newlingunn, 10 km vom Errabiddy-Hof, Westaustralien, Australien.
· Taxonomie/Etymologie: Nach den Analysen von Umbrello, Woolley & Westerman (2018) nimmt woolleyae wie bilarni eine eher basale Stellung in der Gattung Pseudantechinus ein und trennte sich vor rund 11 Millionen Jahren von den restlichen Arten. Benannt nach Dr. Pat Woolley von der La-Trobe-Universität in Viktorien, zur Ehrung ihrer umfangreichen und bedeutsamen Forschung an Raubbeutlern.
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Australien: Westaustralien).
· Literatur: Burbidge et al. (2016); Kitchener & Caputi (1988); Umbrello, Woolley & Westerman (2018).
Pseudantechinus ningbing Kitchener,
1988 (Ningbing-Fettschwanzbeutelmaus/Ningbing
False Antechinus):
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Australien: Westaustralien).
· Literatur: Burbidge & Woinarski (2016); Kitchener (1988).
Pseudantechinus mimulus (Thomas, 1906) (Kleine Fettschwanzbeutelmaus/Alexandria False Antechinus):
· Alternative Bezeichnung: Alexandria-Fettschwanzbeutelmaus.
· Taxonomie: Zeitweise als Synonym von macdonnellensis gelistet, später aber wieder als gültige Art akzeptiert (Kitchener, 1991). Artstatus wird durch genetische Daten gestützt (Umbrello, Woolley & Westerman, 2018).
· Bestand: Potenziell gefährdet (Vorwarnliste); Population abnehmend.
· Verbreitung: Ozeanien (Australien: Nördliches Territorium, Queensland).
· Literatur: Kitchener (1991); Lloyd et al. (2013); Thomas (1906); Woinarski & Burbidge (2016); Umbrello, Woolley & Westerman (2018).
Pseudantechinus macdonnellensis (Spencer,
1895) (MacDonnell-Fettschwanzbeutelmaus/Fat-tailed False Antechinus):
· Holotypus/Terra typica: Alice Springs, Nördliches Territorium, Australien.
· Taxonomie/Etymologie: Zunächst als Phascologale macdonnellensis beschrieben (Spencer, 1895, 1896). Das Taxon roryi stellt nach Analysen von Umbrello, Woolley & Westerman (2018) entweder ein Synonym von macdonnellenis dar oder ist Bestandteil eines derzeit noch unter macdonnellensis zusammengefassten Artenkomplexes.
· Synonyme: Pseudantechinus roryi Cooper, Aplin & Adams, 2000. Holotypus/Terra typica: WAM M34277 (Westaustralisches Museum Perth), adultes Männchen, gesammelt am 29. Juli 1990 von R. A. How et al. an der Woodstock-Station, Pilbara-Region, Westaustralien, Australien.
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt; die IUCN führt das Taxon roryi noch als eigenständige Art mit dem Status Nicht gefährdet.
· Verbreitung: Ozeanien (Australien: Westaustralien, Nördliches Territorium, Südaustralien, Queensland.
· Literatur: Burbidge, Cooper & Morris (2016); Cooper, Aplin & Adams (2000); Spencer (1895, 1896); Umbrello, Woolley & Westerman (2018); Woinarski et al. (2016).
Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Dasyurinae > Dasycercus
|
|
|
|
|
|
Dasycercus |
|||
|
|
|
||
Genus Dasycercus
Peters, 1875
(Gattung Kammschwanz-Beutelmäuse):
· 2 Arten; Generotypus Dasycercus cristicauda (Krefft, 1867).
· Synonyme: Chaetocercus Krefft, 1867.
· Literatur: Krefft (1867); Peters (1875).
Dasycercus blythi (Waite, 1904) (Bürstenschwanz-Beutelmaus/Brush-tailed
Mulgara):
· Taxonomie/Etymologie: Zunächst als Phascogale blythi beschrieben. Die Art gilt als monotypisch. In der Literatur finden sich einige Zitierfehler, da für die jetzt Dasycercus blythi zugeordneten Exemplare bis 2005 der Name D. cristicauda verwendet wurde, während für die jetzt unter cristicauda laufende Form der Name D. hillieri Verwendung fand.
· Identifizierung/Beschreibung: 120-165 mm; Schwanzlänge 60-100 mm; Gewicht 60-110 g. Die Weibchen besitzen im Beutel sechs Zitzen.
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt; Europäisches Zuchtbuch (ESB) koordiniert vom Zoologisch-botanischen Garten Wilhelma Stuttgart.
· Verbreitung: Ozeanien (Australien: Westaustralien, Nördliches Territorium, Queensland, Südaustralien).
· Literatur: Baker (2015, 2020, 2023); Baker & Gynther (2023); Waite (1904); Woolley (2016).
Dasycercus cristicauda (Krefft, 1867) (Kammschwanz-Beutelmaus/Crest-tailed Mulgara):
· Taxonomie/Etymologie: Ursprünglich als Chaetocercus cristicauda beschrieben, wurde die Art von Peters (1875) in die neue Gattung Dasycercus gestellt, da bereits eine Kolibri-Gattung mit dem Namen Chaetocercus G. Gray, 1855 existiert. Da für die Form bis 2005 in der Regel der Name Dasycercus hillieri verwendet wurde und D. cristicauda für die jetzt D. blythi zugeordneten Populationen, existieren in der Literatur einige fehlerhafte Zuordnungen. D. cristicauda gilt als monotypisch.
· Synonyme: Phascogale hillieri Thomas, 1905.
·
Identifizierung/Beschreibung: 120-230 mm;
Schwanzlänge 80-125 mm; Gewicht 65-185 g. Die Weibchen besitzen im Beutel acht
Zitzen.
· Bestand: Potenziell gefährdet (Vorwarnliste); Population stabil.
· Verbreitung: Ozeanien (Australien: Nördliches Territorium, Queensland, Südaustralien, in Neusüdwales und Westaustralien möglicherweise ausgestorben).
· Literatur: Baker & Gynther (2023); Gray (1855); Krefft (1867); Peters (1875); Thomas (1905); Woinarski & Burbidge (2016).
Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Dasyurinae > Dasyuroides
|
Dasyuroides |
|
|
|
|
Genus Dasyuroides
Spencer, 1896 (Gattung Doppelkammbeutelmäuse):
· 1 Art
Dasyuroides byrnei Spencer, 1896 (Doppelkammbeutelmaus/Kowari):
· Bestand: Gefährdet; Population abnehmend.
· Verbreitung: Ozeanien (Australien: Queensland, Südaustralien).
· Literatur: McKnight et al. (2019); Spencer (1896).
Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Dasyurinae > Dasykaluta
|
Dasykaluta |
|
|
|
|
Genus Dasykaluta
Archer, 1982
(Gattung Rote Breitfußbeutelmäuse):
· 1 Art
Dasykaluta rosamondae (Ride, 1964) (Rote Breitfußbeutelmaus/Little Red
Kaluta):
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Australien: Westaustralien).
· Literatur: Burbidge (2016); Ride (1964).
Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Dasyurinae > Myoictis
Genus Myoictis
Gray, 1858 (Gattung Streifenbeutelmarder):
· 4 Arten; Generotypus. Stammbaum basierend auf den Ergebnissen von Westerman et al. (2016).
· Literatur: Gray (1858); Westerman et al. (2016)
Myoictis melas (Müller,
1840) (Müller-Streifenbeutelmarder/Müller’s Three-striped Dasyure):
· Taxonomie: Möglicherweise handelt es sich bei melas um einen Artenkomplex.
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Indonesien: Westpapua; Papua-Neuguinea).
· Literatur: Leary et al. (2016); Müller (1840).
Myoictis wallacii Gray, 1858 (Wallace-Streifenbeutelmarder/Wallace’s
Three-striped Dasyure):
· Taxonomie: Zeitweise in die Gattung Phascogale gestellt (Schlegel, 1866). Gelegentlich wird wallacii auch als Unterart von melas gelistet.
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Indonesien: Aru-Inseln, Westpapua; Papua-Neuguinea).
· Literatur: Flannery (1995); Gray (1858); Leary et al. (2016); Schlegel (1866); Westerman et al. (2006); Woolley (2001, 2005).
Myoictis leucera (Woolley, 2005) (Woolley-Streifenbeutelmarder/Woolley’s
Three-striped Dasyure):
· Bestand: Daten defizitär; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Papua-Neuguinea).
· Literatur: Westerman et al. (2006); Woolley (2005, 2016).
Myoictis wavicus (Tate,
1947) (Tate-Streifenbeutelmarder/Tate’s
Three-striped Dasyure):
· Taxonomie: Zeitweise als Unterart von melas gelistet.
· Bestand: Daten defizitär; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Papua-Neuguinea).
· Literatur: Flannery (1995); Tate (1947); Westerman et al. (2006); Woolley (2005, 2016).
Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Dasyurinae > Parantechinus
|
Parantechinus |
|
|
|
|
Genus Parantechinus
Tate, 1947 (Gattung Sprenkelbeutelmäuse):
· 1 Art.
Parantechinus apicalis (Gray,
1842) (Sprenkelbeutelmaus/Dibbler):
· Bestand: Stark gefährdet; Population abnehmend.
· Verbreitung: Ozeanien (Australien: Westaustralien).
· Literatur: Burbidge & Woinarski (2016); Gray (1842); Mills & Bencini (2000); Wolfe, Robertson & Bencini (2000).
Amniota > Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Phascogalinae
|
|
|
|
|
|
|
Phascogalinae |
|
|
||
|
|
|
|
||
|
|
|
|||
|
|
|
|
||
|
|
|
|
|
Subfamilia Phascogalinae Gill, 1872 (Unterfamilie Breitfußbeutelmäuse):
· 29 Arten; nominotypische Gattung Phascogale Temminck, 1824; nominotypische Art Phascogale tapoatafa (F. Meyer, 1793), ursprünglich Phascogale penicillata (Shaw, 1800), gilt aber als Synonym von tapoatafa. Der Stammbaum basiert auf den Ergebnissen von Westerman et al. (2016).
· Literatur: Gill (1872); Meyer (1793); Shaw (1800); Temminck (1824); Westerman et al. (2016).
Genus Antechinus
Macleay, 1841 (Gattung
Eigentliche Breitfußbeutelmäuse):
· 15 Arten; Generotypus Antechinus stuartii Macleay, 1841; Stammbaum orientiert sich an den Ergebnissen von Mutton et al. (2019) und Baker et al. (2014, 2015).
· Literatur: Baker et al. (2014, 2015); Macleay (1841); Mutton et al. (2019).
Genus Murexia
Tate
& Archbold,
1937 (Gattung
Neuguinea-Beutelmäuse):
·
11 Arten; Generotypus Murexia murex (Thomas, 1913); Stammbaum orientiert sich an den
Ergebnissen von Woolley, Krajewski & Westerman (2020).
·
Taxonomie: Zunächst als Untergattung von Phascogale beschrieben. Einige Arten waren
früher auch in der Gattung Antechinus
eingeordnet, wurden aber von Armstrong, Krajewski & Westerman
(1998) in die
Gattung Murexia überstellt.
·
Literatur: Armstrong, Krajewski & Westerman
(1998); Tate &
Archbold, 1937; Thomas (1913); Woolley,
Krajewski & Westerman (2020).
Genus Phascogale
Temminck, 1824 (Gattung Pinselschwanzbeutelmäuse):
·
3 Arten; Generotypus Phascogale tapoatafa (F.
Meyer, 1793), ursprünglich Phascogale
penicillata (Shaw, 1800), gilt
aber als Synonym von tapoatafa.
·
Literatur: Meyer
(1793); Shaw (1800); Temminck (1824).
Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Phascogalinae > Antechinus
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
Antechinus |
|
|
|
|
||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
Genus Antechinus
Macleay, 1841 (Gattung
Eigentliche Breitfußbeutelmäuse):
· 15 Arten; Generotypus Antechinus stuartii Macleay, 1841; Stammbaum orientiert sich an den Ergebnissen von Mutton et al. (2019) und Baker et al. (2014, 2015).
· Literatur: Baker et al. (2014, 2015); Macleay (1841); Mutton et al. (2019).
Antechinus arktos Baker, Mutton, Hines & Van Dyck, 2014 (Schwarzschwanz-Breitfußbeutelmaus/Black-tailed
Antechinus):
· Holotypus/Terra typica: QM JM 20009 (Queensland Museum Brisbane), adultes Weibchen, gesammelt am 28. Mai 2013 von A. M. Baker, T. Y. Mutton, H. B. Hines und J. Rowland an einer kleinen Rinne nahe des „Best of All Lookout“ am Berg Mumdjin, Springbrook-Nationalpark, südöstliches Queensland, Australien.
· Taxonomie/Etymologie: Nach genetischen Analysen gehört A. arktos mit den Arten minimus, mimetes, swainsonii und vandycki zum swainsonii-Komplex. Der wissenschaftliche Name stammt vom griechischen Wort ἄρκτος für „Bär“, was auf das bärenartige Erscheinungsbild der Art hindeuten soll (lange Grannenhaare am Körper, Angewohnheit sich bei Störung auf die Hinterbeine zu stellen und in die Luft zu schnüffeln).
· Bestand: Nicht bewertet.
· Verbreitung: Ozeanien (Australien: Queensland, Neusüdwales).
· Literatur: Baker et al. (2014); Gray, Baker & Firn (2017).
Antechinus minimus (É.
Geoffroy Saint-Hilaire, 1803)
(Sumpf-Breitfußbeutelmaus/Swamp
Antechinus):
·
Unterarten:
1. A. minimus minimus (É. Geoffroy Saint-Hilaire, 1803) (Tasmanische
Sumpf-Breitfußbeutelmaus/Tasmanian Swamp Antechinus).
2. A. minimus maritimus (Finlayson, 1958) (Küstennahe Sumpf-Breitfußbeutelmaus/Coastal Swamp Antechinus).
· Bestand: Nicht gefährdet; Population abnehmend.
· Verbreitung: Ozeanien (Australien: Südaustralien, Viktorien inkl. Inseln Sunday und Wilsons Promontory, Tasmanien inkl. Inseln der Bass-Straße)
· Literatur: Baker & Van Dyck (2015); Geoffroy Saint-Hilaire (1803); van Weenen & Menkhorst (2016).
Antechinus mimetes (Thomas, 1924) (Dunkle Breitfußbeutelmaus/Mainland Dusky Antechinus):
· Holotypus/Terra typica: BMNH 24.10.1.1 (Britisches Museum für Naturgeschichte London), Weibchen, gesammelt von Captain G. H. Wilkins am 14. April 1924 im Guy-Fawkes-Distrikt, nahe Ebor, nordöstliches Neusüdwales, Australien.
·
Unterarten:
1. A. mimetes mimetes (Thomas, 1924) (Östliche Dunkle
Breitfußbeutelmaus/Eastern Dusky Antechinus).
2. A. mimetes insulanus Davison, 1991 (Südliche Dunkle Breitfußbeutelmaus/Victoria Dusky Antechinus).
· Bestand: Nicht bewertet.
· Verbreitung: Ozeanien (Australien: Queensland, Neusüdwales, Viktorien).
· Literatur: Davison (1991); Dickman, Menkhorst & Burnett (2016); Righetti, Fox & Croft (2000); Thomas (1924); Watchorn, Ashman & Harley (2019).
Antechinus swainsonii (Waterhouse, 1840) (Swainson-Breitfußbeutelmaus/Tasmanian Dusky Antechinus):
· Alternative Bezeichnung: Tasmanische Dunkle Breitfußbeutelmaus.
· Holotypus/Terra typica: BMNH 60.1.5.18 (Haut) und 60.1.5.26 (Schädel) (Britisches Museum für Naturgeschichte London), Männchen aus der privaten Sammlung von William Swainson übergeben an Waterhouse, gesammelt auf Tasmanien (Van-Diemens-Land), Australien.
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Australien: Tasmanien).
· Literatur: Dickman, Menkhorst & Burnett (2016); Righetti, Fox & Croft (2000); Waterhouse (1840).
Antechinus vandycki Baker, Mutton, Mason & Gray, 2015 (Van-Dyck-Breitfußbeutelmaus/Tasman
Peninsula Dusky Antechinus):
· Holotypus/Terra typica: JM20111 (Queenland Museum Brisbane), Männchen, gesammelt am 7. Mai 2014 von Eugene Mason, Emma Gray und Hannah Maloney an der Straße Lichen Road, Tasman-Halbinsel, Tasmanien.
· Taxonomie/Etymologie: Die jetzt als A. vandycki klassifizierten Exemplare der Tasman-Halbinsel wurden vorher der Art swainsonii zugeschrieben. Nach genetischen Untersuchungen sind vandycki und swainsonii zwar Schwestertaxa, stellen aber eigenständige Evolutionslinien auf Artniveau dar. Zur Würdigung seiner Pionierarbeit bei der Antechinus-Taxonomie wurde die Art nach Dr. Steve Van Dyck benannt, dem Kurator der Säugetier- und Vogelabteilung am Queenland Museum.
· Bestand: Nicht bewertet.
· Verbreitung: Ozeanien (Australien: Queensland, Neusüdwales, Viktorien).
· Literatur: Baker et al. (2015).
Antechinus godmani Thomas,
1923 (Queensland-Breitfußbeutelmaus/Atherton
Antechinus):
· Bestand: Nicht gefährdet; Population stabil.
· Verbreitung: Ozeanien (Australien: Queensland).
· Literatur: Burnett & Winter (2019); Thomas (1923).
Antechinus agilis Dickman, Parnaby, Crowther & King, 1998 (Graue Breitfußbeutelmaus/Agile
Antechinus):
· Alternative Bezeichnung: Flinke Breitfußbeutelmaus.
· Holotypus/Terra typica: M33319 (Australisches Museum Sydney), adultes Männchen, gesammelt am 8. August 1997 von M. S. Crowther auf der Südseite der Straßenecke Warks Road/Bundells Creek Road, nahe des Bachs Lees Creek, Bereich Brindabella, australisches Hauptstadtterritorium, Australien.
· Taxonomie/Etymologie: Nach genetischen Untersuchungen (Mutton et al., 2019) stellt A. agilis das Schwestertaxon zum stuartii/subtropicus-Artenkomplex dar.
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt. Das aus dem Latein stammende Artepitheton agilis bedeutet „flink“ und spielt auf das geschickte Kletterverhalten der Art und ihre akrobatischen Fähigkeiten an.
· Verbreitung: Ozeanien (Australien: Neusüdwales, Viktorien).
· Literatur: Dickman et al. (1998); Dickman, Lunney & Menkhorst (2016); Mutton et al. (2019); Shimmin, Taggart & Temple-Smith (2000).
Antechinus stuartii Macleay,
1841 (Stuart-Breitfußbeutelmaus/Brown
Antechinus):
· Taxonomie: Nach genetischen (Mutton et al., 2019) und morphometrischen Analysen (Viacava et al., 2022) handelt es sich bei stuartii vsl. um zwei Arten, wobei die nördliche Form die Schwesterart von subtropicus ist, während die südliche Form dem Zweig aus diesen beiden Arten gegenübersteht.
· Bestand: Nicht gefährdet; Population stabil.
· Verbreitung: Ozeanien (Australien: Queensland, Neusüdwales).
· Literatur: Burnett & Dickman (2016); Goldingay (2000); Gray, Baker & Firn (2017); Knight & Fox (2000); Macleay (1841); Mutton et al. (2019); Righetti, Fox & Croft (2000); Viacava et al. (2022).
· Taxonomie: Zeitweise als Unterart von stuartii geführt, wurde subtropicus von Van Dyck & Crowther (2000) in den Artenrang erhoben.
· Bestand: Nicht gefährdet; Population abnehmend.
· Verbreitung: Ozeanien (Australien: Queensland, Neusüdwales).
· Literatur: Burnett & Dickman (2016); Mutton et al. (2017); Van Dyck & Crowther (2000).
Antechinus adustus (Thomas, 1923) (Rostfarbene Breitfußbeutelmaus/Rusty Antechinus):
· Alternative Bezeichnung: Tropische Breitfußbeutelmaus.
· Taxonomie: Zeitweise als Unterart von stuartii geführt, wurde adustus von Van Dyck & Crowther (2000) in den Artenrang erhoben.
· Bestand: Nicht gefährdet; Population abnehmend.
· Verbreitung: Ozeanien (Australien: Queensland).
· Literatur: Burnett & Winter (2016); Thomas (1923); Van Dyck & Crowther (2000).
Antechinus bellus (Thomas, 1904) (Augenfleck-Breitfußbeutelmaus/Fawn Antechinus):
· Alternative Bezeichnung: Beige Breitfußbeutelmaus.
· Bestand: Gefährdet; Population abnehmend.
· Verbreitung: Ozeanien (Australien: Nördliches Territorium inkl. Melville-Insel).
· Literatur: Thomas (1904); Woinarski & Burbidge (2016).
Antechinus leo Van Dyck, 1980 (Zimtfarbene
Breitfußbeutelmaus/Cinnamon Antechinus):
· Alternative Bezeichnung: Zimt-Breitfußbeutelmaus.
· Bestand: Nicht gefährdet; Population stabil.
· Verbreitung: Ozeanien (Australien: Queensland).
· Literatur: Burnett & Winter (2016); Van Dyck (1980).
Antechinus flavipes (Waterhouse, 1838) (Gelbfüßige
Breitfußbeutelmaus/Yellow-footed Antechinus):
· Unterarten:
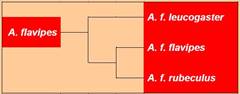
1. A. flavipes flavipes (Waterhouse, 1838) (Südliche Gelbfüßige
Breitfußbeutelmaus/Southern Yellow-footed Antechinus).
2. A. flavipes leucogaster (J. E. Gray, 1841) (Weißbäuchige Gelbfüßige Breitfußbeutelmaus/Western Yellow-footed Antechinus).
3. A. flavipes rubeculus Van Dyck, 1982 (Rötliche Gelbüßige Breitfußbeutelmaus/Northern Yellow-footed Antechinus).
· Bestand: Nicht gefährdet; Population stabil.
· Verbreitung: Ozeanien (Australien: Queensland, Neusüdwales, Viktorien, Südaustralien, Westaustralien).
· Literatur: Crowther et al. (2002); Menkhorst et al. (2016); Tian et al. (2022); Van Dyck & Crowther (2000); Waterhouse (1838).
Antechinus argentus Baker, Mutton & Hines, 2013
(Silberfarbene
Breitfußbeutelmaus/Silver-headed Antechinus):
· Alternative Bezeichnung: Silberkopf-Breitfußbeutelmaus.
· Holotypus/Terra typica: QM JM 19966 (Queensland Museum Brisbane), adultes Männchen, gesammelt am 26. April 2013 von T. Mutton und H. Hines am Plateau westlich bis nordwestlich von „The Lookout“ am östlichen Steilhang des Kroombit-Tops, 400 km NNW von Brisbane, 60 km SSW von Gladstone, südöstliches Queensland, Australien.
· Taxonomie/Etymologie: Nach genetischen Untersuchungen ist A. argentus eng mit A. mysticus verwandt. Das Artepitheton leitet sich von dem lateinischen Wort argentum ab, das „Silber“ bedeutet. Es spielt auf die silberne Färbung an Kopf und Oberkörper der Tiere an.
· Bestand: Nicht bewertet.
· Verbreitung: Ozeanien (Australien: Queensland).
· Literatur: Baker, Mutton & Hines (2013); Mason et al. (2017).
Antechinus mysticus Baker,
Mutton & Van Dyck, 2012 (Mystische
Breitfußbeutelmaus/Buff-footed Antechinus):
· Alternative Bezeichnung: Hellfüßige Breitfußbeutelmaus.
· Bestand: Nicht bewertet.
· Literatur: Baker, Mutton & Van Dyck (2012); Mutton et al. (2017).
Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Phascogalinae > Murexia
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
Murexia |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Genus Murexia
Tate
& Archbold,
1937 (Gattung
Neuguinea-Beutelmäuse):
· 11 Arten; Generotypus Murexia murex (Thomas, 1913); Stammbaum orientiert sich an den Ergebnissen von Woolley, Krajewski & Westerman (2020).
· Taxonomie/Etymologie: Zunächst als Untergattung von Phascogale beschrieben. Einige Arten waren früher auch in der Gattung Antechinus eingeordnet, wurden aber von Armstrong, Krajewski & Westerman (1998) in die Gattung Murexia überstellt. Der Gattungsname leitet sich vermutlich vom Artepitheton murex der Typusart ab, dessen Bedeutung aber unklar ist.
· Literatur: Armstrong, Krajewski & Westerman (1998); Tate & Archbold, 1937; Thomas (1913); Woolley, Krajewski & Westerman (2020).
Murexia rothschildi Tate, 1938 (Rothschild-Neuguinea-Beutelmaus/Broad-striped
Dasyure):
· Taxonomie: Die Art wird gelegentlich aufgrund morphologischer Analysen in eine separate Gattung Paramurexia Van Dyck, 2002 gestellt. Genetische Untersuchungen unterstützen aber die Zugehörigkeit zu Murexia (Armstrong, Krajewski & Westerman, 1998; Krajewski et al., 2000, 2007).
· Bestand: Potenziell gefährdet (Vorwarnliste); Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Papua-Neuguinea).
· Literatur: Armstrong, Krajewski & Westerman (1998); Krajewski et al. (2007); Krajewski, Wroe & Westerman (2000); Leary et al. (2016); Tate (1938); Van Dyck (2002).
Murexia habbema (Tate
& Archbold, 1941) (Habbema-Neuguinea-Beutelmaus/Habbema
Dasyure):
· Alternative Bezeichnung: Westliche Berg-Neuguinea-Beutelmaus.
· Taxonomie: Die Art wird gelegentlich aufgrund morphologischer Analysen in eine separate Gattung Micromurexia Van Dyck, 2002 gestellt. Genetische Untersuchungen unterstützen aber die Zugehörigkeit zu Murexia (Armstrong, Krajewski & Westerman, 1998; Krajewski et al., 2000, 2007). Meist wird das Taxon hageni als Unterart von habbema geführt. Molekulare Analysen weisen jedoch auf zwei eigenständige Arten hin Woolley, Krajewski & Westerman (2020). Allerdings ist noch zu prüfen, ob diese den bisherigen Unterarten entsprechen.
· Bestand: Nicht gefährdet; Population stabil
· Verbreitung: Ozeanien (Indonesien: Westpapua).
· Literatur: Armstrong, Krajewski & Westerman (1998); Krajewski et al. (2007); Krajewski, Wroe & Westerman (2000); Leary et al. (2016); Tate & Archbold (1941); Van Dyck (2002).
Murexia hageni (Laurie, 1952) (Hagen-Neuguinea-Beutelmaus/Hagen’s Dasyure):
· Alternative Bezeichnung: Östliche Berg-Neuguinea-Beutelmaus.
· Taxonomie: Die Art wird gelegentlich aufgrund morphologischer Analysen in eine separate Gattung Micromurexia Van Dyck, 2002 gestellt. Genetische Untersuchungen unterstützen aber die Zugehörigkeit zu Murexia (Armstrong, Krajewski & Westerman, 1998; Krajewski et al., 2000, 2007). Meist wird das Taxon hageni als Unterart von habbema geführt. Molekulare Analysen weisen jedoch auf zwei eigenständige Arten hin Woolley, Krajewski & Westerman (2020). Allerdings ist noch zu prüfen, ob diese den bisherigen Unterarten entsprechen.
· Bestand: Nicht bewertet; von IUCN zu Murexia habbema gerechnet.
· Verbreitung: Ozeanien (Papua-Neuginea).
· Literatur: Armstrong, Krajewski & Westerman (1998); Krajewski et al. (2007); Krajewski, Wroe & Westerman (2000); Laurie (1952); Leary et al. (2016); Van Dyck (2002).
Murexia murex (Thomas, 1913) (Missim-Neuguinea-Beutelmaus/Mount
Missim Dasyure):
· Holotypus/Terra typica: BM 12.2.4.1 (Britisches Museum für Naturgeschichte London), adultes Männchen, gesammelt von O. Fritsche am Sattelberg, Provinz Morobe, Papua-Neuguinea.
· Taxonomie/Etymologie: Ursprünglich als Phyascogale murex beschrieben, von Tate & Archbold (1937) aber in die neue Gattung Murexia überführt. Das Taxon wird meist als Unterart oder Synonym von longicaudata gelistet (Baker, 2015; Groves, 2005), steht nach genetischen Analysen aber als separate Entwicklungslinie den Artkomplexen von longicaudata, melanurus und naso gegenüber (Woolley, Krajewski & Westerman, 2020). Das Vorkommen auf der Normanby-Insel, welches Van Dyck (2002) noch melanurus zuordnete, wird aktuell murex zugerechnet (Lavery & Flannery, 2023), doch steht eine Bestätigung durch genetische Analysen noch aus. Die Bedeutung des Artepithetons ist unsicher. Das lateinische Wort murex bedeutet „Purpurschnecke“, kann aber auch „spitzer Stein“ bedeuten, was ein Hinweis auf den Sattelberg als Fundort sein könnte. Möglicherweise handelt es sich aber auch um eine Ableitung des Wortes mus, welches „Maus“ bedeutet.
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge ca. 165 mm; Schwanzlänge ca. 165 cm; Hinterfußlänge ca. 31,3 mm; Gewicht ca. 113 g.
· Bestand: Nicht bewertet.
· Verbreitung (Ozeanien: Papua-Neuguinea inkl. Normanby-Insel).
· Literatur: Baker (2015, 2020); Groves (2005); Lavery & Flannery (2023); Tate & Archbold (1937); Thomas (1913); Van Dyck (2002); Woolley, Krajewski & Westerman (2020).
Murexia tafa Tate & Archbold, 1936 (Morobe-Neuguinea-Beutelmaus/Morobe
Dasyure):
· Taxonomie: Das Taxon wird meist als Unterart oder Synonym von naso gelistet, gilt nach genetischen Analysen aber als Schwestertaxon zum Artenpaar melanurus und wilhelma (Woolley, Krajewski & Westerman, 2020). Die naso zugeordneten Taxa werden gelegentlich aufgrund morphologischer Analysen in eine separate Gattung Phascomurexia Van Dyck, 2002 gestellt. Genetische Untersuchungen unterstützen aber die Zugehörigkeit zu Murexia (Armstrong, Krajewski & Westerman, 1998; Krajewski et al., 2000, 2007).
· Bestand: Nicht bewertet.
· Verbreitung: Ozeanien (Papua-Neuguinea).
· Literatur: Armstrong, Krajewski & Westerman (1998); Krajewski et al. (2007); Krajewski, Wroe & Westerman (2000); Leary et al. (2016); Tate & Archbold (1936); Woolley, Krajewski & Westerman (2020).
Murexia melanurus (Thomas, 1899) (Schwarzschwanz-Neuguinea-Beutelmaus/Black-tailed Dasyure):
· Taxonomie: Ursprünglich als Phascogale melanurus beschrieben, wird die Art gelegentlich aufgrund morphologischer Analysen in eine separate Gattung Murexechinus Van Dyck, 2002 gestellt. Genetische Untersuchungen unterstützen aber die Zugehörigkeit zu Murexia (Armstrong, Krajewski & Westerman, 1998; Krajewski et al., 2000, 2007).
· Bestand: Nicht gefährdet; Population stabil.
· Verbreitung: Ozeanien (Papua-Neuguinea).
· Literatur: Armstrong, Krajewski & Westerman (1998); Krajewski et al. (2007); Krajewski, Wroe & Westerman (2000); Leary et al. (2016); Thomas (1899); Woolley, Krajewski & Westerman (2020).
Murexia wilhelmina Tate, 1947 (Wilhelmina-Neuguinea-Beutelmaus/Mount Wilhelmina Dasyure):
· Holotypus/Terra typica: AMNH 109811 (Amerikanisches Museum für Naturgeschichte New York), adultes Männchen, gesammelt 1938 von W. B. Richardson 9 km nordöstlich vom Habbema-See, nördlich vom Berg Wilhelmina (2.800 m Höhe), Westpapua, Indonesien.
· Taxonomie/Etymologie: Das Taxon wird meist als Unterart oder Synonym von melanurus gelistet. Molekulare Analysen stützen aber einen Artstatus (Woolley, Krajewski & Westerman, 2020). Die melanurus zugeordneten Taxa werden gelegentlich aufgrund morphologischer Analysen in eine separate Gattung Murexechinus Van Dyck, 2002 gestellt. Genetische Untersuchungen unterstützen aber die Zugehörigkeit zu Murexia (Armstrong, Krajewski & Westerman, 1998; Krajewski et al., 2000, 2007). Der wissenschaftliche Artname leitet sich vom Berg Wilhelmina ab, in dessen Nähe die Art entdeckt wurde.
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge ca. 108 mm; Schwanzlänge ca. 130 mm; Hinterfußlänge ca. 20 mm.
· Bestand: Nicht bewertet.
· Verbreitung: Ozeanien (Indonesien: Westpapua).
· Literatur: Armstrong, Krajewski & Westerman (1998); Krajewski et al. (2007); Krajewski, Wroe & Westerman (2000); Tate (1947); Woolley, Krajewski & Westerman (2020).
Murexia naso (Jentink, 1911) (Langnasen-Neuguinea-Beutelmaus/Long-nosed Dasyure):
· Holotypus/Terra typica: RMNH 326 (Reichsmuseum für Naturgeschichte Leiden/Naturalis Biodiversitätszentrum), adultes Männchen, gesammelt am 16. Oktober 1909 im Hellwig-Gebirge, Westpapua, Indonesien.
· Taxonomie/Etymologie: Die Art wurde ursprünglich als Phascogale naso beschrieben und wird gelegentlich aufgrund morphologischer Analysen in eine separate Gattung Phascomurexia Van Dyck, 2002 gestellt. Genetische Untersuchungen unterstützen aber die Zugehörigkeit zu Murexia (Armstrong, Krajewski & Westerman, 1998; Krajewski et al., 2000, 2007). Das Artepitheton naso leitet sich vom lateinischen Wort nasus ab, welches „Nase“ bedeutet und sich auf die verhältnismäßig lange Schnauze bei Individuen der Art bezieht.
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge 106-145 mm; Schwanzlänge 105-155 mm; Hinterfußlänge 19-27 mm; Ohrlänge 16-17,5 mm; Gewicht 37,6-62,5 g.
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Indonesien: Westpapua).
· Literatur: Armstrong, Krajewski & Westerman (1998); Jentink (1911); Krajewski et al. (2007); Krajewski, Wroe & Westerman (2000); Leary et al. (2016).
Murexia longicaudata (Schlegel, 1866) (Langschwänzige Neuguinea-Beutelmaus/Short-furred Dasyure):
· Holotypus/Terra typica: RMNH 35135 (Reichsmuseum für Naturgeschichte Leiden/Naturalis Biodiversitätszentrum), subadultes Männchen, gesammelt 1865 von Baron C. B. H. von Rosenberg bei Wonumbai, Kobroor, Aur-Inseln, Indonesien.
· Taxonomie: Die Taxa aspera und maxima, teilweise auch murex werden meiste als Unterarten oder Synonyme von longicaudata geführt (Lavery & Flannery, 2023; Baker, 2015; Groves, 2005). Genetische Untersuchungen stützen aber eine Stellung als separate Arten (Woolley, Krajewski & Westerman, 2020). Das aus dem Latein stammende Artepitheton longicaudata bedeutet „langschwänzig“ und bezieht sich auf den im Verhältnis zu den anderen von Schlegel untersuchten Arten langen Schwanz der Spezies.
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
·
Identifizierung/Beschreibung: Kopf-Rumpf-Länge 234-262
mm; Schwanzlänge 215-230 cm; Hinterfußlänge 40-47 mm; Ohrlänge 23-24 mm; Gewicht
ca. 434 g.
· Verbreitung (Ozeanien: Indonesien: Aru- und Yapen-Inseln, Westpapua).
· Literatur: Baker (2015, 2020, 2023); Groves (2005); Lavery & Flannery (2023); Schlegel (1866); Woolley et al. (2016); Woolley, Krajewski & Westerman (2020).
Murexia aspera (O. Thomas, 1913) (Kurznasen-Neuguinea-Beutelmaus/Namosado Dasyure):
· Holotypus/Terra typica: BMNH 13.6.18.90. (Britisches Museum für Naturgeschichte London), adultes Weibchen, gesammelt am 1. Dezember 1912 von C. B. Kloss am Utakwa-Fluss (2.500 m Höhe), Westpapua, Indonesien.
· Taxonomie/Etymologie: Ursprünglich als Unterart Phascogale murex aspera beschrieben, überführten Tate & Archbold (1937) das Taxon in die neue Gattung Murexia. Die Form aspera wird meist als Unterart oder Synonym von longicaudata (Lavery & Flannery, 2023; Groves, 2005) gelistet. Molekulare Analysen stützen aber einen Artstatus (Woolley, Krajewski & Westerman, 2020). Das aus dem Latein stammende Artepitheton aspera bedeutet „rau“. Möglicherweise bezieht sich Thomas auf die raue, bergige Umgebung des Fundorts.
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge ca. 169 mm; Schwanzlänge ca. 180 mm; Hinterfußlänge ca. 33 mm; Ohrlänge ca. 21 mm.
· Bestand: Nicht bewertet.
· Verbreitung (Ozeanien: Indonesien: Westpapua; Papua-Neuguinea).
· Literatur: Groves (2005); Lavery & Flannery (2023); Tate & Archbold (1937); Thomas (1913); Woolley, Krajewski & Westerman (2020).
Murexia maxima (Stein, 1932) (Große Neuguinea-Beutelmaus/Greater
Dasyure):
· Taxonomie: Das Taxon wird meist als Unterart oder Synonym von longicaudata gelistet. Molekulare Analysen stützen aber einen Artstatus (Woolley, Krajewski & Westerman, 2020).
· Bestand: Nicht bewertet.
· Verbreitung (Ozeanien: Papua-Neuguinea).
· Literatur: Stein (1932); Woolley, Krajewski & Westerman (2020).
Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Phascogalinae > Phascogale
Genus Phascogale
Temminck, 1824 (Gattung Pinselschwanzbeutelmäuse):
· 3 Arten; Generotypus Phascogale tapoatafa (F. Meyer, 1793), ursprünglich Phascogale penicillata (Shaw, 1800), gilt aber als Synonym von tapoatafa.
· Literatur: Meyer (1793); Shaw (1800); Temminck (1824).
Phascogale calura Gould, 1844 (Kleine Pinselschwanzbeutelmaus/Red-tailed Phascogale):
· Alternative Bezeichnung: Kleiner Pinselschwanzbeutler.
· Holotypus/Terra typica: Gesammelt bei einer Militärstation am Fluss Williams River, Westaustralien, Australien.
· Taxonomie/Etymologie: Ursprünglich als Phascogale calurus beschrieben, korrigierte Gould (1845) gleich darauf dem Genus des Gattungsnamen entsprechend das Epitheton in calura. Für kurze Zeit wurde die Art auch in die Gattung Phascologale (Thomas, 1888) überführt, dann aber wieder Phascogale zugeordnet (Iredale & Troughton, 1934). Das aus dem Latein stammende Artepitheton calurus bedeutet „heiß“ und soll vermutlich darauf hinweisen, dass die Art auch bis in Wüstenregionen verbreitet ist.
· Bestand: Potenziell gefährdet (Vorwarnliste); Population stabil.
· Literatur: Burbidge & Woinarski (2019); Cannella et al. (2019); Gould (1844, 1845).
· Alternative Bezeichnung: Nördlicher Pinselschwanzbeutler.
· Holotypus/Terra typica: BMNH 4.1.3.100 (Britisches Museum für Naturgeschichte London), erwachsenes Männchen, gesammelt am 24. Mai 1903 von J. T. Tunney am Fluss South Alligator River, Nördliches Territorium, Australien.
· Taxonomie: Zeitweise als Unterart von P. tapoatafa betrachtet.
· Bestand: Gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Australien: Nördliches Territorium).
· Literatur: Thomas (1904); Woinarski, Rhind & Oakwood (2019).
· Holotypus/Terra typica: gesammelt Sydney, Neusüdwales, Australien.
· Taxonomie/Etymologie: Ursprünglich als Viverra tapoatafa beschrieben und von Iredale & Troughton (1934) in die Gattung Phascogale gestellt. Das Artepitheton leitet sich von der von den Aborigines verwendeten Bezeichnung Tapoa Tafa für diese Tiere ab. Inzwischen werden drei Unterarten identifiziert (Aplin et al., 2015), deren Validität sich auch gut durch morphometrische (Rhind, Bradley & Cooper, 2001) und genetische Daten (Spencer, Rhind & Eldridge, 2001) belegen lässt. Möglicherweise existiert eine weitere Unterart bei Cape York.
· Unterarten:
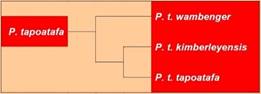
1. P. tapoatafa tapoatafa (F. Meyer, 1793) (Östliche
Pinselschwanzbeutelmaus/Eastern Brush-tailed Phascogale).
2. P. tapoatafa kimberleyensis Aplin & Rhind, 2015 (Kimberley-Pinselschwanzbeutelmaus/Kimberley Brush-tailed Phascogale). Holotypus/Terra typica: WAM16028, adultes Männchen gesammelt von Gerald F. Hill am 19. Februar 1910 an der Pago-Mission, Napier-Bucht, nahe Broome, Westaustralien, Australien. Das Unterartepitheton bezieht sich auf die Region Kimberley, in der das Taxon verbreitet ist.
3. P. tapoatafa wambenger Rhind & Aplin, 2015 (Wambenger-Pinselschwanzbeutelmaus/Wambenger Brush-tailed Phascogale). Holotypus/Terra typica: WAM7674 (Westaustralisches Museum Perth), adultes Männchen, gesammelt von R. C. Hislop am 17. März 1967 bei Quindalup, Westaustralien, Australien. Das Unterartepitheton wambenger entspricht der im südwestlichen Australien lokal verbreiteten Bezeichnung für Pinselschwanzbeutelmäuse. Das Wort stammt ursprünglich vermutlich aus der Sprache der indigenen Bevölkerungsgruppe Noongar.
· Synonyme: Didelphis penicillata Shaw, 1800; Dasyurus tafa White, 1803.
· Bestand: Potenziell gefährdet (Vorwarnliste); Population abnehmend; Unterart Kimberley-Pinselschwanzbeutelmaus Stark gefährdet.
· Verbreitung: Ozeanien (Australien: Westaustralien, Queensland, Neusüdwales, Viktorien, Südaustralien).
· Literatur: Aplin et al. (2015); Burbidge & Woinarski (2020); Cannella et al. (2019); Edwards et al. (2019); Iredale & Troughton (1934); Meyer (1793); Rhind, Bradley & Cooper (2001); Shaw (1800); Spencer, Rhind & Eldridge (2001); White (1803).
Therapsida > Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Planigalinae
|
Planigalinae |
|
|
|
|
Subfamilia Planigalinae Archer, 1982
(Unterfamilie Flachkopfbeutelmäuse):
· 5 Arten.
· Literatur: Archer (1982).
Genus Planigale
Troughton, 1928
(Gattung Eigentliche
Flachkopfbeutelmäuse):
· 5 Arten; Generotypus Planigale ingrami (Thomas, 1906).
· Literatur: Thomas (1906); Troughton (1928).
Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Planigalinae > Planigale
|
|
|
|
|
|
|
|
|
Planigale |
|
|
||||
|
|
|
|
|
|
||
|
|
|
|||||
|
|
|
|
|
|
||
|
|
|
|||||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Genus Planigale
Troughton, 1928
(Gattung Eigentliche
Flachkopfbeutelmäuse):
· 5 Arten; Generotypus Planigale ingrami (Thomas, 1906).
· Literatur: Thomas (1906); Troughton (1928).
Planigale novaeguineae Tate & Archbold, 1941 (Neuguinea-Flachkopfbeutelmaus/New Guinean Planigale):
· Taxonomie/Etymologie: Das Artepitheton novaeguineae für Neuguinea bezieht sich auf das Verbreitungsgebiet der Art.
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Indonesien: Westpapua; Papua-Neuguinea).
· Literatur: Baker (2015, 2020); Flannery (1995); Jackson & Groves (2015); Leary et al. (2016); Tate & Archbold (1941).
Planigale maculata (Gould, 1851) (Gefleckte Flachkopfbeutelmaus/Common
Planigale):
· Holotypus/Terra typica: BM53.10.22.21 (Britisches Museum für Naturgeschichte London), erwachsenes Männchen (Haut und Schädel), gesammelt von J. Strange am Fluss Clarence River, nahe Clarence, südlich der Moreton-Bucht, Neusüdwales, Australien.
· Taxonomie/Etymologie: Ursprünglich als Antechinus maculatus beschrieben und später von Archer (1976) in Gattung Planigale überführt. Derzeit werden zwei Unterarten gelistet. Wahrscheinlich handelt es sich aber um einen Arten-/Unterarten-Komplex. So stellt zum Beispiel die bisher zu P. maculata gezählte Population auf der Barrow-Insel wahrscheinlich eine separate, noch unbeschriebene Art dar. Das aus dem Latein stammende Artepitheton maculata bedeutet „gefleckt“ und bezieht sich auf den gefleckten Bauch der Art.
·
Unterarten:
1. Planigale maculata maculata (Gould, 1851)
(Östliche Gefleckte Flachkopfbeutelmaus/Eastern Common Planigale).
2. Planigale maculata sinualis (Thomas, 1926) (Nördliche Gefleckte Flachkopfbeutelmaus/Northern Common Planigale). Holotypus BM26.3.11.194 (Britisches Museum für Naturgeschichte London), juveniles Männchen, gesammelt am 19. Januar 1925 auf der Expedition von Captain G. H. Wilkins auf der Insel Groote Eylandt, Nördliches Territorium, Australien. Ursprünglich als Phascogale minutissima sinualis beschrieben, ordneten Iredale & Troughton (1934) das Taxon als Unterart von maculata ein. Archer (1976) betrachtete sinualis hingegen als Synonym von maculata, während Painter, Krajewski & Westerman (1995) vermuten, dass es sich um eine eigenständige Art handelt.
· Synonyme: Antechinus minutissimus Gould, 1852 (Holotypus BM53.10.22.20 (Haut) und BM54.10.21.5 (Schädel) (Britisches Museum für Naturgeschichte London), adultes Männchen, gesammelt von J. Strange nahe der Moreton-Bucht an der Ostküste Australiens.
· Bestand: Nicht gefährdet; Population stabil.
· Verbreitung: Ozeanien (Australien: Westaustralien, Nördliches Territorium, Queensland, Neusüdwales).
· Literatur: Archer (1976); Baker (2015, 2020); Burnett & Dickman (2016); Gould (1851, 1852); Iredale & Troughton (1934); Jackson & Groves (2015); Painter, Krajewski & Westerman (1995); Thomas (1926).
Planigale tenuirostris Troughton, 1928 (Spitznasen-Flachkopfbeutelmaus/Narrow-nosed
Planigale):
· Alternative Bezeichnung: Südliche Flachkopfbeutelmaus.
· Bestand: Nicht gefährdet; Population stabil.
· Verbreitung: Ozeanien (Australien: Nördlichen Territorium, Queensland, Neusüdwales, Südaustralien).
· Literatur: Baker (2015, 2020); Ellis, van Weenen & Burnett (2016); Jackson & Groves (2015); Troughton (1928).
Planigale gilesi Aitken,
1972 (Giles-Flachkopfbeutelmaus/Paucident
Planigale):
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Australien: Nördliches Territorium, Queensland, Neusüdwales, Viktorien, Südaustralien).
· Literatur: Aitken (1972); Baker (2015, 2020); Ellis, van Weenen & Pennay (2016); Jackson & Groves (2015).
Planigale ingrami (Thomas, 1906) (Langschwanz-Flachkopfbeutelmaus/Long-tailed
Planigale):
· Alternative Bezeichnung: Ingram-Flachkopfbeutelmaus, Nördliche Flachkopfbeutelmaus.
· Taxonomie/Etymologie: Ursprünglich als Phascogale ingrami beschrieben. Die Art wurde nach Sir William Ingram benannt, der unter anderem als Hobby-Ornithologe und Sammler tätig war und die Sammelexpedition nach Australien sponserte.
· Bestand: Nicht gefährdet; Population stabil.
· Verbreitung: Ozeanien (Australien: Westaustralien, Nördliches Territorium, Queensland, Südaustralien).
· Literatur: Baker (2015, 2020); Jackson & Groves (2015); Thomas (1906); Woinarski, van Weenen & Burbidge (2016).
Therapsida > Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Sminthopsinae > Sminthopsinae
|
|
|
|
|
|
|
Sminthopsinae |
|
|||
|
|
|
|||
|
|
|
|||
|
|
|
|||
|
|
|
|
|
Subfamilia Sminthopsinae Archer, 1982 (Unterfamilie Schmalfußbeutelmäuse):
· 26 Arten. Der Stammbaum basiert auf den Ergebnissen von Westerman et al. (2016).
· Literatur: Archer (1982); Westerman et al. (2016).
Genus Antechinomys
Krefft, 1867
(Gattung Springbeutelmäuse):
· 3 Arten; Stammbaum basiert auf den Ergebnissen von Westerman, Umbrello & Woolley (2023).
· Literatur: Jackson & Groves (2015); Krefft (1867); Westerman, Umbrello & Woolley (2023).
Genus Ningaui
Archer, 1975 (Gattung
Ningauis):
· 3 Arten; Generotypus Ningaui timealeyi Archer, 1975; Stammbaum nach den Ergebnissen von Westerman, Umbrello & Woolley (2023).
· Taxonomie/Etymologie: Nach neueren genetischen Untersuchungen bildet die Gattung Ningaui das Schwestertaxon zur Gattung Antechinomys (Westerman, Umbrello & Woolley, 2023). Der Gattungsname Ningaui ist eine Bezeichnung aus der Mythologie der Aborigines für kleine, haarige Wesen mit kurzen Füßen, die nur nachts herauskommen, alles jagen und roh verzehren. Er wurde gewählt, weil die Vertreter der Gattung wie die beschriebenen Wesen klein, haarig und nachtaktiv sind sowie im Verhältnis zu den verwandten Sminthopsis-Arten kurze Füße besitzen.
· Literatur: Archer (1975); Baker (2015, 2020); Westerman, Umbrello & Woolley (2023).
Genus Sminthopsis
Thomas, 1887
(Gattung Eigentliche
Schmalfußbeutelmäuse):
· 20 Arten; Generotypus Sminthopsis crassicaudata (Gould, 1844). Die Gattung ist eventuell paraphyletisch bezüglich Antechinomys und Ningaui (Westerman, Umbrello & Woolley, 2023; Krajewski et al., 2012). Der Stammbaum orientiert sich an den Ergebnissen von Westerman, Umbrello & Woolley (2023), Krajewski et al. (2012) und Blacket et al. (2001, 2006).
· Synonyme: Podabrus Gould, 1845 (ungültig, da Käfergattung Podabrus Westwood, 1840 Priorität hat).
· Literatur: Gould (1844, 1845); Krajewski et al. (2012); Thomas (1887); Westerman, Umbrello & Woolley (2023).
Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Sminthopsinae > Sminthopsini
> Antechinomys
Genus Antechinomys
Krefft, 1867
(Gattung Springbeutelmäuse):
· 3 Arten; Stammbaum basiert auf den Ergebnissen von Westerman, Umbrello & Woolley (2023).
· Literatur: Jackson & Groves (2015); Krefft (1867); Westerman, Umbrello & Woolley (2023).
Antechinomys longicaudatus (Spencer, 1909) (Langschwänzige Springbeutelmaus/Long-tailed Kultarr):
· Holotypus/Terra typica: NMV C7803 (Nationalmuseum von Viktorien Melbourne), gesammelt in Westaustralien.
· Taxonomie/Etymologie: Zunächst als Sminthopsis longicaudata beschrieben, überführten Westerman, Umbrello & Woolley (2023) die Art aufgrund genetischer Analysen, die sie als Schwestertaxon zum Antechinomys laniger-Komplex identifizierten, in die Gattung Antechinomys. Das Artepitheton setzt sich aus den lateinischen Wörtern longus für „lang“ und caudatus für „geschwänzt“ ab und bezieht sich auf den im Verhältnis zu anderen Schmalfußbeutelmäusen langen Schwanz.
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Australien: Westaustralien, Nördliches Territorium).
· Literatur: Baker (2015, 2020); Jackson & Groves (2015); McKenzie, Woinarski & Burbridge (2016); Spencer (1909); Westerman, Umbrello & Woolley (2023).
Antechinomys laniger (Gould, 1856)
(Jerboa-Springbeutelmaus/Eastern
Kultarr):
· Holotypus/Terra typica: BM 47.8.14.22 (Haut) und 47.12.4.5 (Schädel) (Britisches Museum für Naturgeschichte London), adultes Männchen, gesammelt von Thomas Mitchell in der Ebene zwischen Murray-Fluss und Darling-Fluss, Neusüdwales, Australien.
· Taxonomie: Ursprünglich als Phascogale lanigera beschrieben, überführte Krefft (1867) sie später in die eigene Gattung Antechinomys, wobei erst Thomas (1888) den Artnamen von lanigera zu laniger änderte. Das Taxon spenceri wird oft als Synonym (Archer, 1977) oder Unterart (Strahan, 1983) von laniger geführt, doch genetische Analysen von Westerman, Umbrello & Woolley (2023) unterstützen den Artstatus von spenceri und deuten außerdem daraufhin, dass es sich bei den Populationen weiter westlich um eine weitere, unbeschriebene Art handelt.
· Bestand: Nicht gefährdet.
· Verbreitung: Ozeanien (Australien).
· Literatur: Archer (1977); Baker (2015, 2020); Burbidge & Woinarski (2016); Gould (1856); Jackson & Groves (2015); Krefft (1867); Strahan (1983); Thomas (1888); Westerman, Umbrello & Woolley (2023).
Antechinomys spenceri O. Thomas, 1906 (Spencer-Springbeutelmaus/Spencer’s Kultarr):
· Holotypus/Terra typica: BM 97.11.3.12 (Britisches Museum für Naturgeschichte London), Weibchen (Schädel und Körper in Alkohol), gesammelt bei Charlotte Waters, Nördliches Territorium, Australien.
· Taxonomie: Ursprünglich als eigenständige Art beschrieben, wurde spenceri später oft als Synonym (Archer, 1977) oder Unterart (Strahan, 1983) von laniger betrachtet.
· Bestand: Daten defizitär.
· Verbreitung: Ozeanien (Australien).
· Literatur: Archer (1977); Baker (2015, 2020); Jackson & Groves (2015); Strahan (1983); Thomas (1906); Westerman, Umbrello & Woolley (2023).
Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Sminthopsinae > Sminthopsini
> Ningaui
Genus Ningaui
Archer, 1975 (Gattung
Ningauis):
· 3 Arten; Generotypus Ningaui timealeyi Archer, 1975. Stammbaum nach den Ergebnissen von Westerman, Umbrello & Woolley (2023).
· Taxonomie/Etymologie: Nach neueren genetischen Untersuchungen bildet die Gattung Ningaui das Schwestertaxon zur Gattung Antechinomys (Westerman, Umbrello & Woolley, 2023). Der Gattungsname Ningaui ist eine Bezeichnung aus der Mythologie der Aborigines für kleine, haarige Wesen mit kurzen Füßen, die nur nachts herauskommen, alles jagen und roh verzehren. Er wurde gewählt, weil die Vertreter der Gattung wie die beschriebenen Wesen klein, haarig und nachtaktiv sind sowie im Verhältnis zu den verwandten Sminthopsis-Arten kurze Füße besitzen.
· Literatur: Archer (1975); Baker (2015, 2020); Westerman, Umbrello & Woolley (2023).
Ningaui timealeyi Archer, 1975 (Pilbara-Ningaui/Pilbara Ningaui):
· Holotypus/Terra typica: WAM M6181 (Westaustralisches Museum Perth), jungerwachsenes Weibchen, gesammelt von A. Snell am 7. Juli 1963 ca. 32,2 km südöstlich vom Berg Robinson, nordwestliches Westaustralien.
· Taxonomie/Etymologie: Exemplare der Art wurden vorher zu Planigale tenuirostris Ride, 1970 gerechnet, bevor sie als neue Art Ningaui timealeyi beschrieben wurden. Der wissenschaftliche Name wurde zu Ehren des Ökologen und Umweltwissenschaftlers Dr. Eric Herbert Mitchell ‚Tim‘ Ealey von der Monash-Universität gewählt, der das erste Exemplar der Gattung Ningaui sowie andere seltene Arten wie Antechinus rosamondae gesammelt hat.
· Bestand: Nicht gefährdet.
· Verbreitung: Ozeanien (Australien: Pilbara-Region, Gascoyne-Region und Kleine Sandwüste in Westaustralien).
· Literatur: Archer (1975); Baker (2015, 2020); Burbidge (2016).
Ningaui ridei Archer, 1975 (Ride-Ningaui/Wongai Ningaui):
· Alternative Bezeichnung: Wongai-Ningaui, Inland-Ningaui.
· Holotypus/Terra typica: WAM M8080 (Westaustralisches Museum Perth), jungerwachsenes Weibchen, gesammelt von E. Pianka im Februar 1967 an der Straße White Cliffs Road, ca. 38,6 km Ost-Nordost von Laverton, Westaustralien.
· Taxonomie/Etymologie: Exemplare der Art wurden vorher zu Planigale ingrami Ride, 1970 gerechnet, bevor sie als neue Art Ningaui ridei beschrieben wurden. Der wissenschaftliche Name wurde zu Ehren des Zoologen und ehemaligen Direktors des Westaustralischen Museums Dr. William David Lindsay Ride gewählt, der schon früh auf die Komplexität und mögliche Polyphylie der unter Planigale zusammengefassten Beuteltier hinwies.
· Bestand: Nicht gefährdet.
· Verbreitung: Ozeanien (Australien: Westaustralien, Nördliches Territorium, Queensland, Südaustralien).
· Literatur: Archer (1975); Baker (2015, 2020); Woinarski, van Weenen & Burbidge (2016).
Ningaui yvonneae Kitchener, Stoddart & Henry, 1983 (Yvonne-Ningaui/Southern Ningaui):
· Alternative Bezeichnung: Südliches Ningaui, Kitchener-Ningaui, Mallee-Ningaui.
· Holotypus/Terra typica: WAM 20466 (Westaustralisches Museum Perth), adultes Männchen, gesammelt von A. A. Burbidge am 9. September 1980 im Gebiet des Berges Manning, westaustralische Goldfelder, Australien.
· Taxonomie/Etymologie: Nach genetischen Analysen handelt es sich bei N. yvonneae um das Schwestertaxon zu N. ridei. Die Art wurde nach Yvonne Carole Kitchener benannt. Sie ist die Frau von D. J. Kitchener, des Hauptautors der Erstbeschreibung.
· Bestand: Nicht gefährdet.
· Verbreitung: Ozeanien (Australien: Westaustralien, Südaustralien, Neusüdwales, Viktorien).
· Literatur: Baker (2015, 2020); Ellis et al. (2016); Kitchener, Stoddart & Henry (1983).
Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Dasyuridae > Sminthopsinae > Sminthopsini
> Sminthopsis
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
Sminthopsis |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Genus Sminthopsis
Thomas, 1887
(Gattung Eigentliche
Schmalfußbeutelmäuse):
· 20 Arten; Generotypus Sminthopsis crassicaudata (Gould, 1844). Die Gattung ist eventuell paraphyletisch bezüglich Antechinomys und Ningaui (Westerman, Umbrello & Woolley, 2023; Krajewski et al., 2012). Der Stammbaum orientiert sich an den Ergebnissen von Westerman, Umbrello & Woolley (2023), Krajewski et al. (2012) und Blacket et al. (2001, 2006).
· Synonyme: Podabrus Gould, 1845 (ungültig, da Käfergattung Podabrus Westwood, 1840 Priorität hat).
· Literatur: Gould (1844, 1845); Krajewski et al. (2012); Thomas (1887); Westerman, Umbrello & Woolley (2023).
Sminthopsis crassicaudata (Gould, 1844) (Dickschwänzige
Schmalfußbeutelmaus/Fat-tailed Dunnart):
· Terra typcia: Gesammelt bei einer Militärstation am Fluss Williams River, Westaustralien, Australien.
· Taxonomie/Etymologie: Ursprünglich als Phascogale crassicaudata beschrieben. Thomas (1888) stellte die Art schließlich in die Gattung Sminthopsis. Üblicherweise werden zwei Unterarten unterschieden, wobei centralis häufig auch als Synonym von crassicaudata betrachtet (Archer, 1979). Cooper, Adams & Labrinidis (2000) konnten in ihren Analysen zwar zwei genetische Linien (Nordwest-Klade und Südost-Klade) feststellen, doch stimmen diese mit der bisherigen morphologischen Unterscheidung und Verbreitung der Unterarten nicht überein. Weitere Untersuchungen sind zur Klärung notwendig.
·
Unterarten:
1. S. crassicaudata crassicaudata (Gould, 1844)
(Gemeine Dickschwanz-Schmalfußbeutelmaus/Common Fat-tailed Dunnart).
2. S. crassicaudata centralis Thomas, 1902 (Trockengebiets-Dickschwanz-Schmalfußbeutelmaus/Drylands Fat-tailed Dunnart). Holotypus BM2987 (Britisches Museum für Naturgeschichte) gesammelt am 21. Juni 1902 bei Kilalpannina, Eyresee-Becken, Südaustralien, Australien.
· Bestand: Nicht gefährdet; Population stabil.
· Verbreitung: Ozeanien (Australien).
· Literatur: Archer (1979); Burbidge et al. (2016); Cooper, Adams & Labrinidis (2000); Gould (1844); Thomas (1888, 1902).
Sminthopsis bindi Van Dyck, Woinarski & Press, 1994 (Kakadu-Schmalfußbeutelmaus/Kakadu
Dunnart):
· Holotypus/Terra typica: NTMU944 (Nördliches Territorium-Museum Darwin), adultes München, gesammelt von J. Woinarski am 22. Februar 1991 an der Eva-Valley-Station im Kakadu-Nationalpark, Nördliches Territorium, Australien.
· Taxonomie/Etymologie: Nach Analysen von Westerman, Umbrello & Woolley (2023) ist bindi in die macroura-Gruppe einzuordnen, die eine basale Stellung innerhalb des Tribus Sminthopsini einnimmt. Der wissenschaftliche Artname leitet sich von dem Wort Bindi des Jawoyn-Volkes für kleine Raubbeutler ab. Die Jawoyn bewohnen traditionell das Gebiet, in dem die meisten Belegexemplare gefangen wurden.
· Bestand: Potenziell gefährdet (Vorwarnliste); Population abnehmend.
· Verbreitung: Ozeanien (Australien: Nördliche Territorium).
· Literatur: Van Dyck, Woinarski & Press (1994); Westerman, Umbrello & Woolley (2023); Woinarski & Burbidge (2016).
Sminthopsis douglasi Archer,
1979 (Douglas-Schmalfußbeutelmaus/Julia
Creek Dunnart):
· Alternative Bezeichnung: Julia-Schmalfußbeutelmaus.
· Bestand: Potenziell gefährdet (Vorwarnliste); Population abnehmend.
· Verbreitung: Ozeanien (Australien: Queensland).
· Literatur: Archer (1979); Burnett & Winter (2019); Hume, Smith & Woolley (2000).
Sminthopsis virginiae (de
Tarragon, 1847) (Rotwangen-Schmalfußbeutelmaus/Red-cheeked
Dunnart):
· Alternative Bezeichnung: Queensland-Schmalfußbeutelmaus.
· Taxonomie: Ursprünglich als Phascogale virginiae beschrieben. Die Validität der Unterarten virginiae, nitela und rufigenis wird durch die genetischen Analysen von Blacket et al. (2001) gestützt, wobei bei nitela durch weitere Untersuchungen auch zu prüfen ist, ob es sich um eine separate Art handelt.
· Unterarten:
1. S. virginiae virginiae (de Tarragon,
1847) (Queensland-Rotwangen-Schmalfußbeutelmaus/Eastern Red-cheeked
Dunnart).
2. S. virginiae nitela Collett, 1897 (Westliche Rotwangen-Schmalfußbeutelmaus/Western Red-cheeked Dunnart).
3. S. virginiae rufigenis O. Thomas, 1922 (Neuguinea-Rotwangen-Schmalfußbeutelmaus/Northern Red-cheeked Dunnart).
· Bestand: Nicht gefährdet; Population stabil.
· Verbreitung: Ozeanien (Australien: Queensland, Nördliches Territorium, Westaustralien; Indonesien: Westpapua, Aru-Inseln; Papua-Neuguinea).
· Literatur: Blacket et al. (2001); Collett (1897); De Tarragon (1847); Helgen et al. (2016); Luckett & Woolley (1996); Taplin (1980); Thomas (1922).
Sminthopsis macroura (Gould, 1845) (Streifengesichtige Schmalfußbeutelmaus/Stripe-faced Dunnart):
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Australien).
· Literatur: Woinarski & Dickman (2016).
Sminthopsis froggatti (Ramsay, 1887)
(Froggatt-Schmalfußbeutelmaus/Froggatt’s
Dunnart):
· Taxonomie: Ursprünglich beschrieben als Antechinus (Podabrus) froggatti.
· Bestand: Nicht bewertet.
· Verbreitung: Ozeanien (Australien).
· Literatur: Ramsay (1887).
Sminthopsis stalkeri Thomas,
1906 (Stalker-Schmalfußbeutelmaus/Stalker’s
Dunnart):
· Bestand: Nicht bewertet.
· Verbreitung: Ozeanien (Australien).
· Literatur: Thomas (1906).
Sminthopsis granulipes Troughton, 1932 (Kornsohlen-Schmalfußbeutelmaus/White-tailed Dunnart):
· Alternative Bezeichnung: Weißschwänzige Schmalfußbeutelmaus.
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Australien: Südwestliches Westaustralien).
· Literatur: McKenzie (2016); Troughton (1932).
Sminthopsis psammophila Spencer, 1895 (Sand-Schmalfußbeutelmaus/Sandhill
Dunnart):
· Alternative Bezeichnung: Dünen-Schmalfußbeutelmaus.
· Bestand: Gefährdet; Population abnehmend.
· Verbreitung: Ozeanien (Australien: Südaustralien, Westaustralien).
· Literatur: Spencer (1895); Woinarski & Burbidge (2016).
Sminthopsis hirtipes Thomas, 1898 (Polster-Schmalfußbeutelmaus/Greater Hairy-footed Dunnart):
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Australien: Westaustralien, Südaustralien, Nördliches Territorium, Queensland).
· Literatur: McKenzie & Dickman (2016).
· Bestand: Nicht gefährdet; Population stabil.
· Verbreitung: Ozeanien (Australien: Westaustralien, Nördliches Territorium, Südaustralien, Queensland).
· Literatur: McKenzie & Dickman (2016).
· Alternative Bezeichnung: Känguru-Insel-Schmalfußbeutelmaus.
· Bestand: Vom Aussterben bedroht; Population abnehmend.
· Verbreitung: Ozeanien (Australien: Känguru-Insel).
· Literatur: Kitchener, Stoddart & Henry (1984); Van Weenen (2008).
Sminthopsis fuliginosus (Gould, 1852)
(Graubäuchige
Schmalfußbeutelmaus/Grey-bellied Dunnart):
· Alternative Bezeichnung: Rußige Schmalfußbeutelmaus.
· Taxonomie: Ursprünglich als Antechinus fuliginosus beschreiben.
· Synonyme: Sminthopsis boullangerensis Crowther, Dickman & Lynam, 1999; Sminthopsis grisoventer Kitchener, Stoddart & Henry, 1984.
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt; von IUCN noch als Sminthopsis griseoventer geführt.
· Verbreitung: Ozeanien (Australien).
· Literatur: Baker (2015, 2020); Crowther, Dickman & Lynam (1999); Gould (1852); Kitchener, Stoddart & Henry (1984); McKenzie & Kemper (2016).
Sminthopsis ooldea Troughton,
1965 (Ooldea-Schmalfußbeutelmaus/Ooldea Dunnart):
· Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Australien: Westaustralien, Südaustralien, Nördliches Territorium).
· Literatur: Burbidge, Robinson & Woinarski (2016); Troughton (1965).
Sminthopsis archeri Van Dyck, 1986 (Kastanienbraune
Schmalfußbeutelmaus/Chestnut Dunnart):
· Alternative Bezeichnung: Archer-Schmalfußbeutelmaus.
· Holotypus/Terra typica: PNGM 1663 (Nationalmuseum und Kunstgalerie Papua-Neuguinea Port Moresby), adultes Männchen, gesammelt von J. Waithman am 30. Juli 1973 bei Morehead in der Trans-Fly-Ebene, Papua-Neuguinea.
· Taxonomie/Etymologie: Benannt nach Dr. Michael Archer, um dessen umfangreiche Arbeiten in Zoologie und Paläontologie zu würdigen.
· Bestand: Daten defizitär; Populationsentwicklung unbekannt.
· Verbreitung: Ozeanien (Papua-Neuguinea; Australien: Queensland).
· Literatur: Baker (2015, 2020); Van Dyck (1986); Woolley et al. (2016).
Sminthopsis butleri Archer,
1979 (Kimberley-Schmalfußbeutelmaus/Carpentarian
Dunnart):
· Bestand: Gefährdet; Population abnehmend.
· Verbreitung: Ozeanien (Australien: Kimberley-Region in Westaustralien, Tiwi-Inseln des Nördlichen Territoriums).
· Literatur: Archer (1979); McKnight (2019).
Sminthopsis dolichura Kitchener, Stoddart & Henry, 1984
(Kleine Langschwänzige
Schmalfußbeutelmaus/Little Long-tailed Dunnart):
· Bestand: Nicht gefährdet; Population stabil.
· Verbreitung: Ozeanien (Australien: Westaustralien, Südaustralien).
· Literatur: Kitchener, Stoddart & Henry (1984); McKenzie, van Weenen & Kemper (2016).
Sminthopsis leucopus (E. Gray, 1842) (Rippsohlen-Schmalfußbeutelmaus/White-footed Dunnart):
· Alternative Bezeichnung: Weißfüßige Schmalfußbeutelmaus.
· Unterarten:
1. S. leucopus leucopus (E. Gray, 1842)
(Tasmanien-Rippsohlen-Schmalfußbeutelmaus/Tasmanian White-footed Dunnart).
2. S. leucopus ferruginifrons Gould, 1854 (Viktoria-Rippsohlen-Schmalfußbeutelmaus/Victoria White-footed Dunnart).
3. S. leucopus janetzkiae Lavery, Collett, Fisher, Hoskin & Rowland, 2023 (Queensland-Rippsohlen-Schmalfußbeutelmaus/Wet Tropics White-footed Dunnart). Holotypus QM JM20890 (Queensland-Museum, adultes Männchen, gesammelt am 6. August 2016 von R. Collett und J. Rowland nahe Mt Edith Rd (Höhe 900 m), Danbulla-Nationalpark, Australien.
· Bestand: Nicht gefährdet; Population stabil.
· Verbreitung: Ozeanien (Australien: Queensland, Neusüdwales, Viktorien, Tasmanien).
· Literatur: Baker (2015, 2020); Burbidge & Woinarski (2020); Gould (1854); Gray (1842); Lavery et al. (2023).
Sminthopsis gilberti Kitchener, Stoddart & Henry, 1984 (Gilbert-Schmalfußbeutelmaus/Gilbert’s
Dunnart):
· Bestand: Nicht gefährdet; Population stabil.
· Verbreitung: Ozeanien (Australien: Westaustralien).
· Literatur: Kitchener, Stoddart & Henry (1984); McKenzie (2016).
Sminthopsis murina (Waterhouse, 1838) (Kleine Schmalfußbeutelmaus/Common Dunnart):
·
Unterarten:
1. S. murina murina (Waterhouse, 1838) (Schmalschwänzige
Schmalfußbeutelmaus/Slender-tailed Dunnart).
2. S. murina tatei Troughton, 1965 (Tate-Schmalfußbeutelmaus/Tate’s Dunnart).
· Bestand: Nicht gefährdet; Population abnehmend.
· Verbreitung: Ozeanien (Australien: Queensland, Neusüdwales, Südaustralien).
· Literatur: Dickman, Burnett & McKenzie (2016); Righetti, Fox & Croft (2000); Troughton (1965); Waterhouse (1838).
Amniota > Therapsida > Mammalia > Theria
> Metatheria > Australidelphia > Dasyuromorphia > Myrmecobiidae > Myrmecobius
|
Myrmecobiidae |
|
Myrmecobius |
|
|
|
|
|
Familia Myrmecobiidae Waterhouse, 1841
(Familie Ameisenbeutler):
· 1 Art; nominotypische Gattung Myrmecobius Waterhouse, 1836; nominotypische Art Myrmecobius fasciatus Waterhouse, 1836.
· Literatur: Waterhouse (1836, 1841).
Genus Myrmecobius Waterhouse, 1836 (Gattung
Numbats):
· 1 Art; Generotypus Myrmecobius fasciatus Waterhouse, 1836.
· Taxonomie: Myrmecobius stellt die einzige rezente Gattung innerhalb der Familie Myrmecobiidae dar. Der wissenschaftliche Gattungsname leitet sich von den griechischen Wörtern μύρμηκοι für „von Ameisen“ und βíος für „lebend“ ab, was darauf hinweisen soll, dass sich die Tiere dieser Gattung von Ameisen ernähren.
· Literatur: Waterhouse (1836).
Myrmecobius fasciatus Waterhouse,
1836
(Gebänderter
Ameisenbeutler/Banded Anteater):
· Holotypus/Terra typica: My Kokeby, südlich von Beverly, Westaustralien, Australien.
· Taxonomie/Etymologie: Das aus dem Latein stammende Artepitheton fasciatus bedeutet „gestreift“ und bezieht sich auf den gestreiften Rücken der Art.
·
Unterarten:
1. M. fasciatus fasciatus Waterhouse, 1836 (Westlicher Gebänderter Ameisenbeutler/Western
Banded Anteater).
2. †M. fasciatus rufus Wood Jones, 1923 (Südlicher Gebänderter Ameisenbeutler/Southern Banded Anteater).
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge 200-290 mm; Schwanzlänge 125-213 mm; Gewicht 305-647 g.
· Bestand: Stark gefährdet; Population abnehmend; Unterart Südlicher Gebänderter Ameisenbeutler Ausgestorben.
· Verbreitung: Ozeanien (Australien: Neusüdwales, in Südaustralien und Westaustralien wieder angesiedelt).
· Literatur: Baker & Gynther (2023); Waterhouse (1836); Woinarski & Burbidge (2016); Wood Jones (1923).
Referenzen:
1)
Aitken, P. F. (1972). Planigale gilesi
(Marsupialia, Dasyuridae); a new species from the interior of south eastern
Australia. Records of the South
Australian Museum 16 (10): 1-14.
2)
AMTC
(2022). The Australasian Taxonomy Mammal Consortium Australian Mammal Species
List. Version 2.0.
https://australianmammals.org.au/publications/amtc-species-list. Stand
27.02.2023.
3) Aplin, K. P.,
Rhind, S. G., Ten Have, J. & Chesser, R. T. (2015). Taxonomic revision of Phascogale
tapoatafa (Meyer, 1793)
(Dasyuridae; Marsupialia), including descriptions of two new subspecies and
confirmation of P. pirata Thomas, 1904 as a ‘Top End’ endemic. Zootaxa 4055 (1): 1-73.
4)
Archer, M. (1975). Ningaui, a new genus of tiny dasyurids (Marsupialia) and two new
species, N. timealeyi and N. ridei, from arid Western Australia. Memoirs of the Queensland Museum 17 (2): 237-249.
5)
Archer, M. (1976). A revision of the marsupial genus Planigale Troughton (Dasyuridae). Memoirs
of the Queensland Museum 17 (3):
341-365.
6) Archer, M. (1977). Revision of the dasyurid marsupial genus Antechinomys Krefft. Memoirs of the Queensland Museum 18 (1): 17-29.
7)
Archer, M. (1979). Two new species of Sminthopsis Thomas (Dasyuridae: Marsupialia) from northern Australia, S. butleri and S. douglasi. The Australian
Zoologist 20 (2): 327-345.
8)
Archer, M. (1982). Review of dasyurid
(Marsupialia) fossil record, integration of data bearing on phylogenetic
interpretation, and suprageneric classification. S. 397-443 in: Archer, M. (Hrsg.) (1982). Carnivorous
Marsupials Volume 2. Royal Zoological
Society of New South Wales, Sydney.
9)
Armstrong, L. A., Krajewski, C. & Westerman, M. (1998).
Phylogeny of the dasyurid marsupial genus Antechinus
based on cytochrome-b, 12S-rRNA, and protamine-P1 genes. Journal of Mammalogy 79 (4): 1379-1389.
10) Baker, A.
M., Mutton, T. Y. & Hines, H. B. (2013).
A new dasyurid marsupial from Kroombit Tops, south-east Queensland, Australia:
the silver-headed antechinus, Antechinus
argentus sp. nov. (Marsupialia: Dasyuridae). Zootaxa 3746 (2):
201-239.
11)
Baker, A. M. (2015). Family
Dasyuridae (Carnivorous Marsupials). S. 232-348 in: Wilson, D. E. & Mittermeier, R. A. (Hrsg.) (2015).
Handbook of the Mammals of the World Volume 5 – Monotremes and Marsupials. Lynx Edicions, Barcelona.
12)
Baker, A. M. (2020). Family
Dasyuridae (Carnivorous Marsupials). S. 60-70 in: Burgin, C. J., Wilson, D. E., Mittermeier, R. A., Rylands, A.
B., Lacher, T. E. & Sechrest, W. (Hrsg.) (2020). Illustrated
Checklist of the Mammals of the World Volume 1 – Monotremata to Rodentia. Lynx Edicions, Barcelona.
13)
Baker, A. M. (2023). Family Dasyuridae – Carnivorous Marsupials. S. 43-49 in: Lynx Nature Books (2023). All the
Mammals of the World. Lynx Nature Books,
Barcelona.
14)
Baker, A. & Dickman, C. (2018). Secret Lives of Carnivorous
Marsupials. CSIRO Publishing, Clayton
South.
15)
Baker, A. M. & Gynther, I. C. (Hrsg.)
(2023). Strahan’s Mammals of Australia – Fourth Edition. New Holland Publishers, Wahroonga.
16) Baker, A.
M., Mutton, T. Y., Hines, H. B. & Van Dyck, S. (2014). The black-tailed antechinus, Antechinus
arktos sp. nov.: a new species of carnivorous marsupial from montane regions of
the Tweed Volcano caldera, eastern Autralia. Zootaxa 3765 (2):
101-133.
17)
Baker, A. M., Mutton, T. Y., Mason, E. D. & Gray,
E. L. (2015). A taxonomic assessment of the
Australian dusky antechinus complex: A new species, the Tasman Peninsula dusky
antechinus (Antechinus vandycki sp.
nov.) and an elevation to species of the mainland dusky antechinus (Antechinus swainsonii mimetes (Thomas)). Memoirs of the Queensland Museum 59: 75-126.
18)
Baker, A. M., Mutton, T. Y. & Van Dyck, S. (2012). A new dasyurid marsupial
from eastern Queensland, Australia: The buff-footed antechinus, Antechinus mysticus sp. nov.
(Marsupialia: Dasyuridae). Zootaxa 3515: 1-37.
19)
Baker, A. M. & Van Dyck, S. (2015). Taxonomy and redescription of the swamp antechinus, Antechinus minimus (È. Geoffroy) (Marsupialia: Dasyuridae). Memoirs of the Queensland Museum 59: 127-170.
20)
Beck, R. M. D., Godthelp, H., Weisbecker, V., Archer,
M. & Hand, S. J. (2008). Australia’s oldest marsupial fossils and their biogeographical
implications. PloS one 3 (3): e1858.
21) Belcher, C. A. (1995). Diet of the tiger quoll (Dasyurus maculatus) in East Gippsland, Victoria. Wildlife Research 22 (3): 341-357.
22)
Blacket, M. J., Adams, M., Cooper, S. J. B., Krajewski, C. & Westerman,
M. (2001). Systematics and evolution of the dasyurid
marsupial genus Sminthopsis: I. The macroura species group. Journal of Mammalian Evolution 8 (2): 149-170.
23) Blacket, M. J., Adams, M.,
Krajewski, C. & Westerman, M. (2000). Genetic variation within the
dasyurid marsupial genus Planigale. Australian Journal of Zoology 48 (5): 443-459.
24) Boitard, P. M. (1841). Le Jardin
des Plantes, description et moeurs des mammifères de la Ménagerie et du Muséum
d’Histoire Naturelle. J. J. Dubochet,
Paris.
25) Bonaparte, C. L. (1838). Synopsis
vertebratorum systematis. Nuovi Annali
delle Scienze Naturali, Bologna 2
(1): 105-133.
26) Burbidge, A.
(2016). Dasykaluta
rosamondae. The IUCN Red
List of Threatened Species 2016:
e.T40527A21943336.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40527A21943336.en. Stand 25.
Februar 2023.
27) Burbidge, A.
(2016). Ningaui
timealeyi. The IUCN Red
List of Threatened Species 2016:
e.T40530A21944037. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40530A21944037.en.
Stand 13. Februar 2023.
28) Burbidge,
A., Cooper, N. & Morris, K. (2016). Pseudantechinus roryi. The IUCN Red List of Threatened Species 2016:
e.T136620A21945749.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T136620A21945749.en. Stand 13.
Februar 2023.
29) Burbidge,
A., Cooper, N., Woolley, P. & Morris, K. (2016). Pseudantechinus woolleyae. The IUCN Red List of Threatened Species 2016: e.T40539A21945425.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40539A21945425.en. Stand 23.
Februar 2023.
30) Burbidge, A. A., Eldridge, M.
D. B., Groves, C., Harrison, P. L., Jackson, S. M., Reardon, T. B., Westerman,
M. & Woinarski, J. C. Z. (2014). A list of native Australian species and
subspecies. S. 15-32 in: Woinarski, J. C.
Z., Burbidge, A. A. & Harrison, P. L. (Hrsg.) (2014). The Action
Plan for Australian Mammals 2012. CSIRO
Publishing, Collingwood.
31) Burbidge,
A., Robinson, T., Ellis, M., Dickman, C., Menkhorst, P. & Woinarski, J. (2016). Sminthopsis crassicaudata.
The IUCN Red
List of Threatened Species 2016:
e.T40541A21948539.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40541A21948539.en. Stand 13.
Februar 2023.
32) Burbidge,
A., Robinson, T. & Woinarski, J. (2016). Sminthopsis ooldea. The IUCN Red
List of Threatened Species 2016:
e.T40548A21949221. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40548A21949221.en.
Stand 13. Februar 2023.
33) Burbidge, A.
A. & Woinarski, J. (2016). Antechinomys laniger. The IUCN Red
List of Threatened Species 2016:
e.T1581A21943713.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T1581A21943713.en. Stand 13.
Februar 2023.
34) Burbidge, A.
A. & Woinarski, J. (2016). Dasyurus viverrinus. The IUCN Red
List of Threatened Species 2016:
e.T6296A21947190. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T6296A21947190.en.
Stand 13. Februar 2023.
35) Burbidge, A.
A. & Woinarski, J. (2016). Parantechinus apicalis. The IUCN Red List of Threatened Species 2016:
e.T16138A21944584. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T16138A21944584.en.
Stand 13. Februar 2023.
36) Burbidge, A.
A. & Woinarski, J. (2016). Pseudantechinus ningbing. The IUCN Red List of Threatened Species 2016:
e.T40538A21945674.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40538A21945674.en. Stand 13.
Februar 2023.
37) Burbidge, A.
A. & Woinarski, J. (2016). Thylacinus cynocephalus. The IUCN Red List of Threatened Species 2016:
e.T21866A21949291.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T21866A21949291.en. Stand 13.
Februar 2023.
38) Burbidge, A.
A. & Woinarski, J. (2020). Phascogale tapoatafa. The IUCN Red
List of Threatened Species 2020:
e.T16890A166495589.
http://dx.doi.org/10.2305/IUCN.UK.2020-1.RLTS.T16890A166495589.en. Stand 13.
Februar 2023.
39) Burbidge, A.
A. & Woinarski, J. (2020). Sminthopsis leucopus. The IUCN Red
List of Threatened Species 2020:
e.T20297A166496257.
http://dx.doi.org/10.2305/IUCN.UK.2020-1.RLTS.T20297A166496257.en. Stand 13.
Februar 2023.
40) Burnett, S.
& Dickman, C. (2016). Antechinus stuartii. The IUCN Red
List of Threatened Species 2016:
e.T40526A21946655.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40526A21946655.en. Stand 13.
Februar 2023.
41) Burnett, S.
& Dickman, C. (2016). Antechinus subtropicus. The IUCN Red List of Threatened Species 2016: e.T136755A21946164.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T136755A21946164.en. Stand 13.
Februar 2023.
42) Burnett, S.
& Dickman, C. (2016). Planigale maculata. The IUCN Red
List of Threatened Species 2016:
e.T40535A21944685. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40535A21944685.en.
Stand 13. Februar 2023.
43) Burnett, S. & Dickman, C. (2018). Dasyurus maculatus. The IUCN Red List of Threatened Species 2018: e.T6300A21946847.
http://dx.doi.org/10.2305/IUCN.UK.2018-2.RLTS.T6300A21946847.en. Stand 19.
Februar 2023.
44) Burnett, S.
& Winter, J. (2016). Antechinus adustus. The IUCN Red
List of Threatened Species 2016:
e.T136555A21946505.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T136555A21946505.en. Stand 13.
Februar 2023.
45) Burnett, S.
& Winter, J. (2016). Antechinus leo. The IUCN Red
List of Threatened Species 2016:
e.T1584A21946093.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T1584A21946093.en. Stand 13.
Februar 2023.
46) Burnett, S.
& Winter, J. (2019). Antechinus godmani. The IUCN Red
List of Threatened Species 2019:
e.T1583A21945986.
http://dx.doi.org/10.2305/IUCN.UK.2019-1.RLTS.T1583A21945986.en. Stand 13.
Februar 2023.
47) Burnett, S.
& Winter, J. (2019). Sminthopsis douglasi. The IUCN Red
List of Threatened Species 2019:
e.T20290A21948305.
http://dx.doi.org/10.2305/IUCN.UK.2019-1.RLTS.T20290A21948305.en. Stand 13.
Februar 2023.
48)
Cannella, E., Browne-Cooper, R., Fairbairn, K. &
Turpin, J. (2019). Possible sympatry between
kenngoor (Phascogale calura) and
wambenger (Phascogale tapoatafa wambenger).
Australian Mammalogy 41 (2): 266-268.
49)
Cardillo, M., Bininda-Emonds, O. R. P., Boakes, E.
& Purvis, A. (2004).
A species-level phylogenetic supertree of marsupials. Journal of Zoology 264
(1): 11-31.
50) Cooper, N. K., Aplin, K. P. & Adams, M. (2000). A new species of false Antechinus (Marsupialia: Dasyuromorphia: Dasyuridae) from the Pilbara region, Western Australia. Records of the Western Australian Museum 20 (1): 115-136.
51) Cooper, S. J. B., Adams, M. & Labrinidis, A. (2000). Phylogeography of the Australian dunnart Sminthopsis crassicaudata (Marsupialia: Dasyuridae). Australian Journal of Zoology 48 (5): 461-473.
52) Crowther, M. S. & Baker, A. M. (2023). Patterns of Phenotypic Evolution and Diversification in Antechinus. S.1-18 in: Cáceres, N. C. & Dickman, C. R. (Hrsg.) (2023). American and Australasian Marsupials: An Evolutionary, Biogeographical, and Ecological Approach. Springer International Publishing, Cham.
53) Crowther, M. S., Dickman, C.
R. & Lynam, A. J. (1999). Sminthopsis griseoventer
boullangerensis (Marsupialia: Dasyuridae), a new subspecies in
the S. murina complex from Boullanger
Island, Western Australia. Australian
Journal of Zoology 47 (3):
215-243.
54) Crowther, M. S., Spencer, P.
B. S., Alpers, D. & Dickman, C. R. (2002). Taxonomic status of the mardo, Antechinus flavipes leucogaster
(Marsupialia: Dasyuridae): A morphological, reproductive and bioclimatic
approach. Australian Journal of Zoology
50 (6): 627-647.
55) De Tarragon, M. (1847).
Description du mâle adulte du Colobe
guereza et du Phascogale virginiae.
Revue Zoologique 10 (6): 177-178.
56) Dickman, C.,
Burnett, S. & McKenzie, N. (2016). Sminthopsis
murina. The IUCN Red
List of Threatened Species 2016:
e.T40547A21949138.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40547A21949138.en. Stand 13.
Februar 2023.
57) Dickman, C.,
Lunney, D. & Menkhorst, P. (2016). Antechinus agilis. The IUCN Red List of Threatened Species 2016: e.T1590A21946586. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T1590A21946586.en.
Stand 13. Februar 2023.
58) Dickman, C.,
Menkhorst, P. & Burnett, S. (2016). Antechinus swainsonii. The IUCN Red
List of Threatened Species 2016:
e.T41508A21946313. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T41508A21946313.en.
Stand 13. Februar 2023.
59) Dickman, C. R., Parnaby, H.
E., Crowther, M. S. & King, D. H. (1998). Antechinus
agilis (Marsupialia: Dasyuridae), a new species from the A. stuartii complex in south-eastern
Australia. Australian Journal of Zoology
46 (1): 1-26.
60) Dorph, A. & McDonald, P.
G. (2017). The acoustic repertoire and behavioural
context of the vocalisations of a nocturnal dasyurid, the eastern quoll (Dasyurus viverrinus). PLoS ONE 12 (7): e0179337: 1-16. Doi: 10.1371/journal.pone.0179337.
61) Edwards, M. C., Hoy, J. M.,
FitzGibbon, S. & Murray, P. J. (2019). Training a wild-born marsupial to use
microchip-automated devices: The brush-tailed phascogale (Phascogale tapoatafa) as proof of concept. Australian Mammalogy 41
(2): 279-282.
62) Ellis, M.,
Menkhorst, P., van Weenen, J. & Burbidge, A. (2016). Ningaui yvonneae. The IUCN Red List of Threatened Species 2016: e.T40531A21943904.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40531A21943904.en. Stand 13.
Februar 2023.
63) Ellis, M.,
van Weenen, J. & Burnett, S. (2016). Planigale tenuirostris. The IUCN Red List of Threatened Species 2016: e.T40536A21944763.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40536A21944763.en. Stand 13.
Februar 2023.
64) Ellis, M.,
van Weenen, J. & Pennay, M. (2016). Planigale gilesi. The IUCN Red
List of Threatened Species 2016:
e.T40533A21944830.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40533A21944830.en. Stand 13.
Februar 2023.
65)
Firestone, K. B. (1999). The application of
molecular genetics to the conservation management of quolls, Dasyurus species (Dasyuridae:
Marsupialia). PhD Thesis University of
New South Wales, Sydney.
66) Firestone,
K. B. (2000). Phylogenetic relationships
among quolls revisited: The mtDNA control region as a useful tool. Journal of Mammalian Evolution 7 (1): 1-22.
67)
Firestone, K. B., Elphinstone, M. S., Sherwin, W. B.
& Houlden, B. A. (1999). Phylogeographical population
structure of tiger quolls Dasyurus maculatus (Dasyuridae: Marsupialia), an
endangered carnivorous marsupial. Molecular
Ecology 8 (10): 1613-1625.
68)
Fischer von Waldheim, G. (1813). Zoognosia tabulis synopticis illustrate: In usum praelectionum
Academiae imperalis medico-chirugicae mosquensis edita. Volume 2. Nicolai S. Vsevolozsky, Moskau.
69)
Flannery, T. (1995). The Mammals of New Guinea. Reed Books, Sydney.
70) Geiser, F. & Cooper, C. E. (2023). Daily Torpor, Hibernation, and Heterothermy in Marsupials. S.1-28 in: Cáceres, N. C. & Dickman, C. R. (Hrsg.) (2023). American and Australasian Marsupials: An Evolutionary, Biogeographical, and Ecological Approach. Springer International Publishing, Cham.
71)
Geoffroy Saint-Hilaire, É. (1796).
Dissertatio sur les animaux à bourse (Didelphis
L.). Magazin Encyclopédique ou Journal
des Sciences, des Letters et des Arts 2
(3): 445-472.
72)
Geoffroy Saint-Hilaire, É. (1804). Mémoire sur les espèces du
genre dasyure. Annales du Muséum
d’Histoire Naturelle, Paris 3:
353-363.
73)
Gill, T. (1872). Arrangement of the families
of mammals with analytical tables. Smithsonian
Miscellaneous Collections 11
(1): 1-98.
74) Glen, A. S.,
de Tores, P. J., Sutherland, D. R. (2009).
Interactions between chuditch (Dasyurus
geoffroii) and introduced predators: A review. Australian Journal of Zoology 57
(5): 347-356.
75) Glen, A. S.
& Dickman, C. R. (2006). Home range, denning
behaviour and microhabitat use of the carnivorous marsupial Dasyurus maculatus in eastern Australia.
Journal of Zoology 268 (4): 347-354.
76) Glen, A. S.
& Dickman, C. R. (2006). Diet of the spotted-tailed quoll (Dasyurus maculatus) in eastern Australia: Effects of season, sex
and size. Journal of Zoology 269 (2): 241-248.
77)
Goldfuß, G. A. (1820). Handbuch der Naturgeschichte
zum Gebrauch bei Vorlesungen. Dritter Theil. Zweite Abteilung. Handbuch der
Zoologie. Johann Leonhard Schrag,
Nürnberg.
78) Goldingay,
R. L. (2000). Small dasyurid marsupials –
are they effective pollinators? Australian
Journal of Zoology 48 (5):
597-606.
79)
Gould, J. (1841). Observations on Dasyurus maugei and D. viverrinus of Geoffroy,
and description of a new species. Proceedings
of the Zoological Society of London 8
(1): 151.
80)
Gould, J. (1842). Characters of a new species
of Perameles, and a new species of Dasyurus. Proceedings of the Zoological Society of London 10 (1): 41-42.
81) Gould, J. (1844).
Exhibition and character of a number of animals, &c. transmitted from
Australia by Mr. Gilbert. Proceedings of the Zoological Society of
London 12 (1): 103-107.
82) Gould, J. (1845).
Phascogale calura. Tafel 34 (mit
Text) in: Gould, J. (1845-1863).
The Mammals of Australia Volume I. John
Gould, London.
83)
Gould, J. (1845). Podabrus crassicaudatus. Tafel 47 (mit Text) in: Gould, J. (1845-1863). The Mammals of
Australia Volume I. John Gould,
London.
84) Gould, J. (1851).
Antechinus maculatus. Tafel 44 (mit
Text) in: Gould, J. (1845-1863).
The Mammals of Australia Volume I. John
Gould, London.
85)
Gould, J. (1852). Antechinus fuliginosus.
Tafel 41 (mit Text) in: Gould, J. (1845-1863).
The Mammals of Australia Volume I. John
Gould, London.
86)
Gould, J. (1852). Antechinus minutissimus. Tafel 45 (mit Text) in: Gould, J. (1845-1863). The Mammals of
Australia Volume I. John Gould,
London.
87) Gould, J. (1854).
Antechinus ferruginifrons. Tafel 36
(mit Text) in: Gould, J. (1845-1863).
The Mammals of Australia Volume I. John
Gould, London.
88)
Gould, J. (1856). Phascogale
lanigera. Tafel 33 in Gould, J. (1845-1863).
The Mammals of Australia Volume I. John
Gould, London.
89) Gray, E. L., Baker, A. M.
& Firn, J. (2017). Autecology of a new species of carnivorous
marsupial, the endangered black-tailed dusky antechinus (Antechinus arktos), compared to a sympatric congener, the brown
antechinus (Antechinus stuartii). Mammal Research 62 (1): 47-63.
90) Gray, G. R. (1855). Catalogue
of the genera and subgenera of birds contained in the British Museum. Order of the Trustees of the British Museum
(Natural History), London.
91) Groves, C. P. (2005). Order Dasyuromorphia. S. 23-37 in: Wilson, D. E. & Reeder, D. M. (2005).
Mammal Species of the World: A Taxonomic and Geographic Reference – Third
Edition Volume 1. The Johns Hopkins
University Press, Baltimore.
92) Harris, G. P. (1808). Description of two new species of Didelphis from Van Damien’s Land. Transactions of the Linnean Society of
London 9 (1): 174-178.
93) Hawkins, C. E., McCallum, H.,
Mooney, N., Jones, M. & Holdsworth, M. (2008).
Sarcophilus harrissii. The IUCN Red List of Threatened Species 2008:
e.T40540A10331066. http://dx.doi.org/10.2305/IUCN.UK.2008.RLTS.T40540A10331066.en.
Stand 13. Februar 2023.
94) Hayman, D. L. (1990). Marsupial cytogenetics. Australian Journal of Zoology 37
(3): 331-349.
95) Helgen, K. M. (2007). A
Reassessment of Taxonomic Diversity and Geographic Patterning in the Melanesian
Mammal Fauna. PhD Thesis, University of
Adelaide, Adelaide.
96)
Helgen, K. M. (2007). A
taxonomic and geographic overview of the mammals of Papua. S. 689-749 in: Marshall, A. J. & Beehler, B. (Hrsg.)
(2007). Ecology of Indonesia Volume VI: The Ecology of Papua Part One. Periplus Editions, Singapur.
97) Helgen, K.,
Dickman, C., Lunde, D., Burnett, S., Woinarski, J. & Woolley, P. (2016). Sminthopsis virginiae. The IUCN Red
List of Threatened Species 2016:
e.T40549A21948773.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40549A21948773.en. Stand 13.
Februar 2023.
98)
Helgen, K. & Veatch, E. G. (2015). Recently Extinct Australian Marsupials and Monotremes. S. 17-31
in: Wilson, D. E. & Mittermeier, R.
A. (Hrsg.) (2015). Handbook of the Mammals of the World Volume 5 –
Monotremes and Marsupials. Lynx Edicions,
Barcelona.
99)
Hope, J. H. (1972). Mammals of the Bass Strait
Islands. Proceedings of the Royal Society
of Victoria 85 (1): 163-195.
100)
Hughes, R. L. (2000). Structure of the female reproductive tract of an adult parous
Tasmanian tiger, Thylacinus cynocephalus.
Australian Journal of Zoology 48 (5): 487-499.
101)
Hume, I. D., Smith, C. & Woolley, P. A. (2000). Anatomy and physiology of the gastrointestinal tract of the
Julia Creek dunnart, Sminthopsis douglasi
(Marsupialia: Dasyuridae). Australian
Journal of Zoology 48 (5):
475-485.
102)
Iredale, T. & Troughton, E. le G. (1934). A check-list of the mammals
recorded from Australia. The Australian
Museum Sydney Memoir 6: 1-122.
103)
Jackson, S. (2003). Australian Mammals – Biology and
Captive Management. CSIRO Publishing,
Collingwood.
104)
Jackson, S. & Groves, C. (2015). Taxonomy of Australian Mammals. CSIRO Publishing, Clayton South.
105)
Jentink, F. A. (1911). New and interesting mammals of Dutch
New-Guinea-Expedition to the Snow-Mountains. Notes from the Leyden Museum 33:
233-238.
106)
Johnson, D. H. (1954). A new marsupial of the genus
Antechinus from northern Australia. Proceedings of the Biological Society of
Washington 67: 77-79.
107)
Jones, M. E., Rose, R. K. & Burnett, S. (2001). Dasyurus
maculatus. Mammalian Species 33 (676): 1-9.
108)
Kealy, S. & Beck, R. (2017). Total evidence phylogeny and evolutionary timescale for
Australian faunivorous marsupials (Dasyuromorphia). BMC Evolutionary Biology 17:
240: 1-23. Doi: 10.1186/s12862-017-1090-0.
109)
Kerr, R. (1792). The Animal Kingdom, or
Zoological System, of the celebrated Sir Charles
Linnaeus. Class I. Mammalia: Containing a complete systematic
description, arrangement, and nomenclature, of all the known species and
varieties of the Mammalia, or animals which give suck to their young. Volume 1.
A. Strahan, T. Cadell & W. Creech,
Edinburgh.
110)
Kitchener, D. J. (1988). A new
species of false antechinus (Marsupialia: Dasyuridae) from the Kimberley,
Western Australia. Records of the Western
Australian Museum 14 (1): 61-71.
111)
Kitchener, D. J. (1991). Pseudantechinus mimulus (Thomas
1906) (Marsupialia: Dasyuridae): Rediscovery and redescription. Records of the Western Australian Museum
15 (1): 191-202.
112)
Kitchener, D. J. & Caputi, N. (1988).
A new species of false antechinus (Marsupialia: Dasyuridae) from Western
Australia, with remarks on the generic classification within the Parantechini. Records of the Western Australian Museum
14 (1): 35-59.
113)
Kitchener, D. J., Stoddart, J. & Henry, J. (1983). A taxonomic appraisal of the genus Ningaui Archer
(Marsupialia: Dasyuridae), including description of a new species. Australian Journal of Zoology 31 (3): 361-379.
114)
Kitchener, D. J., Stoddart, J. & Henry, J. (1984). A taxonomic revision of the Sminthopsis murina complex (Marsupialia,
Dasyuridae) in Australia, including description of four new species. Records of the Western Australian Museum
11 (3): 201-247.
115)
Knight, E. H. & Fox, B. J. (2000). Does habitat structure
mediate the effects of forest fragmentation and human-induced of forest
fragmentation and human-induced disturbance on the abundance of Antechinus stuartii? Australian Journal of Zoology 48 (5): 577-595.
116)
Krajewski, C., Anderson, F. E., Woolley, P. A. &
Westerman, M. (2012). Molecular evidence for a
deep clade of dunnarts (Marsupialia: Dasyuridae: Sminthopsis). Journal of
Mammalian Evolution 19 (4):
265-276.
117)
Krajewski, C., Torunsky, R. Sipiorski, J. T. &
Westerman, M. (2007). Phylogenetic relationships
of the dasyurid marsupial genus Murexia.
Journal of Mammalogy 88 (3): 696-705.
118)
Krajewski, C. & Westerman, M. (2003). Molecular systematics of
Dasyuromorphia. S. 3-20 in: Jones, M.,
Dickman, C. & Archer, M. (Hrsg.) (2003). Predators with Pouches –
The Biology of Carnivorous Marsupials. CSIRO
Publishing, Collingwood.
119)
Krajewski, C., Woolley, P. A. & Westerman, M. (2000). The evolution of reproductive
strategies in dasyurid marsupials: implications of molecular phylogeny. Biological Journal of the Linnean Society
71 (3): 417-435.
120) Krajewski, C., Wroe, S. & Westerman, M. (2000). Molecular evidence for the pattern and timing of cladogenesis in dasyurid marsupials. Zoological Journal of the Linnean Society 130 (3): 375-404.
121) Krajewski, C., Young, J., Buckley, L, Woolley, P. A. & Westerman, M. (1997). Reconstructing the evolutionary radiation of dasyurine marsupials with cytochrome b, 12S rRNA, and protamine P1 gene trees. Journal of Mammalian Evolution 4 (3): 217-236.
122) Krefft, G. (1867). On the classification of the small Dasyuridae of Australia, with descriptions of two new genera and one new species. Proceedings of the Zoological Society of London 34 (1): 431-435.
123) Lavery, T. H., Collett, R., Fisher, D. O., Hoskin, C. J. & Rowland, J. (2023). White-footed dunnarts (Sminthopsis leucopus) in Queensland’s wet tropcis, with the description of a new subspecies. Australian Mammalogy 45 (1): 77-90.
124)
Lavery, T. H. & Flannery, T. F. (2023).
Mammals of South-West Pacific. CSIRO
Publishing, Clayton South.
125)
Leary, T., Seri, L., Flannery, T., Wright, D.,
Hamilton, S., Helgen, K., Singadan, R., Menzies, J., Allison, A., James, R.,
Dickman, C., Lunde, D., Bonaccorso, F. & Woolley, P. (2016). Planigale novaeguineae. The IUCN Red
List of Threatened Species 2016:
e.T17474A21944952.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T17474A21944952.en. Stand 13.
Februar 2023.
126)
Leary, T., Seri, L., Flannery, T., Wright, D.,
Hamilton, S., Helgen, K., Singadan, R., Menzies, J., Allison, A., James, R.
& Woolley, P. (2016). Dasyurus spartacus. The IUCN Red
List of Threatened Species 2016:
e.T6301A21947093.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T6301A21947093.en. Stand 19.
Februar 2023.
127)
Leary, T., Seri, L., Wright, D., Hamilton, S., Helgen,
K., Singadan, R., Menzies, J., Allison, A., James, R., Dickman, C., Lunde, D.,
Aplin, K., Flannery, T. & Woolley, P. (2016). Myoictis melas. The IUCN Red List of Threatened Species 2016: e.T14086A21945102. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T14086A21945102.en.
Stand 25. Februar 2023.
128)
Leary, T., Seri, L., Wright, D., Hamilton, S., Helgen,
K., Singadan, R., Menzies, J., Allison, A., James, R., Dickman, C., Lunde, D.,
Aplin, K., Flannery, T. & Woolley, P. (2016). Myoictis wallacei. The IUCN Red List of Threatened Species 2016: e.T136839A21945028.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T136839A21945028.en. Stand 25.
Februar 2023.
129)
Leary, T., Seri, L., Wright, D., Hamilton, S., Helgen,
K., Singadan, R., Menzies, J., Allison, A., James, R., Dickman, C., Lunde, D.,
Aplin, K. & Woolley, P. (2016). Murexia habbema. The IUCN Red List of Threatened Species 2016: e.T1589A21943099.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T1589A21943099.en. Stand 23.
Februar 2023.
130)
Leary, T., Seri, L., Wright, D., Hamilton, S., Helgen,
K., Singadan, R., Menzies, J., Allison, A., James, R., Dickman, C., Lunde, D.,
Aplin, K. & Woolley, P. (2016). Murexia melanurus. The IUCN Red List of Threatened Species 2016: e.T1591A21943184.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T1591A21943184.en. Stand 19.
Februar 2023.
131)
Leary, T., Seri, L., Wright, D., Hamilton, S., Helgen,
K., Singadan, R., Menzies, J., Allison, A., James, R., Dickman, C., Lunde, D.,
Aplin, K. & Woolley, P. (2016). Murexia naso. The IUCN Red List of Threatened Species 2016: e.T1587A21942936.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T1587A21942936.en. Stand 19.
Februar 2023.
132)
Leary, T., Seri, L., Wright, D., Hamilton, S., Helgen,
K., Singadan, R., Menzies, J., Allison, A., James, R., Dickman, C., Lunde, D.,
Aplin, K. & Woolley, P. (2016). Murexia rothschildi. The IUCN Red List of Threatened Species 2016: e.T13931A21943008.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T13931A21943008.en. Stand 19. Februar
2023.
133)
Lloyd, P., Sanders, M., Reis, T. & Abbott, A. (2013). Targeted trapping surveys shed new light on the
distribution and habitat characteristics of the Carpentarian Pseudantechinus (Pseudantechinus mimulus), a threatened
dasyurid marsupial. Australian Mammalogy
35 (2): 220-223.
134)
Luckett, W. P. & Woolley, P. A. (1996). Ontogeny and
homology of the dentition in dasyurid marsupials: Development in Sminthopsis virginiae. Journal of Mammalian Evolution 3 (4): 327-364.
135)
Marshall, L. G. & Hope, J. H. (1973). A
revaluation of Dasyurus bowlingi Spencer and Kershaw 1910 (Marsupialia, Dasyuridae) from King Island,
Bass Straight. Proceedings of the Royal
Society of Victoria 85 (2):
225-235.
136)
Mason, E. D., Firn, J., Hines, H. B. & Baker, A. M. (2017). Breeding biology and growth in a new,
threatened carnivorous marsupial. Mammal
Research 62 (2): 179-187.
137)
McKenzie, N. (2016). Sminthopsis gilberti. The IUCN Red List of Threatened Species 2016: e.T40543A21948233. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40543A21948233.en.
Stand 13. Februar 2023.
138)
McKenzie, N. (2016). Sminthopsis granulipes. The IUCN Red List of Threatened Species 2016: e.T41509A21948474.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T41509A21948474.en. Stand 13.
Februar 2023.
139)
McKenzie, N. & Dickman, C. (2016). Sminthopsis hirtipes. The IUCN Red List of Threatened Species 2016: e.T40544A21948399.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40544A21948399.en. Stand 13.
Februar 2023.
140)
McKenzie, N. & Dickman, C. (2016). Sminthopsis youngsoni.
The IUCN Red
List of Threatened Species 2016:
e.T40550A21948853.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40550A21948853.en. Stand 13.
Februar 2023.
141)
McKenzie, N. & Kemper, C. (2016). Sminthopsis griseoventer.
The IUCN Red
List of Threatened Species 2016:
e.T41510A21948615.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T41510A21948615.en. Stand 13.
Februar 2023.
142)
McKenzie, N., van Weenen, J. & Kemper, C. (2016). Sminthopsis
dolichura. The IUCN Red
List of Threatened Species 2016:
e.T40542A21948697.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40542A21948697.en. Stand 13.
Februar 2023.
143)
McKenzie, N., Woinarski, J. & Burbidge, A. (2016). Sminthopsis
longicaudata. The IUCN Red
List of Threatened Species 2016:
e.T40545A21948982.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40545A21948982.en. Stand 13.
Februar 2023.
144)
McKnight,
M. (2019). Sminthopsis butleri. The IUCN Red List of Threatened Species 2019: e.T20295A21948035. http://dx.doi.org/10.2305/IUCN.UK.2019-2.RLTS.T20295A21948035.en.
Stand 13. Februar 2023.
145)
McKnight,
M., Canty, P., Brandle, R., Robinson, A. & Watson, M. (2019). Dasyuroides byrnei. The IUCN Red List of Threatened Species 2019: e.T6265A21944128. http://dx.doi.org/10.2305/IUCN.UK.2019-1.RLTS.T6265A21944128.en.
Stand 13. Februar 2023.
146)
Menkhorst, P., Friend, T., Burnett, S. & McKenzie,
N. (2016). Antechinus
flavipes. The IUCN Red
List of Threatened Species 2016:
e.T40524A21946235. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40524A21946235.en.
Stand 23. Februar 2023.
147) Mickoleit, Gerhard (2004). Phylogenetische Systematik der Wirbeltiere. Verlag Dr. Friedrich Pfeil, München.
148)
Mills, H. R. & Bencini, R. (2000). New
evidence for facultative male die-off in island populations of dibblers, Parantechinus apicalis. Australian Journal of Zoology 48 (5): 501-510.
149)
Mitchell, K. J., Pratt, R. C., Watson, L. N., Gibb, G. C., Llamas, B.,
Kasper, M., Edson, J., Hopwood, B., Male, D., Armstrong, K. N., Meyer, M.,
Hofreiter, M., Austin, J., Donnellan, S. C., Lee, M. S. Y., Phillips, M. J.
& Cooper, A. (2014).
Molecular phylogeny, biogeography, and habitat preference evolution of
marsupials. Molecular Biology and
Evolution 31 (9): 2322-2330.
150)
Mutton, T. Y., Gray, E. L., Fuller, S. J. & Baker, A. M. (2017). Life history, breeding biology and movement in a
new species of carnivorous marsupial, the buff-footed antechinus (Antechinus mysticus) and a sympatric
congener, the subtropical antechinus (Antechinus
subtropicus). Mammal Research 62 (4): 373-385.
151)
Mutton, T. Y., Phillips, M. J., Fuller, S. J., Bryant, L. M. & Baker,
A. M. (2019). Systematics, biogeography and ancestral state of
the Australian marsupial genus Antechinus
(Dasyuromorphia: Dasyuridae). Zoological
Journal of the Linnean Society 186
(2): 553-568.
152)
Oakwood, M. (2000). Reproduction and demography of the
northern quoll, Dasyurus hallucatus,
in the lowland savanna of northern Australia. Australian Journal of Zoology 48
(5): 519-539.
153)
Oakwood,
M., Woinarski, J. & Burnett, S. (2016). Dasyurus hallucatus. The IUCN Red List of
Threatened Species 2016:
e.T6295A21947321.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T6295A21947321.en. Stand 19.
Februar 2023.
154) Painter, J., Krajewski, C. & Westerman, M. (1995). Molecular phylogeny of the marsupial genus Planigale (Dasyuridae). Journal of Mammalogy 76 (2): 406-413.
155) Peters, W. (1875). Abbildungen von zwei neuen Beutelthieren aus Neu-Guinea, welche dem Museo Civico von Genoa gehören. Sitzungs-Berichte der Gesellschaft Naturforschender Freunde zu Berlin 1875: 73.
156) Peters, W. & Doria, G. (1876). Diagnosi di tre nuove specie di mammifere della Nuova Guinea e di Salawatti. Annali del Museo Civico di Storia Naturale di Genova 8: 335-336.
157) Potter, S., Eldridge, M. D. B. & Ho, S. Y. W. (2023). Molecular Evolution in Australasian Marupials. S. 1-31 in: Cáceres, N. C. & Dickman, C. R. (Hrsg.) (2023). American and Australasian Marsupials: An Evolutionary, Biogeographical, and Ecological Approach. Springer International Publishing, Cham.
158) Ramsay, E. P. (1887). Description oft wo new species of marsupials (Permeles and Antechinus), and of a new species of Mus (M. burtoni), from the neighbourhood of Derby, N.W.A. The Proceedings oft he Linnean Society of New South Wales, 2nd Series 2 (3): 551-553.
159) Ramsay, E. P. (1888). Notes on the fauna of the Bellenden-Ker Ranges. Proceedings of the Linnean Society of New South Wales, 2nd Series 3 (3): 1295-1299.
160) Rhind, S. G., Bradley, J. S. & Cooper, N. K. (2001). Morphometric variation and taxonomic status of brush-tailed phascogales, Phascogale tapoatafa (Meyer, 1793) (Marsupialia: Dasyuridae). Australian Journal of Zoology 49 (4): 345-368.
161) Righetti, J., Fox, B. J. & Croft, D. B. (2000). Behavioural mechanisms of competition in small dasyurid marsupials. Australian Journal of Zoology 48 (5): 561-576.
164) Schlegel, H. (1880). On Dasyurus albopunctatus. Notes from the Leyden Museum 2: 51-53.
166) Shaw, G. (1800). General Zoology or Systematic Natural History Volume 1, Part 2: Mammalia. G. Kearsley, London.
167) Shimmin, G. A., Taggart, D. A. & Temple-Smith, P. D. (2000). Variation in reproductive surpluses of the agile antechinus (Antechinus agilis) at different teat-number locations. Australian Journal of Zoology 48 (5): 511-517.
168) Soderquist, T. R. & Serena, M. (2000). Juvenile behaviour and dispersal of chuditch (Dasyurus geoffroii) (Marsupialia: Dasyuridae). Australian Journal of Zoology 48 (5): 551-560.
169) Spencer, P. B. S., Rhind, S. G. & Eldridge, M. D. B. (2001). Phylogeographic structure within Phascogale (Marsupialia: Dasyuridae) based on partial cytochrome b sequence. Australian Journal of Zoology 49 (4): 369-377.
170) Spencer, W. B. (1895). Preliminary notice of two new species of marsupials from Central Australia. Proceedings of the Royal Society of Victoria 7: 222-224.
171) Spencer, W. B. (1896). Mammalia. S. 1-52 in: Spencer, W. B. (Hrsg.) (1896). Report on the work of the Horn scientific expedition to central Australia Part II: Zoology Melville, Mullen & Slade, Melbourne.
173) Spencer, W. B. (1909). Description of a new species of Sminthopsis. Proceedings of the Royal Society of Victoria 21 (2): 449-451.
174) Spencer, W. B. & Kershaw, J. A. (1910). A collection of sub-fossil bird and marsupial remains from King Island, Bass Strait. Memoirs of the National Museum of Melbourne 3: 5-35.
175) Strahan, R. (Hrsg.) (1983). The Australian Museum Complete Book of Australian Mammals. Angus und Robertson Publishers, Sydney.
176) Strahan, R. & Conder, P. (2007). Dictionary of Australian and New Guinean Mammals. CSIRO Publishing, Collingwood.
177) Taplin, L. E. (1980). Some observations on the reproductive biology of Sminthopsis virginiae (Tarragon), (Marsupialia: Dasyuridae). The Australian Zoologist 20 (3): 407-418
178) Tate, G. H. H. (1947). Results of the Archbold expeditions. No. 56. On the anatomy and classification of the Dasyuridae (Marsupialia). Bulletin of the American Museum of Natural History 88: 97-155.
179) Tate, G. H. H. & Archbold, R. (1936). Results of the Archbold Expeditions. No. 8. Four apparently new polyprotodont marsupials from New Guinea. American Museum Novitates 823: 1-4.
180) Tate, G. H. H. & Archbold, R. (1937). Results of the Archbold Expeditions. No. 16. Some marsupials of New Guinea and Celebes. Bulletin of the American Museum of Natural History 73 (4): 331-476.
181) Tate, G. H. H. & Archbold, R. (1941). Results of the Archbold Expeditions. No. 31. New rodents and marsupials from New Guinea. American Museum Novitates 1101: 1-9.
182) Thomas, O. (1886). Diagnosis of a new species of Phascogale. Annali del Museo Civico di Storia Naturale di Genova 24: 208.
183) Thomas, O. (1887). On the specimens of Phascogale in the Museo Civico, Genoa, with notes on the allied species of the genus. Annali del Museo Civico di Storia Naturale di Genova 24: 502-511.
184) Thomas, O. (1888). Catalogue of the Marsupialia and Monotremata in the Collection of the British Museum (Natural History). Order of the Trustees of the British Museum (Natural History), London.
186) Thomas, O. (1906). New mammals from the Australian region. Annals and Magazin of Natural History, 7th Series 17 (99): 324-332.
187) Thomas, O. (1906). On mammals collected in South-west Australia for Mr. W. E. Balson. Proceedings of the Zoological Society of London 76 (3-4): 468-478.
188) Thomas, O. (1906). On mammals from northern Australia presented to the National Musum by Sir Wm. Ingram, Bt., and the Hon. John Forrest. Proceedings of the Zoological Society of London 76 (3-4): 536-543.
191) Thomas, O. (1926). On various mammals obtained during Capt. Wilkins’s expedition in Australia. Annals and Magazine of Natural History, 9th Series 17 (102): 625-635.
192) Tian, R., Han, K., Geng, Y., Yang, C., Shi, C., Thomas, P. B., Pearce, C., Moffatt, K., Ma, S., Xu, S., Yang, G., Zhou, X., Gladyshev, V. N., Liu, X., Fisher, D. O., Chopin, L. K., Leiner, N. O., Baker, A. M., Fan, G. & Seim, I. (2022). A chromosome-level genome of Antechinus flavipes provides a reference for an Australian marsupial genus with male death after mating. Molecular Ecology Resources 22 (2): 740-754.
193) Troughton, E. le G. (1928). A new genus, species, and subspecies of marsupial mice (family Dasyuridae). Records of the Australian Museum 16 (6): 281-288.
195) Van Dyck, S. (1986). The chestnut dunnart, Sminthopsis archeri (Marsupialia: Dasyuridae), a new species from the savannahs of Papua New Guinea and Cape York Peninsula, Australia. Australian Mammalogy 9 (2): 111-124.
196) Van Dyck, S. (1988). The bronze quoll, Dasyurus spartacus (Marsupialia: Dasyuridae), a new species from the savannahs of Papua New Guinea. Australian Mammalogy 11 (2): 145-156.
198) Van Dyck, S., Gynther, I. & Baker, A. (Hrsg.) (2013). Field Companion to the Mammals of Australia. New Holland Publishers, Sydney.
199) Van Dyck, S., Woinarski, J. C. Z. & Press, A. J. (1994). The Kakadu dunnart, Sminthopsis bindi (Marsupialia: Dasyuridae), a new species from the stony woodlands of the Northern Territory. Memoirs of the Queensland Museum 37 (1): 311-323.
200) Van Weenen, J. (2008). Sminthopsis aitkeni. The IUCN Red List of Threatened Species 2008: e.T20294A9183297. http://dx.doi.org/10.2305/IUCN.UK.2008.RLTS.T20294A9183297.en. Stand 13. Februar 2023.
201) Van Weenen, J. & Menkhorst, P. (2016). Antechinus minimus. The IUCN Red List of Threatened Species 2016: e.T40525A21946728. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40525A21946728.en. Stand 23. Februar 2023.
203) Vogelnest, L. & Allan, G. (Hrsg.) (2015). Radiology of Australian Mammals. CSIRO Publishing, Clayton South.
205) Watchorn, D. J., Ashman, K. R. & Harley, D. K. P. (2019). Observations of arboreal behaviour in the mainland dusky antechinus (Antechinus mimetes). Australian Mammalogy 42 (2): 226-229.
206) Waterhouse, G. R. (1836). Description of a new genus (Myrmecobius) of mammiferous animals from New Holland, probably belonging to the marsupial type. Proceedings of the Zoological Society of London 4 (1): 69-70.
207) Waterhouse, G. R. (1838). Description of a new genus of mammiferous animals from Australia, belonging probably to the order Marsupialia. Transactions of the Zoological Society of London 2 (2): 149-154.
209) Westheide, W. & Rieger, R. (Hrsg.) (2010). Spezielle Zoologie Teil 2: Wirbel- oder Schädeltiere – 2. Auflage. Spektrum Akademischer Verlag, Heidelberg.
210)
Westerman, M., Krajewski, C., Kear, B. P., Meehan, L.,
Meredith, R. W., Emerling, C. A. & Springer, M. S. (2016). Phylogenetic relationships of
dasyuromorphian marsupials revisited. Zoological
Journal of the Linnean Society 176
(3): 686-701.
211)
Westerman, M., Loke, S. & Tan, M. H. (2022). Molecular relationships of
the red-bellied dasyure (Phascolosorex
doriae) – a rare marsupial from western New Guinea. Australian Mammalogy 44
(1): 182-184.
212)
Westerman, M., Umbrello, L. & Woolley, P. A. (2023). On the composition of Antechinomys (Marsupialia: Dasyuridae):
How many species? Australian Journal of
Zoology 70 (3): 95-103.
213)
Westerman, M., Young, J. & Krajewski, C. (2007). Molecular relationships of species of Pseudantechinus, Parantechinus and Dasykaluta
(Marsupialia: Dasyuridae). Australian
Mammalogy 29 (2): 201-212.
214)
Westwood, J. O. (1840). An Introduction to the Modern Classification of
Insects; Founded on the Natural Habits and Corresponding Organization Volume
II. Longman, Orme, Brown, Green, and
Longmans, London.
215)
Wolfe, K. M., Robertson, H. & Bencini, R. (2000). The mating behaviour of the dibbler, Parantechinus apicalis, in captivity. Australian Journal of Zoology 48 (5): 541-550.
216)
Woinarski, J. & Burbidge, A. A. (2016). Antechinus
bellus. The IUCN Red
List of Threatened Species 2016:
e.T40523A21946388.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40523A21946388.en. Stand 13.
Februar 2023.
217)
Woinarski, J. & Burbidge, A. A. (2016). Dasycercus
cristicauda. The IUCN Red
List of Threatened Species 2016:
e.T6266A21945813.
http://dx.doi.org/10.2305/IUCN.UK.2016-1.RLTS.T6266A21945813.en. Stand 13.
Februar 2023.
218)
Woinarski, J. & Burbidge, A. A. (2016). Myrmecobius
fasciatus. The IUCN Red
List of Threatened Species 2016:
e.T14222A21949380. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T14222A21949380.en.
Stand 13. Februar 2023.
219)
Woinarski, J. & Burbidge, A. A. (2016). Pseudantechinus
bilarni. The IUCN Red
List of Threatened Species 2016:
e.T40636A21945319. http://dx.doi.org/10.2305/IUCN.UK.2016-3.RLTS.T40636A21945319.en.
Stand 13. Februar 2023.
220)
Woinarski, J. & Burbidge, A. A. (2016). Pseudantechinus
mimulus. The IUCN Red
List of Threatened Species 2016:
e.T18447A21945496.
http://dx.doi.org/10.2305/IUCN.UK.2016-3.RLTS.T18447A21945496.en. Stand 13.
Februar 2023.
221)
Woinarski, J. & Burbidge, A. A. (2016). Sminthopsis
bindi. The IUCN Red
List of Threatened Species 2016:
e.T40551A21948917.
http://dx.doi.org/10.2305/IUCN.UK.2016-1.RLTS.T40551A21948917.en. Stand 13.
Februar 2023.
222)
Woinarski, J. & Burbidge, A. A. (2016). Sminthopsis
psammophila. The IUCN Red
List of Threatened Species 2016:
e.T20293A21947794.
http://dx.doi.org/10.2305/IUCN.UK.2016-1.RLTS.T20293A21947794.en. Stand 13.
Februar 2023.
223)
Woinarski,
J. & Burbidge, A. A. (2019). Dasyurus
geoffroii. The IUCN Red List of
Threatened Species 2019:
e.T6294A21947461.
http://dx.doi.org/10.2305/IUCN.UK.2019-1.RLTS.T6294A21947461.en. Stand 19.
Februar 2023.
224)
Woinarski, J. C. Z., Burbidge, A. A. & Harrison, P. L. (2014). The action plan for Australian Mammals 2012. CSIRO Publishing, Collingwood.
225)
Woinarski, J. & Burbidge, A., van Weenen, J. &
Dickman, C. (2016). Pseudantechinus macdonnellensis. The IUCN Red List of Threatened Species 2016: e.T40537A21945598.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40537A21945598.en. Stand 13.
Februar 2023.
226)
Woinarski, J. & Dickman, C. (2016). Sminthopsis macroura. The IUCN Red List of Threatened Species 2016: e.T40546A21949068.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40546A21949068.en. Stand 13.
Februar 2023.
227)
Woinarski, J., Rhind, S. & Oakwood, M. (2019). Phascogale pirata. The IUCN Red List of
Threatened Species 2019:
e.T16889A21944455.
http://dx.doi.org/10.2305/IUCN.UK.2019-2.RLTS.T16889A21944455.en. Stand 23.
Februar 2023.
228)
Woinarski, J., van Weenen, J. & Burbidge, A. (2016). Ningaui
ridei. The IUCN Red
List of Threatened Species 2016:
e.T40529A21943973.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40529A21943973.en. Stand 13.
Februar 2023.
229)
Woinarski, J., van Weenen, J. & Burbidge, A. (2016). Planigale
ingrami. The IUCN Red
List of Threatened Species 2016:
e.T40534A21944891.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T40534A21944891.en. Stand 13.
Februar 2023.
230)
Wood Jones, F. (1923). The
Mammals of South Australia. Part 1. Government
Printer, Adelaide.
231)
Woolley, P. (2016). Dasycercus blythi. The IUCN Red List of Threatened Species 2016: e.T6267A21945900.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T6267A21945900.en. Stand 20.
Februar 2023.
232)
Woolley, P. (2016). Myoictis leucura. The IUCN Red
List of Threatened Species 2016:
e.T136449A21945246.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T136449A21945246.en. Stand 20.
Februar 2023.
233)
Woolley, P. (2016). Myoictis wavicus. The IUCN Red
List of Threatened Species 2016:
e.T136829A21945185. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T136829A21945185.en.
Stand 20. Februar 2023.
234)
Woolley, P., Helgen, K., Dickman, C., Lunde, D.,
Winter, J. & Burnett, S. (2016). Sminthopsis archeri. The IUCN Red
List of Threatened Species 2016:
e.T20296A21948127. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T20296A21948127.en.
Stand 13. Februar 2023.
235)
Woolley, P. A., Krajewski, C. & Westerman, M. (2015). Phylogenetic relationships within Dasyurus (Dasyuromorphia: Dasyuridae): Quoll systematics based on
molecular evidence and male characteristics. Journal of Mammalogy 96
(1): 37-46.
236)
Woolley, P. A., Krajewski, C. & Westerman, M. (2020). The endemic New Guinean genus Murexia (Dasyuromorphia: Dasyuridae). How many species? An analysis
based on morphological, distributional and molecular data. Australian Journal of Zoology 67
(3): 134-144.
237)
Woolley,
P., Leary, T., Seri, L., Flannery, T., Wright, D., Hamilton, S., Helgen, K.,
Singadan, R., Menzies, J., Allison, A. & James, R. (2016). Dasyurus albopunctatus. The IUCN Red List of Threatened Species 2016: e.T6299A21946965.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T6299A21946965.en. Stand 19.
Februar 2023.
238)
Woolley,
P., Leary, T., Seri, L., Flannery, T., Wright, D., Hamilton, S., Helgen, K.,
Singadan, R., Menzies, J., Allison, A., James, R., Aplin, K., Dickman, C.,
Lunde, D. & Bonaccorso, F. (2016). Phascolosorex dorsalis. The IUCN
Red List of Threatened Species 2016:
e.T16894A21943541.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T16894A21943541.en. Stand 23.
Februar 2023.
239)
Woolley,
P., Leary, T., Seri, L., Wright, D., Hamilton, S., Helgen, K., Singadan, R.,
Dickman, C. & Lunde, D. (2016). Phascolosorex
doriae. The IUCN
Red List of Threatened Species 2016:
e.T16893A21943616. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T16893A21943616.en.
Stand 23. Februar 2023.
240)
Woolley,
P., Leary, T., Seri, L., Wright, D., Hamilton, S., Helgen, K., Singadan, R.,
Menzies, J., Allison, A., James, R., Dickman, C., Lunde, D. & Aplin, K. (2016).
Murexia longicaudata. The IUCN Red List of Threatened Species 2016: e.T13930A21943259.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T16893A21943616.en. Stand 23.
Februar 2023.
241)
Woolley,
P., Leary, T., Wright, D., Hamilton, S., Helgen, K., Singadan, R., Dickman, C.
& Lunde, D. (2016). Neophascogale
lorentzii. The IUCN
Red List of Threatened Species 2016:
e.T14541A21943824.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T14541A21943824.en. Stand 19.
Februar 2023.
242)
Woolley, P. A., Raftopoulos, S. A., Coleman, G. J. & Armstrong, S. M. (1991). A
comparative study of the circadian activity patterns of two New Guinean
dasyurid marsupials, Phascolosorex
dorsalis and Antechinus habbema. Australian Journal of Zoology 39 (6): 661-671.