System der
Lebewesen (Stefan Hintsche
2022)
Stammbaum
Eutheria > Boreoeutheria > Laurasiatheria > Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
|
|
|
|
|
|
|
|
Vespertilionidae |
|
|
|||
|
|
|
|
|
||
|
|
|
|
|||
|
|
|
|
|
||
|
|
|
|
|||
|
|
|
|
|
||
|
|
|
|
|
|
Familia
Vespertilionidae Gray, 1821 (Familie Glattnasen/Vesper
Bats):
-
522 Arten; nominotypische Gattung Vespertilio Linnaeus, 1758; nominotypische Art Vespertilio murinus Linnaeus,
1758.
-
Taxonomie :
In der Vergangenheit wurde auch die Gattung Miniopterus häufig in die Vespertilionidae eingeordnet (Corbet,
1978; Simmons, 2005).
Heute werden sie aber in der Regel in eine eigene Familie gestellt.
-
Literatur: Corbet (1978); Gray (1821);
Linnaeus (1758); Simmons (2005).
Subfamilia Vespertilioninae Gray, 1821 (Unterfamilie
Echte Glattnasen):
-
307 Arten; nominotypische Gattung Vespertilio Linnaeus, 1758; nominotypische Art Vespertilio murinus Linnaeus,
1758.
-
Literatur: Gray (1821);
Linnaeus (1758).
Subfamilia Myotinae
Tate, 1942 (Unterfamilie
Mausohrfledermäuse):
-
134 Arten.
-
Taxonomie: Von Tate
ursprünglich als Tribus Myotini innerhalb der Vespertilioninae eingeführt, erhob Simmons
(1998) den Zweig der Mausohren aufgrund der Ergebnisse karyologischer Analysen von Volleth & Heller
(1994) später in den Rang einer Unterfamilie.
-
Literatur: Simmons
(1998); Tate (1942);
Volleth & Heller (1994).
Subfamilia Kerivoulinae G. S. Miller, 1907 (Unterfamilie
Wollfledermäuse/Woolly Bats):
-
35 Arten; nominotypische Gattung Kerivoula Gray, 1842; nominotypische Art Kerivoula picta (Pallas, 1767).
-
Literatur: Gray (1842);
Miller (1907); Pallas (1767).
Subfamilia Murininae G. S. Miller, 1907 (Unterfamilie
Röhrennasenfledermäuse):
-
46 Arten.
-
Literatur: Miller (1907).
Laurasiatheria > Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
Subfamilia Vespertilioninae Gray, 1821 (Unterfamilie Echte Glattnasen):
-
307 Arten; nominotypische Gattung Vespertilio Linnaeus, 1758; nominotypische Art Vespertilio murinus Linnaeus,
1758.
-
Literatur: Gray (1821);
Linnaeus (1758).
Tribus Plecotini
Gray, 1866 (Gattungsgruppe
Langohrfledermäuse):
-
32 Arten.
Tribus Lasiurini
Tate, 1942 (Gattungsgruppe
Haarschwanzfledermäuse):
-
23 Arten.
Tribus Antrozoini
Miller, 1897 (Gattungsgruppe
Gelbfledermäuse):
-
15 Arten.
Tribus Scotophilini Hill &
Harrison, 1987 (Gattungsgruppe Hausfledermäuse):
-
21 Arten.
Tribus Perimyotini
(Gattungsgruppe Amerikanische Zwergfledermäuse):
-
2 Arten.
Tribus Eptesicini
Volleth & Heller, 1994 (Gattungsgruppe
Breitflügelfledermäuse):
-
72 Arten.
Tribus Hypsugini
(Gattungsgruppe Tropische Glattnasen):
-
84 Arten.
Tribus Vespertilionini
Gray, 1821 (Gattungsgruppe
Altwelt-Glattnasen):
-
58 Arten; nominotypische Gattung Vespertilio Linnaeus, 1758; nominotypische Art Vespertilio murinus Linnaeus,
1758.
-
Literatur: Gray (1821);
Linnaeus (1758).
Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Plecotini
|
|
|
|
|
|
|
|
|
Plecotini |
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
||||
|
|
|
|
|
|
||
|
|
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Tribus Plecotini
Gray, 1866 (Gattungsgruppe
Langohrfledermäuse):
-
32 Arten.
Genus
Barbastella
Gray, 1821 (Gattung
Mopsfledermäuse):
-
6 Arten.
Genus Corynorhinus Allen,
1865 (Gattung Neuwelt-Langohren):
-
3 Arten.
Genus Idionycteris Anthony,
1923 (Gattung Allen-Langohren):
-
1
Art.
Genus Otonycteris Peters,
1859 (Gattung Wüstengroßohren):
-
2 Arten.
Genus Plecotus É. Geoffroy, 1818 (Gattung
Altwelt-Langohren):
-
20 Arten.
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Plecotini > Barbastella
|
|
|
|
|
|
|
||
|
Barbastella |
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Genus
Barbastella
Gray, 1821 (Gattung
Mopsfledermäuse):
-
6 Arten; Stammbaum orientiert sich an den Ergebnissen von Kruskop, Kawai & Tiunov (2019).
-
Literatur: Kruskop, Kawai & Tiunov (2019).
Barbastella
pacifica Kruskop, Kawai & Tiunov, 2019 (Japanische Mopsfledermaus/Japanese
Barbastelle):
- Holotypus/Terra typica: BSI 168-07, adultes Männchen (Kadaver in Alkohol und Schädel), gesammelt von T. A. Selezneva und M. P. Tiunov im Juli 2006 nahe der Mündung des Flusses Filatova, Insel Kunashir, Russland.
- Taxonomie/Etymologie: Der wissenschaftliche Name pacifica bezieht sich darauf, dass die Art auf den Inseln im norwestlichen Pazifik verbreitet ist. Möglicherweise besteht eine engere Verwandtschaft zu B. darjelingensis.
- Bestand: Nicht bewertet.
- Verbreitung: Asien (Japan; Russland: Kurilen).
- Literatur: Kruskop, Kawai & Tiunov (2019); Moratelli et al. (2019, 2020).
Barbastella darjelingensis
Hodgson in Horsfield,
1855 (Östliche
Mopsfledermaus/Eastern
Barbastelle):
- Terra typica: Nahe Darjeeling, Westbengalen, Indien.
- Taxonomie/Etymologie: Der wissenschaftliche Name leitet sich vom Fundort Darjeeling ab. Die Art wurde ursprünglich als Plecotus darjelingensis beschrieben. Über einen langen Zeitraum wurde sie dann aber Barbastella leucomelas zugeordnet. Inzwischen konnte die Stellung als eigenständige Art durch genetische und morphologische Daten gut gestützt werden. Bei den aktuell zu darjelingensis gerechneten Tieren in China und Südostasien handelt es sich vermutlich um eine weitere, noch nicht beschriebene Art (Kruskop, Kawai & Tiunov, 2019).
- Bestand: Nicht bewertet.
- Verbreitung: Asien (Afghanistan; Pakistan; Indien; Nepal; China; Bhutan; Laos; Vietnam; Taiwan).
- Literatur: Kruskop, Kawai & Tiunov (2019); Moratelli et al. (2019, 2020).
Barbastella barbastellus (Schreber, 1774) (Westliche Mopsfledermaus/Western Barbastelle):
- Terra typica: Burgund, Frankreich.
- Taxonomie: Ursprünglich als Vespertilio barbastellus beschrieben.
- Unterarten: Europäische Mopsfledermaus (B. barbastellus barbastellus (Schreber, 1774)), Kanaren-Mopsfledermaus (B. barbastellus guanchae Trujillo, Ibáñez & Juste, 2002).
- Bestand: Potenziell gefährdet (Vorwarnliste); Population abnehmend.
-
Literatur: Carr et
al. (2020); Moratelli et al. (2019,
2020); Piraccini
(2016); Toffoli
& Cucco
(2020); Schreber
(1774).
Barbastella beijingensis Zhang, Han, Jones, Lin, Zhang, Zhu, Huang
& Zhang, 2007 (Peking-Mopsfledermaus/Beijing Barbastelle):
- Bestand: Daten defizitär.
- Literatur: Kruskop & Flanders (2021); Moratelli et al. (2019, 2020); Zhang et al. (2007).
Barbastella caspica Satunin, 1908 (Kaspische Mopsfledermaus/Caspian
Barbastelle):
- Taxonomie/Etymologie: Zunächst als Barbastella barbastella caspica beschrieben, wurde die Form dann den Taxa B. leucomelas oder B. darjelingensis zugeordnet. Inzwischen konnte die Kaspische Mopsfledermaus durch vergleichende genetische und morphometrische Analysen aber als eigenständige Art bestätigt werden. Der wissenschaftliche Name caspica bezieht sich auf die Verbreitung der Art am Kaspischen Meer.
- Bestand: Nicht bewertet; wahrscheinlich gefährdet.
- Literatur: Moratelli et al. (2019, 2020); Satunin (1908).
Barbastella
leucomelas (Cretzschmar, 1826) (Arabische
Mopsfledermaus/Arabian
Barbastelle):
- Alternative Bezeichnung: Sinai-Mopsfledermaus
- Taxonomie: Ursprünglich als Vespertilio leucomelas beschrieben.
- Bestand: Nicht gefährdet.
- Verbreitung: Afrika (Eritrea; Ägypten: Sinai).
- Literatur: Monadjem et al. (2017); Moratelli et al. (2019, 2020).
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Plecotini > Corynorhinus
Genus Corynorhinus Allen, 1865 (Gattung Neuwelt-Langohren):
-
3 Arten ; Generotypus ursprünglich Corynorhinus macrotis (Le Conte,
1831), wird aber als Unterart von C. rafinesquii
(Lesson, 1827) betrachtet.
-
Taxonomie: Von H.
Allen einst als separate Gattung beschrieben, wurde Corynorhinus in
der Vergangenheit häufig als Untergattung in Plecotus eingeordnet (Corbet & Hill, 1991). Der Status als eigenständige
Gattung lässt sich aber inzwischen durch molekulare und morphologische Analysen gut stützen.
-
Literatur: Allen (1865);
Corbet & Hill
(1991); Lesson (1827); McMurtrie
(1831).
Corynorhinus rafinesquii (Lesson, 1827) (Rafinesque-Langohr/Rafinesque’s
Big-eared Bat):
-
Taxonomie: Rafinesque (1818) beschrieb
die Art zunächst als Vespertilio megalotis. Da
der Name aber bereits vergeben
war, wurde sie von Lesson
mit Plecotus rafinesquii neu benannt.
-
Unterarten: Nördliches Rafinesque-Langohr (C.
rafinesquii rafinesquii
(Lesson, 1827)), Südliches Rafinesque-Langohr (C. rafinesquii macrotis (Le Conte,
1831) (ursprünglich als Plecotus macrotis beschrieben)).
-
Synonyme: C. leconteii (Cooper,
1837); Vespertilio megalotis Rafinesque, 1818
- Bestand: Nicht gefährdet.
-
Literatur: Arroyo-Cabrales &
Álvarez-Castañeda (2017); Lesson (1827); McMurtrie (1831); Moratelli et al. (2019,
2020).
Corynorhinus
mexicanus (G. M. Allen, 1916) (Mexikanisches Langohr/Mexican Big-eared Bat):
- Bestand: Potenziell gefährdet (Vorwarnliste).
- Literatur: Moratelli et al. (2019, 2020); Solari (2019).
Corynorhinus townsendii (Cooper, 1837) (Townsend-Langohr/Townsend’s Big-eared Bat):
- Bestand: Nicht gefährdet.
-
Literatur: Arroyo-Cabrales &
Álvarez-Castañeda (2017); Moratelli et al. (2019, 2020).
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Plecotini > Idionycteris
|
Idionycteris |
|
|
|
|
Genus Idionycteris Anthony,
1923 (Gattung Allen-Langohren):
-
1
Art.
Idionycteris
phyllotis (G. M. Allen, 1916) (Allen-Langohr/Allen’s Big-eared Bat):
- Unterarten: Südliches Allen-Langohr (I. phyllotis phyllotis (G. M. Allen, 1916), Nördliches Allen-Langohr (I. phyllotis hualapaiensis Tumlison, 1993).
- Bestand: Nicht gefährdet.
-
Literatur: Arroyo-Cabrales &
Álvarez-Castañeda (2017); Moratelli et al. (2019, 2020).
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Plecotini > Otonycteris
|
|
|
|
|
|
Otonycteris |
|
|
|
|
|
|
||
|
|
|
|
Genus Otonycteris Peters,
1859 (Gattung Wüstengroßohren):
-
2 Arten. Die Gattung beschränkt sich heute auf Nordafrika
und den Nahen Osten, war aber in der Vergangenheit offensichtlich auch in Europa verbreitet. So wurden in der Ukraine dentale Fragmente des Rummel-Wüstengroßohrs (Otonycteris rummeli Rosina, 2015) gefunden,
einer fossilen Art aus dem späten
Miozän.
-
Literatur: Benda & Gvoždík (2010); Rosina (2015); Peters (1859).
Otonycteris
hemprichii Peters, 1859 (Hemprich-Wüstengroßohr/Hemprich’s Long-eared Bat):
-
Unterarten: Nordafrikanisches
Wüstengroßohr (O.
hemprichii hemprichii Peters, 1859), Gebirgs-Wüstengroßohr (O.
hemprichii cinerea Satunin, 1909
(ZMAS 5444, bei der ursprünglichen
Angabe zum Fundort, dass das
Typusexemplar am 23. März
1901 beim Dorf Nukendžaga, Verwaltungsbezirk Ge
in Belutschistan gesammelt wurde, handelt es sich laut Ognev (1928) um einen Irrtum. Die korrigierte Angabe zum Fundort lautet
demnach, Verwaltungsbezirk Zirkuh, nahe Bamrud,
Provinz Chorasan (21. Juli
1901) im östlichen Iran), Tiefland-Wüstengroßohr (O.
hemprichii jin Cheesman & Hinton,
1924 (BM 24.8.2.2 (Britisches
Museum), adultes Männchen, gesammelt
von R. E. Cheesman
am 10. Dezember 1923 bei Hofuf, in der Hasa-Oase, Ostprovinz von Saudi-Arabien).
- Bestand: Nicht gefährdet.
- Literatur: Benda & Gvoždík (2010); Cheesman & Hinton (1924); Daniel, Korine & Pinshow (2009, 2010); Fenton, Shalmon & Makinc (1999); Holderied, Korine & Moritz (2011); Monadjem et al. (2017); Moratelli et al. (2019, 2020); Peters (1859); Qumsiyeh & Bickham (1993); Satunin (1909).
Otonycteris
leucophaea (Severtzov, 1873) (Turkestan-Wüstengroßohr/Turkestani Long-eared Bat):
- Bestand: Daten defizitär.
- Literatur: Benda (2017); Benda & Gvoždík (2010); Moratelli et al. (2019, 2020); Ogneff & Heptner (1928).
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Plecotini > Plecotus
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Plecotus |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Genus Plecotus É. Geoffroy, 1818 (Gattung Altwelt-Langohren):
-
20 Arten. Stammbaum basierend auf den Ergebnissen von Benda
et al. (2004), Kiefer
(2007), Kruskop et al. (2020), Mayer, Dietz & Kiefer (2007) und
Spitzenberger et al. (2006).
-
Literatur: Benda et al. (2004);
Hoofer & van den Bussche (2001); Kiefer (2007); Kruskop et al. (2020);
Spitzenberger et al. (2006).
Plecotus balensis Kruskop & Lavrenchenko, 2000 (Bale-Langohr/Ethiopian
Long-eared Bat):
-
Alternative
Bezeichnung: Ägyptisches Langohr.
-
Holotypus/Terra typica: S-164904 (Zoological Museum of
the Moscow State University), erwachsenes
Männchen, gesammelt von S. V. Kruskop
am 29. Dezember 1995 auf
2.760 m Höhe im Harennawald, Nationalpark
Bale-Berge, südliches Äthiopien.
- Bestand: Daten defizitär; Populationsentwicklung unbekannt.
- Verbreitung: Afrika (Äthiopien).
- Literatur: Benda et al. (2004); Kruskop & Lavrenchenko (2000); Lavrenchenko, Juste & Benda (2019); Moratelli et al. (2019, 2020).
Plecotus christii J. E. Gray, 1838 (Wüstenlangohr/Christie’s Long-eared Bat):
- Holotypus/Terra typica: BM 66a (Britisches Museum), gesammelt von Turnbull Christie im Niltal, Ägypten.
- Taxonomie/Etymologie: Benannt nach dem in Ägypten forschenden Mediziner Alexander Turnbull Christie. Dobson (1878) wertete die Form als Synonym von P. auritus. Die Analysen von Spitzberger et al. (2006) stützen jedoch den Artstatus.
-
Unterarten: Christie-Langohr (P. christii christii J. E. Gray, 1838),
Sinai-Langohr (P.
christii petraeus Benda, 2008).
- Bestand: Daten defizitär; Populationsentwicklung unbekannt.
- Verbreitung: Afrika (Libyen; Ägypten; Sudan).
- Literatur: Aulagnier & Benda (2019); Benda et al. (2004, 2008); Gray (1838); Dobson (1878); Moratelli et al. (2019, 2020); Spitzenberger et al. (2006).
Plecotus
austriacus (J. B. Fischer, 1829) (Graues Langohr/Grey
Long-eared Bat):
- Terra typica: Wien, Österreich.
- Taxonomie: Ursprünglich als Vespertilio aurtius austriacus beschrieben.
- Synonyme: Plecotus auritus meridionalis Martino & Martino, 1940 (BM 1937.4.24.40 (Britisches Museum), Weibchen, gesammelt im Juni 1936 von E. Martino, Sveti Miklavž pri Ormažu, Slowenien. Ursprünglich als Unterart von P. auritus beschrieben).
- Bestand: Potenziell gefährdet (Vorwarnliste); Population abnehmend.
- Verbreitung: Europa (Portugal; Spanien; Andorra; Frankreich; Monaco; Vereinigtes Königreich; Niederlande; Belgien; Luxemburg; Deutschland; Schweiz; Liechtenstein; Österreich; Italien; San Marino; Kroatien; Slowenien; Slowakei; Tschechien; Polen; Ukraine; Moldawien; Ungarn; Serbien; Montenegro; Bosnien-Herzegowina; Bulgarien; Rumänien; Nordmazedonien; Griechenland; Türkei).
- Literatur: Ashrafi et al. (2013); Fischer (1829); Gässler et al. (2012); Gazaryan & Godlevska (2021); Horáček, Bogdanowicz & Ðulić (2004); Karataş et al. (2003); Martino & Martino (1940); Moratelli et al. (2019, 2020); Tvrtković, Pavlinić & Haring (2005).
Plecotus
teneriffae Barrett-Hamilton, 1907 (Kanaren-Langohr/Tenerife Long-eared Bat):
- Alternative Bezeichnung: Teneriffa-Langohr.
- Holotypus/Terra typica: BM 87.4.18.1 (Britisches Museum), Geschlecht unbekannt (Haut und Schädel), gesammelt am 3. April 1887 von Ramon Gómez bei Orotava auf Teneriffa, Kanarische Inseln, Spanien.
- Taxonomie: Zeitweise als Synonym von P. austriacus gezählt (Corbet, 1978), unterstützen vergleichende morphologische und genetische Analysen (Ibañez & Fernández, 1985; Pestano et al., 2003; Spitzenberger et al., 2006) aber den Artstatus der Kanaren-Langohren.
- Bestand: Gefährdet; Population abnehmend.
- Verbreitung: Europa (Spanien: Kanaren).
- Literatur: Barrett-Hamilton (1907); Benda et al. (2004); Corbet (1978); Hutterer et al. (2005); Ibañez & Fernández, 1985; Juste & Alcaldé (2016); Juste et al. (2004); Moratelli et al. (2019, 2020); Pestano et al. (2003); Spitzenberger et al. (2006).
Plecotus gaisleri Benda, Kiefer, Hanak & Veith,
2004 (Libysches Langohr/Gaisler’s Long-eared Bat):
- Alternative Bezeichnung: Gaisler-Langohr.
- Holotypus/Terra typica: NMP 49911 (Nationalmuseum Prag), erwachsenes Weibchen, am 20. Mai 2002 im Zentrum des Wadi al Kuf (ca. 8 km südwestlich Massah) gesammelt, Kyrenaika, nordöstliches Libyen.
- Taxonomie: Zunächst als Unterart von P. teneriffae beschrieben. Genetische Untersuchungen unterstützen aber eine Abgrenzung als eigenständige Art (Mayer, Dietz & Kiefer, 2007). Die aktuell zu P. gaisleri gerechneten Populationen in Marokko stellen wahrscheinlich auch eine separate Art dar (Ancillotto et al., 2020).
- Verbreitung: Afrika (Marokko; Algerien; Tunesien; Libyen), Europa (Italien: Pantelleria; Malta).
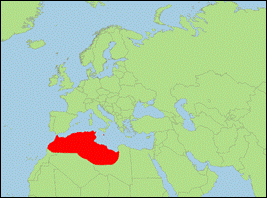
- Bestand: Nicht bewertet; vermutlich weit verbreitet.
-
Literatur: Ancillotto et al. (2020); Benda et al. (2004); Mayer, Dietz
& Kiefer (2007); Moratelli et al. (2019, 2020).
Plecotus
kolombatovici Đulić, 1980 (Balkanlangohr/Mediterranean Long-eared Bat):
- Alternative Bezeichnung: Mittelmeer-Langohr.
- Bestand: Nicht gefährdet.
-
Literatur: Benda et al. (2004);
Kiefer & von Helversen (2004); Moratelli et al. (2019, 2020); Tvrtković,
Pavlinić & Haring (2005).
Plecotus strelkovi Spitzenberger, Strelkov, Winkler & Haring, 2006 (Strelkov-Langohr/Strelkov’s Long-eared Bat):
- Holotypus/Terra typica: ZIN 62182 (Zoologisches Institut der Russischen Akademie der Wissenschaften St. Petersburg), Weibchen (Haut und Schädel), gesammelt von P. P. Strelkov am 19. Juli 1975 bei Teploklyuchenka, ca. 20 km südöstlich von Michailowka, nahe des östlichen Ufers des Issyk-Kul-Sees, Kirgisistan.
- Taxonomie/Etymologie: Benannt nach Petr Petrovich Strelkov, um seine wegweisende Forschung zur Gattung Plecotus zu ehren.
- Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
- Verbreitung: Asien (Iran; Afghanistan; Tadschikistan; Kirgisistan; Kasachstan; China; Mongolei).
- Literatur: Dolch et al. (2007); Kurdyukova & Kruskop (2017); Moratelli et al. (2019, 2020); Spitzenberger et al. (2006); Srinivasulu & Srinivasulu (2020).
Plecotus ariel Thomas, 1911 (Sichuan-Langohr/Sichuan
Long-eared Bat):
- Holotypus/Terra typica: BM 11.2.1.6 (Britisches Museum), Weibchen, gesammelt am 23. Juni 1910 bei Kangding (Tatsienlu), Sichuan, China.
- Bestand: Daten defizitär.
- Verbreitung: Asien (China: Sichuan)
-
Literatur: Fukui (2019); Moratelli et al. (2019,
2020); Thomas (1911).
Plecotus wardi Thomas, 1911 (Ward-Langohr/Ward’s Long-eared Bat):
- Holotypus/Terra typica: BM 6.10.3.2 (Britisches Museum), adultes Weibchen (Haut und Schädel), gesammelt am 10. Juni 1906 von C. A. Crump im Distrikt Leh, Territorium Ladakh, Bundesstaat Jamuu und Kaschmir, Indien.
- Taxonomie/Etymologie: Benannt nach Colonel E. A. Ward, der dem Britischen Museum einige Tiere aus dem Bundesstaat Kaschmir schenkte. Lange als Synonym von P. austriacus erachtet, erhoben die Ergebnisse von Spitzenberger et al. (2006) schließlich das Taxon in den Artstatus.
- Bestand: Nicht gefährdet.
- Verbreitung: Asien (Afghanistan; Pakistan; Indien; Nepal).
- Literatur: Moratelli et al. (2019, 2020); Spitzenberger et al. (2006); Srinivasulu & Srinivasulu (2020); Thomas (1911).
Plecotus auritus (Linnaeus, 1758) (Braunes Langohr/Brown Long-eared Bat):
- Alternative Bezeichnung: Gemeines Langohr.
- Terra typica: Europa.
- Taxonomie: Zunächst als Vespertilio auritus beschrieben.
- Bestand: Nicht gefährdet.
- Verbreitung: Europa (Spanien; Andorra, Frankreich; Irland; Vereinigtes Königreich; Norwegen; Schweden; Finnland; Dänemark; Niederlande; Belgien; Luxemburg; Deutschland; Schweiz; Liechtenstein; Österreich; Italien; San Marino; Kroatien; Slowenien; Slowakei; Tschechien; Polen; Estland; Lettland; Litauen; Weißrussland; Ukraine; Moldawien; Ungarn; Bulgarien; Rumänien; Bosnien-Herzegowina; Montenegro; Serbien; Albanien; Griechenland; Türkei; Russland), Asien (Armenien; Aserbaidschan; Georgien; Iran; evtl. auch Kasachstan).
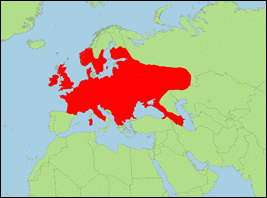
- Literatur: Ashrafi et al. (2013); Bekker & Boshamer (2007); Gazaryan, Kruskop & Godlevska (2020); Heinicke & Krauß (1978); Hernández-Montero, Adam & Kerth (2021); Horáček & Ðulić (2004); Karataş et al. (2003); Linnaeus (1758); Moratelli et al. (2019, 2020); Moussy (2011); Rydell et al. (2021); Tvrtković, Pavlinić & Haring (2005).
Plecotus begognae de Paz, 1994 (Iberisches Langohr/Iberian Long-eared Bat):
- Holotypus/Terra typica: MNCN-1604 (Nationalmuseum der Naturwissenschaften Madrid), Haut, Schädel und Penisknochen eines erwachsenen Männchens, gesammelt im Juli 1984 von Begoña del Horno und Oscar de Paz ca. 7,5 km nordwestlich Vinuesa (Höhe 1.735 m), Spanien.
- Taxonomie/Etymologie: Ursprünglich als Unterart von P. auritus beschrieben und nach Begoña del Horno benannt. Vor allem genetische, aber auch einige morphologische Daten unterstützen den Status einer separaten Art (Mayer, Dietz & Kiefer, 2007).
- Bestand: Nicht bewertet.
- Verbreitung: Europa (Portugal; Spanien).
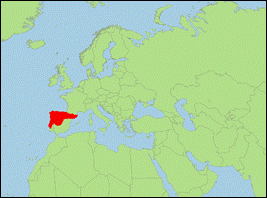
- Literatur: De Paz (1994); Dos Santos (2017); Fernandes (2017); Mayer, Dietz & Kiefer (2007); Moratelli et al. (2019, 2020); Santos et al. (2014).
Plecotus sardus Mucedda, Kiefer, Pidinchedda & Veith,
2002 (Sardisches Langohr/Sardinian Long-eared Bat):
- Holotypus/Terra typica: DZAB (Dipartimento di Zoologia e Antropologia Biologica), Totfund eines erwachsenen Männchens, gefunden von Mauro Mucedda und Ermanno Pidinchedda am 22. September 2001 in einer Höhle des Lanaitto-Tals, Oliena-Distrikt, Nuoro-Provinz, östliches Sardinien, Italien.
- Taxonomie: Das Sardische Langohr wurde lange P. auritus oder P. austriacus zugeordnet. Morphologische und genetische Unterschiede belegen aber den Artstatus.
- Bestand: Gefährdet.
- Verbreitung: Europa (Italien: Sardinien).
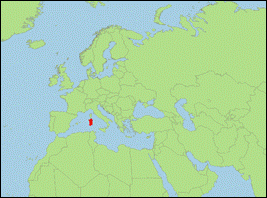
-
Literatur:
Kiefer
& Mucedda (2004); Moratelli et al. (2019, 2020);
Mucedda et al. (2002); Piraccini
(2016).
Plecotus alpinus Kiefer & Veith, 2001 (Alpenlangohr/Alpine
Long-eared Bat):
- Holotypus/Terra typica: ZFMK 2001.325 (Zoologisches Forschungsinstitut und Museum Alexander König Bonn), Totfund eines erwachsenen Männchens (Schädel, Haut, Baculum, Kadaver in Alkohol), gefunden von Philippe Favre an einer Straße in den französischen Alpen auf 1.600 m Höhe, nahe Ristolas, Départment Hautes-Alpes.
- Taxonomie/Etymologie: Der wissenschaftliche Name bezieht sich auf die Region der Alpen, wo die Art einen Verbreitungsschwerpunkt besitzt. Aktuell wird das Taxon noch häufig als Synonym oder Unterart von P. macrobullaris behandelt (Piraccini, 2016; Spitzenberger, Strelkov & Haring, 2003). Genetische Unterschiede, die auf eine Abtrennung von macrobullaris vor mehr als einer Million Jahren hindeuten, sprechen aber für die Stellung als eigenständige Art (Alberdi et al., 2013, 2015b, 2016; Mayer, Dietz & Kiefer, 2007).
- Synonyme: Plecotus microdontus Spitzenberger, 2002 (NMW 34857 (Naturhistorisches Museum Wien), Männchen (Haut und Schädel, linke Bulla tympani fehlend), gesammelt von Kurt Bauer und Barbara Herzig am 19. Mai 1980 bei Lienz, östliches Tirol, Österreich (688 m Höhe)).
- Bestand: Nicht gefährdet; Population abnehmend; von IUCN mit P. macrobullaris zusammengefasst.
- Verbreitung: Europa (Spanien; Andorra; Frankreich; Schweiz; Liechtenstein; Italien; Österreich; Slowenien).
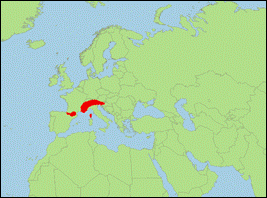
- Literatur: Alberdi & Aizpurua (2018); Alberdi et al. (2012, 2013, 2014, 2015a, b, 2016); Dietrich et al. (2006); Garin et al. (2003); Kiefer & Veith (2001); Kiefer & von Helversen (2004); Mayer, Dietz & Kiefer (2007); Moratelli et al. (2019, 2020); Piraccini (2016); Preatoni et al. (2011); Simmons (2005); Spitzenberger (2006); Spitzenberger, Haring & Tvrtković (2002); Spitzenberger, Strelkov & Haring (2003); Trizio et al. (2005).
Plecotus
macrobullaris Kuzjakin, 1965 (Kaukasisches Langohr/Caucasian Long-eared Bat):
- Holotypus/Terra typica: Nord-Ossetien, Russland.
- Taxonomie: Zunächst als Unterart von P. auritus beschrieben, später zu P. austriacus (Strelkov, 1988) gezählt. Inzwischen aber vor allem aufgrund molekularer Daten in den Artstatus erhoben (Spitzenberger, Strelkov & Haring, 2003). Aktuell wird alpinus häufig noch mit macrobullaris synonymisiert, doch stützen genetische Analysen, die auf eine Trennung der beiden Formen vor mehr als einer Million Jahren hindeuten, eine Separierung in zwei verschiedene Arten (Alberdi et al., 2013, 2015, 2016; Mayer, Dietz & Kiefer, 2007).
- Bestand: Nicht gefährdet; Population abnehmend; Bewertung der IUCN umfasst auch die Population von P. alpinus.
- Verbreitung: Eurasien (Italien; Kroatien; Slowenien; Serbien; Montenegro; Bosnien-Herzegowina; Albanien; Nordmazedonien; Griechenland; Türkei; Armenien; Georgien; Aserbaidschan; Russland; Syrien; Iran).
-
Literatur:
Alberdi & Aizpurua (2018); Alberdi et al. (2013, 2014, 2015, 2016); Bekker & Boshamer (2007); Budinski et al. (2016); Gazaryan (2009); Kiefer & von Helversen
(2004); Mayer, Dietz & Kiefer (2007); Moratelli et al. (2019,
2020); Pavlinov & Rossolimo (1987); Piraccini
(2016); Sachanowicz & Ciechanowski (2006); Spitzenberger, Strelkov & Haring (2003); Strelkov (1988); Tvrtković, Pavlinić & Haring (2005).
Plecotus
sacrimontis G. M. Allen, 1908 (Japanisches Langohr/Japanese Long-eared Bat):
- Holotypus/Terra typica: MCZ 6932 (Harvard Museum für vergleichende Zoologie Cambridge), erwachsenes Männchen, gesammelt von Alan Owston am 4. Dezember 1906 am Berg Fuji in Japan.
- Taxonomie: In der Vergangenheit oft als Unterart von P. auritus betrachtet (Simmons, 2005). Die Untersuchungen von Spitzenberger et al. (2006) unterstützen die Einteilung als eigenständige Art.
- Bestand: Nicht gefährdet.
- Verbreitung: Asien (Japan; Russland: Kurilen).
- Literatur: Allen (1908); Fukui (2015); Fukui & Sano (2019); Moratelli et al. (2019, 2020); Simmons (2005); Spitzenberger et al. (2006); Yoshikura et al. (2009); Yoshiyuki (1979).
Plecotus kozlovi Bobrinski, 1926 (Kozlov-Langohr/Kozlov’s
Long-eared Bat):
- Holotypus/Terra typica: ZIN 5880 (Zoologisches Institut der Russischen Akademie der Wissenschaften St. Petersburg), Männchen, am 11. Juni 1901 gesammelt (P. K. Kozlov), Chyrma Barun-zasak, nahe Chyrma Dsun-zasak, östliches Qaidam-Becken, China.
- Taxonomie/Etymologie: Benannt nach dem russischen Forscher und Entdecker Pëtr Kuz'mič Kozlov. Zunächst als Unterart von P. auritus beschrieben, später auch als Unterart von P. austriacus bzw. Synonym von P. ariel (Simmons, 2005) bewertet. Spitzenberger et al. (2006) erhoben das Taxon schließlich in den Status einer separaten Art.
- Synonyme: Plecotus mordax Thomas, 1926 (BM 26.8.1.1. (Britisches Museum), adultes Weibchen, gesammelt von P. S. Nazaroff bei Kaschgar, Xinjiang, China. Der wissenschaftliche Name leitet sich von dem lateinischen Wort mordax für „bissig“ ab.)
- Verbreitung: Asien (China; Mongolei).
- Bestand: Nicht gefährdet; Populationsentwicklung stabil.
- Literatur: Bobrinski (1926); Dolch et al. (2007); Fukui & Kruskop (2021); Kurdyukova & Kruskop (2017); Moratelli et al. (2019, 2020); Simmons (2005); Spitzenberger et al. (2006); Thomas (1926).
Plecotus ognevi Kishida, 1927 (Ognev-Langohr/Ognev’s
Long-eared Bat):
- Alternative Bezeichnung: Sibirisches Langohr.
- Taxonomie: Früher teils als Synonym von P. sacrimontis bzw. P. auritus sacrimontis eingeordnet (Simmons, 2005; Strelkov, 1988), separierten Spitzenberger et al. (2006) ognevi von sacrimontis und erhoben das Taxon in den Artstatus.
-
Synonyme: Plecotus uenoi Imaizumi &
Yoshiyuki, 1969.
- Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
- Verbreitung: Asien (Russland; Kasachstan; China; Mongolei; Nordkorea; Südkorea).
- Literatur: Dolch et al. (2007); Kruskop & Fukui (2019); Kurdyukova & Kruskop (2017); Moratelli et al. (2019, 2020); Simmons (2005); Spitzenberger et al.. (2006); Strelkov (1988).
Plecotus
turkmenicus Strelkov, 1988 (Turkmenistan-Langohr/Turkmen
Long-eared Bat):
- Lectotypus/Terra typica: ZIN 51383 (Zoologisches Institut der Russischen Akademie der Wissenschaften St. Petersburg), Männchen (Haut und Schädel), gesammelt am 7. Juni 1964 von V. P. Dmitrijeva im Sarykamysh-Becken, Kurgankyr, Turkmenistan.
- Taxonomie: Von Strelkov zunächst als Unterart von P. austriacus beschrieben. Im weiteren historischen Verlauf wurde das Turkmenistan-Langohr dann immer wieder als Synonym bzw. Unterart von P. austriacus oder P. auritus betrachtet. Spitzenberger et al. (2006) konnten mit genetischen und morphologischen Untersuchungen aber den Artstatus belegen.
- Verbreitung: Asien (Kasachstan; Turkmenistan).
- Bestand: Nicht gefährdet.
- Literatur: Dolch et al. (2007); Kurdyukova & Kruskop (2017); Moratelli et al. (2019, 2020); Spitzenberger et al. (2006); Srinivasulu & Srinivasulu (2019); Strelkov (1988); Strelkov, Sosnovtzeva & Babaev (1978).
Plecotus
homochrous Hodgson, 1847 (Himalaya-Langohr/Himalayan
Long-eared Bat):
- Taxonomie: Lange als Unterart oder Synonym von P. auritus betrachtet (Simmons, 2005), nach Spitzenberger et al. (2006) und Fukui et al. (2020) jedoch eine eigenständige Art.
- Synonyme: Plecotus puck Barrett-Hamilton, 1907 (BM 5.11.19.1 (Britisches Museum), Männchen (Haut), gesammelt von Capt. E. T. F. Birrell am 20. August 1905 bei Murree, nördliches Indien (2.286 m Höhe)).
- Bestand: Daten defizitär.
- Verbreitung: Asien (Pakistan; Indien; Nepal).
- Literatur: Barrett-Hamilton (1907); Fukui et al. (2020); Moratelli et al. (2019, 2020); Simmons (2005); Spitzenberger et al. (2006); Srinivasulu & Srinivasulu (2019).
Plecotus taivanus Yoshiyuki, 1991 (Taiwan-Langohr/Taiwan
Long-eared Bat):
- Holotypus/Terra typica: NSMT-M 29616 (Nationales Wissenschaftsmuseum Tokio), Haut und Schädel eines erwachsenen Weibchens, gesammelt am 29. Mai 1991 auf dem Berg An-ma Shan von Mizuko Yoshiyuki (im Bergwald auf 2.250 m Höhe), Ho-ping Hsiang, Tai-chung Hsien, Taiwan.
- Taxonomie/Etymologie: Der wissenschaftliche Name taivanus bezieht sich auf den Fundort Taiwan. Nach Analysen von Yoshiyuki (1991) Art ist eng mit P. homochrous verwandt.
- Bestand: Potenziell gefährdet (Vorwarnliste); Population abnehmend.
-
Literatur:
Hsu (1997); Huang et al. (2019); Huang, Ho & Kuo (2020);
Lin,
Lee & Cheng (1997);
Lin, Motokawa & Harada (2002); Moratelli et al. (2019, 2020);
Smith & Xie (2008, 2013); Yoshiyuki
(1991).
Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Lasiurini
Tribus Lasiurini
Tate, 1942 (Gattungsgruppe
Haarschwanzfledermäuse):
-
23 Arten.
Genus Euderma H. Allen, 1892 (Gattung Gefleckte Langohren):
-
1
Art.
Genus Lasiurus Gray,
1831 (Gattung Eigentliche
Haarschwanzfledermäuse):
-
22 Arten.
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Lasiurini > Euderma
|
Euderma |
|
|
|
|
Genus Euderma H. Allen, 1892 (Gattung Gefleckte Langohren):
-
1
Art.
Euderma maculatum (J. A. Allen, 1891) (Gefleckte Fledermaus/Spotted Great-eared Bat):
- Bestand: Nicht gefährdet.
-
Literatur: Arroyo-Cabrales &
Álvarez-Castañeda (2017); Moratelli et al. (2019, 2020).
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Lasiurini > Lasiurus
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Lasiurus |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Genus Lasiurus Gray,
1831 (Gattung Eigentliche Haarschwanzfledermäuse):
-
22 Arten;
der Stammbaum orientiert sich an den Ergebnissen von Málaga et al. (2020) und Baird et al. (2015, 2017).
-
Literatur: Baird
et al. (2015, 2017); Malaga et al. (2020).
Lasiurus xanthinus (Thomas, 1897) (Westliche Haarschwanzfledermaus/Western Yellow Bat):
- Bestand: Nicht gefährdet; Populationsentwicklung stabil.
Lasiurus ega (Gervais, 1856) (Südliche Haarschwanzfledermaus/Southern
Yellow Bat):
-
Unterarten: Ega-Haarschwanzfledermaus
(L. ega ega (Gervais,
1856)), Argentinische Haarschwanzfledermaus
(L. ega argentinus Thomas,
1901), Kolumbianische Haarschwanzfledermaus
(L. ega fuscatus Thomas
1901), Mittelamerikanische Haarschwanzfledermaus
(L. ega panamensis Thomas,
1901).
- Bestand: Nicht gefährdet.
Lasiurus
insularis Hall & J. K.
Jones, 1961 (Kubanische Haarschwanzfledermaus/Cuban
Yellow Bat):
- Bestand: Gefährdet.
Lasiurus
intermedius H. Allen, 1862 (Nördliche Haarschwanzfledermaus/Northern Yellow Bat):
- Unterarten: Mexikanische Haarschwanzfledermaus (L. intermedius intermedius H. Allen, 1862), Florida-Haarschwanzfledermaus (L. intermedius floridanus G. S. Miller, 1902).
- Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
Lasiurus egregius (Peters, 1870) (Brasilianische Haarschwanzfledermaus/Big Red Bat):
- Bestand: Daten defizitär.
Lasiurus
villosissimus (É. Geoffroy Saint-Hillaire, 1806) (Südamerikanische
Haarschwanzfledermaus/Southern
Hoary Bat):
-
Unterarten: Gewöhnliche Südamerika-Haarschwanzfledermaus (L. villosissimus villosissimus
(É. Geoffroy Saint-Hillaire,
1806)), Östliche Südamerika-Haarschwanzfledermaus
(L. villosissimus
brasiliensis Pira, 1904), Südliche
Südamerika-Haarschwanzfledermaus (L. villosissimus grayi Tomes,
1857), Nördliche Südamerika-Haarschwanzfledermaus
(L. villosissimus
pallescens Peters,
1870).
- Bestand: Nicht bewertet.
Lasiurus cinereus (Palisot de Beauvois, 1796) (Eisgraue Haarschwanzfledermaus/Northern Hoary Bat):
- Bestand: Nicht gefährdet.
Lasiurus semotus (H. Allen, 1890) (Hawaii-Haarschwanzfledermaus/Hawaiian Hoary Bat):
- Bestand: Nicht bewertet.
Lasiurus arequipae Málaga, Díaz, Arias & Medina, 2020 (Arequipa-Haarschwanzfledermaus/Arequipa Red Bat):
- Bestand: Nicht bewertet.
-
Literatur: Malaga et al. (2020);
Mamani-Contreras
& Aragón-Alvarado (2021).
Lasiurus atratus Handley, 1996 (Große Haarschwanzfledermaus/Greater Red
Bat):
- Bestand: Nicht gefährdet.
- Literatur: Moratelli et al. (2019, 2020).
Lasiurus castaneus Handley, 1960 (Panama-Haarschwanzfledermaus/Tacarcunan Red Bat):
- Bestand: Daten defizitär.
- Literatur: Moratelli et al. (2019, 2020).
Lasiurus ebenus Fazzolari-Corrêa, 1994 (São-Paulo-Haarschwanzfledermaus/Blackish Red Bat):
- Bestand: Daten defizitär.
- Literatur: Claudio et al. (2018); Moratelli et al. (2019, 2020).
Lasiurus
minor G. S. Miller, 1931 (Kleine Haarschwanzfledermaus/Minor
Red Bat):
- Bestand: Gefährdet; Population abnehmend.
- Literatur: Moratelli et al. (2019, 2020).
Lasiurus borealis (P. L. S. Müller, 1776) (Rote Haarschwanzfledermaus/Eastern Red Bat):
- Bestand: Nicht gefährdet.
- Literatur: Moratelli et al. (2019, 2020).
Lasiurus pfeifferi Gundlach, 1861 (Pfeiffer-Haarschwanzfledermaus/Pfeiffer’s Red Bat):
- Bestand: Potenziell gefährdet (Vorwarnliste).
- Literatur: Moratelli et al. (2019, 2020).
Lasiurus degelidus Miller, 1931 (Jamaika-Haarschwanzfledermaus/Jamaican Red Bat):
- Bestand: Gefährdet.
- Literatur: Moratelli et al. (2019, 2020).
Lasiurus seminolus (Rhoads, 1895) (Südstaaten-Haarschanzfledermaus/Seminole Red Bat):
- Bestand: Nicht gefährdet.
- Literatur: Moratelli et al. (2019, 2020).
Lasiurus varius (Poeppig, 1835) (Zimtrote Haarschwanzfledermaus/Cinnamon Red Bat):
- Bestand: Nicht gefährdet.
- Literatur: Ossa, Díaz & Barquez (2019); Rodríguez-San Pedro & Allendes (2016).
Lasiurus frantzii (Peters, 1870) (Wüsten-Haarschwanzfledermaus/Desert Red Bat):
- Unterarten: Südliche Wüsten-Haarschwanzfledermaus (L. frantzii frantzii (Peters, 1870)), Nördliche Wüsten-Haarschwanzfledermaus (L. frantzii teliotis H. Allen, 1891)
- Bestand: Nicht bewertet.
- Literatur: Allen (1891); Baird et al. (2015); Peters (1870).
Lasiurus salinae Thomas, 1902 (La-Pampa-Haarschwanzfledermaus/Salinas
Red Bat):
- Bestand: Daten defizitär.
- Literatur: Moratelli et al. (2019, 2020).
Lasiurus
blossevillii (Lesson & Garnot, 1826) (Blosseville-Haarschwanzfledermaus/Southern Red Bat):
- Bestand: Nicht gefährdet.
- Literatur: Gonzales, Barquez & Miller (2016); Lesson & Garnot (1826); Moratelli et al. (2019, 2020).
Lasiurus
brachyotis J. A. Allen, 1882 (Galápagos-Haarschwanzfledermaus/Galápagos
Red Bat):
- Bestand: Nicht bewertet.
- Literatur: Koopman & McCracken (1998); Moratelli et al. (2019, 2020).
Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Antrozoini
Tribus Antrozoini
Miller, 1897 (Gattungsgruppe
Gelbfledermäuse):
-
15 Arten
Genus Rhogeessa H. Allen, 1866 (Gattung Kleine
Gelbfledermäuse):
-
13 Arten
Genus Antrozous H. Allen, 1862 (Gattung Amerikanische Wüstenfledermäuse):
-
1 Art
Genus Bauerus van Gelder, 1959 (Gattung
Van-Gelder-Fledermäuse):
-
1 Art
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Antrozoini > Rhogeessa
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
|
Rhogeessa |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Genus Rhogeessa H. Allen, 1866 (Gattung Kleine
Gelbfledermäuse):
-
13 Arten
Rhogeessa alleni Thomas, 1892 (Allen-Gelbfledermaus/Allen’s Yellow Bat):
- Bestand: Nicht gefährdet
Rhogeessa
gracilis Miller, 1897 (Schlanke Gelbfledermaus/Slender Yellow Bat):
- Bestand: Nicht gefährdet
Rhogeessa
minutilla Miller, 1897 (Zwerg-Gelbfledermaus/Tiny
Yellow Bat):
- Bestand: Gefährdet
Rhogeessa mira
LaVal, 1973 (Kleine Gelbfledermaus/Least
Yellow Bat):
- Bestand: Gefährdet
Rhogeessa parvula H. Allen, 1866 (Tres-Marias-Gelbfledermaus/Little Yellow Bat):
- Bestand: Nicht gefährdet
Rhogeessa hussoni Genoways & Baker, 1996 (Husson-Gelbfledermaus/Husson’s
Yellow Bat):
- Bestand: Daten defizitär
Rhogeessa io Thomas, 1903 (Thomas-Gelbfledermaus/Thomas’ Yellow Bat):
- Bestand: Nicht gefährdet
Rhogeessa menchuae Baird, Marchán-Rivadeneira, Pérez & Baker,
2012 (Menchu-Gelbfledermaus/Menchu
Yellow Bat):
- Bestand: Nicht bewertet
Rhogeessa aeneus Goodwin, 1958 (Yucatán-Gelbfledermaus/Yucatán
Yellow Bat):
- Bestand: Nicht gefährdet
Rhogeessa velilla Thomas, 1903 (Ecuador-Gelbfledermaus/Ecuadorian Yellow Bat):
- Bestand: Nicht bewertet
Rhogeessa tumida H. Allen, 1866 (Schwarzflügel-Gelbfledermaus/Black-winged Yellow Bat):
- Bestand: Nicht gefährdet
Rhogeessa bickhami Baird, Marchán-Rivadeneira, Pérez & Baker,
2012 (Bickham-Gelbfledermaus/Bickham’s
Yellow Bat):
- Bestand: Nicht bewertet
Rhogeessa
genowaysi Baker, 1984 (Chiapias-Gelbfledermaus/Genoways’
Yellow Bat):
- Bestand: Stark gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Antrozoini > Antrozous
|
Antrozous |
|
|
|
|
Genus Antrozous H. Allen, 1862 (Gattung Amerikanische Wüstenfledermäuse):
-
1 Art
Antrozous
pallidus LeConte, 1856 (Wüstenfledermaus/Pallid Bat):
- Alternative Bezeichnung: Blasse Fledermaus
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Antrozoini > Bauerus
|
Bauerus |
|
|
|
|
Genus Bauerus van Gelder, 1959 (Gattung Van-Gelder-Fledermäuse):
-
1 Art
Bauerus
dubiaquercus van Gelder, 1959 (Van-Gelder-Fledermaus/Van
Gelder’s Bat):
- Bestand: Potenziell gefährdet (Vorwarnliste)
Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Scotophilini
|
Scotophilini |
|
|
|
|
Tribus Scotophilini Hill &
Harrison, 1987 (Gattungsgruppe Hausfledermäuse):
-
21 Arten
Genus Scotophilus Leach,
1821 (Gattung Eigentliche
Hausfledermäuse):
-
21 Arten
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Scotophilini > Scotophilus
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Scotophilus |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Genus Scotophilus Leach,
1821 (Gattung Eigentliche
Hausfledermäuse):
-
21 Arten; Stammbaum orientiert sich an den Ergebnissen von Brooks & Bickham,
2014, Koubínova
et al. (2013), Vallo et al. (2013), Vallo, Benda & Reiter (2011), Trujillo et al. (2009) und Jacobs et al. (2006)
Scotophilus
collinus Sody, 1936 (Sody-Hausfledermaus/Sody’s Yellow House Bat):
- Bestand: Nicht gefährdet
Scotophilus kuhlii Leach, 1821 (Kleine Asiatische Hausfledermaus/Lesser Asiatic Yellow House Bat):
- Bestand: Nicht gefährdet.
- Literatur: Lin, Lee & Cheng (1997).
Scotophilus nux Thomas, 1904 (Nussfarbene Hausfledermaus/Nut-colored House Bat):
- Bestand: Nicht gefährdet
Scotophilus leucogaster (Cretzschmar, 1830) (Weißbäuchige
Hausfledermaus/White-bellied
House Bat):
- Bestand: Nicht gefährdet
Scotophilus
nucella Robbins, 1983 (Robbins-Hausfledermaus/Robbins’
House Bat):
- Bestand: Daten defizitär
Scotophilus
marovaza Goodman et al., 2006 (Marovaza-Hausfledermaus/Marovaza Yellow House Bat):
- Bestand: Nicht gefährdet
Scotophilus
tandrefana Goodman, Jenkins & Ratrimomanarivo, 2005 (Westliche Hausfledermaus/Western Yellow House Bat):
- Bestand: Daten defizitär
Scotophilus
celebensis Sody, 1928 (Sulawesi-Hausfledermaus/Sulawesi
Yellow House Bat):
- Bestand: Daten defizitär
Scotophilus
heathii (Horsfield, 1831) (Große Asiatische Hausfledermaus/Greater Asiatic Yellow House Bat):
- Bestand: Nicht gefährdet
Scotophilus
robustus Milne-Edwards, 1881 (Robuste Hausfledermaus/Robust House Bat):
- Bestand: Nicht gefährdet
Scotophilus
viridis (Peters, 1852) (Südliche Grünliche Hausfledermaus/Southern Green
House Bat):
- Bestand: Nicht gefährdet
Scotophilus
borbonicus (É. Geoffroy, 1803) (Madagaskar-Hausfledermaus/Madagascar
Yellow House Bat):
- Bestand: Daten defizitär
Scotophilus colias Thomas, 1904 (Berg-Hausfledermaus/Mountain House Bat):
- Bestand: Nicht bewertet
Scotophilus andrewreborii Brooks & Bickham, 2014 (Rebori-Hausfledermaus/Andrew
Rebori’s House Bat):
- Bestand: Nicht bewertet
Scotophilus ejetai Brooks & Bickham, 2014 (Ejeta-Hausfledermaus/Ejeta’s House Bat):
- Bestand: Nicht bewertet
Scotophilus
nigrita (Schreber, 1774) (Riesen-Hausfledermaus/Giant
House Bat):
- Bestand: Nicht gefährdet
Scotophilus nigritellus de Winton, 1899 (Nördliche Grünliche Hausfledermaus/Northern Green House Bat):
- Bestand: Nicht bewertet
Scotophilus livingstonii Brooks & Bickham, 2014 (Livingstone-Hausfledermaus/Livingstone’s House Bat):
- Bestand: Nicht bewertet
Scotophilus
dinganii (A. Smith, 1833) (Gelbbäuchige Hausfledermaus/Yellow-bellied
House Bat):
- Bestand: Nicht gefährdet
Scotophilus
„mhlanganii“ [Jacobs, Kelly, Mason
& Stoffberg, 2007] (Südafrikanische Hausfledermaus/South
Africa House Bat):
- Bestand: Nicht bewertet
Scotophilus
trujilloi Brooks & Bickham, 2014 (Trujillo-Hausfledermaus/Trujillo’s House Bat):
- Bestand: Nicht bewertet
Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Perimyotini
|
|
|
|
|
|
Perimyotini |
|
|
|
|
|
|
||
|
|
|
|
Tribus Perimyotini
(Gattungsgruppe Amerikanische Zwergfledermäuse):
-
2 Arten
Genus Parastrellus Hoofer, van den Bussche & Horáček, 2006 (Gattung Westamerikanische Zwergfledermäuse):
-
1 Art
Genus Perimyotis Menu,
1984 (Gattung Ostamerikanische
Zwergfledermäuse):
-
1 Art
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Perimyotini > Parastrellus
|
Parastrellus |
|
|
|
|
Genus Parastrellus Hoofer, van den Bussche & Horáček, 2006 (Gattung Westamerikanische Zwergfledermäuse):
-
1 Art
Parastrellus
hesperus (H. Allen, 1864) (Westliche Amerikanische Zwergfledermaus/Western
Pipistrelle):
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Perimyotini > Perimyotis
|
Perimyotis |
|
|
|
|
Genus Perimyotis Menu,
1984 (Gattung Ostamerikanische
Zwergfledermäuse):
-
1 Art
Perimyotis
subflavus (F. Cuvier, 1832) (Östliche Amerikanische Zwergfledermaus/Eastern Pipistrelle):
- Bestand: Nicht gefährdet
Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Eptesicini
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
||
|
Eptesicini |
|
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Tribus Eptesicini
Volleth & Heller, 1994 (Gattungsgruppe
Breitflügelfledermäuse):
-
72 Arten
Genus Eptesicus Rafinesque, 1820 (Gattung
Eigentliche Breitflügelfledermäuse):
-
32 Arten
Genus Histiotus Gervais,
1856 (Gattung Großohrige
Braunfledermäuse):
-
7 Arten
Genus Ia Thomas, 1902 (Gattung Große Abendfledermäuse):
-
1 Arten
Genus
Scotomanes Dobson,
1875 (Gattung
Harlekinfledermäuse):
-
1 Art
Genus
Arielulus Hill &
Harrison, 1987 (Gattung Koboldfledermäuse):
-
5 Arten
Genus Lasionycteris Peters,
1865 (Gattung Silberhaarfledermäuse):
-
1 Art
Genus Glauconycteris Dobson,
1875 (Gattung
Schmetterlingsfledermäuse):
-
12 Arten
Genus Hesperoptenus Peters,
1868 (Gattung Falsche
Breitflügelfledermäuse):
-
5 Arten
Genus
Philetor Thomas,
1902 (Gattung Rohu-Fledermäuse):
-
1 Art
Genus Nycticeius Rafinesque, 1819 (Gattung Amerikanische Abendsegler):
-
2 Arten
Genus
Scoteanax Troughton, 1943 (Gattung Rüppell-Breitnasenfledermäuse):
-
1 Art
Genus
Scotorepens
Troughton, 1943 (Gattung Kleine Breitnasenfledermäuse):
-
4 Arten
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Eptesicini > Eptesicus
Genus
Eptesicus Rafinesque, 1820 (Gattung
Eigentliche Breitflügelfledermäuse):
-
32 Arten
Eptesicus dimissus Thomas, 1916 (Thailändische Breitflügelfledermaus/Surat Serotine):
- Bestand: Daten defizitär
Eptesicus guadeloupensis (Dobson, 1871) (Guadeloupe-Breitflügelfledermaus/Guadeloupean Brown Serotine):
- Bestand: Gefährdet
Eptesicus innoxius (Gervais, 1841) (Ecuador-Breitflügelfledermaus/Harmless Serotine):
- Bestand: Potenziell gefährdet (Vorwarnliste)
Eptesicus
japonensis Imaizumi, 1953 (Japanische Breitflügelfledermaus/Japanese Serotine):
- Bestand: Stark gefährdet
Eptesicus
kobayashii Mori, 1928 (Kobayashi-Breitflügelfledermaus/Kobayashi’s Serotine):
- Bestand: Daten defizitär
Eptesicus lobatus Zagorodniuk, 2009 (Ukrainische Breitflügelfledermaus/Ukrainian Serotine):
- Bestand: Nicht bewertet
Eptesicus nasutus (Dobson, 1877) (Arabische Breitflügelfledermaus/Sind Serotine):
- Bestand: Nicht gefährdet
Eptesicus
rananensis Kishida & Mori, 1931 (Nordkoreanische Breitflügelfledermaus/Ranan Serotine):
- Bestand: Nicht bewertet
Eptesicus taddeii Miranda, Bernardi & Passos, 2006 (Tadde-Breitflügelfledermaus/Tadde’s Serotine):
- Bestand: Nicht bewertet
Eptesicus tatei Ellerman & Morrison-Scott, 1951 (Tate-Breitflügelfledermaus/Tate’s
Serotine):
- Bestand: Daten defizitär
Eptesicus
pachyotis (Dobson, 1871) (Dickohr-Breitflügelfledermaus/Thick-eared Serotine):
- Bestand: Nicht gefährdet
Eptesicus andinus J. A. Allen, 1914 (Schwarze Breitflügelfledermaus/Little Black Serotine):
- Bestand: Nicht gefährdet
Eptesicus fuscus (Beauvois, 1796) (Große Braune Breitflügelfledermaus/Big Brown Serotine):
- Bestand: Nicht gefährdet
Eptesicus
diminutus Osgood, 1915 (Kleine Breitflügelfledermaus/Diminutive
Serotine):
- Bestand: Daten defizitär
Eptesicus
furinalis (d’Orbigny, 1847) (Argentinische Braune Breitflügelfledermaus/Argentine
Brown Serotine):
- Bestand: Nicht gefährdet
Eptesicus
brasiliensis (Desmarest, 1819) (Brasilienische
Braune Breitflügelfledermaus/Brazilian Brown Serotine):
- Bestand: Nicht gefährdet
Eptesicus
chiriquinus Thomas, 1920 (Chiriqui-Breitflügelfledermaus/Chiriquinan Serotine):
- Bestand: Nicht gefährdet
Eptesicus lynni Shamel, 1945 (Jamaika-Breitflügelfledermaus/Jamaican Serotine):
- Bestand: Nicht bewertet
Eptesicus
bobrinskoi Kuzyakin, 1935 (Kasachenfledermaus/Bobrinski’s Serotine):
- Alternative Bezeichnung: Bobrinskoifledermaus
- Bestand: Nicht gefährdet
Eptesicus
gobiensis Bobrinskii, 1926 (Gobi-Breitflügelfledermaus/Gobi
Serotine):
- Bestand: Nicht gefährdet
Eptesicus ognevi Bobrinskii, 1918 (Kaukasische Breitflügelfledermaus/Ognev’s Serotine):
- Bestand: Nicht bewertet
Eptesicus
andersoni Dobson, 1871 (Anderson-Breitflügelfledermaus/Anderson’s Serotine):
- Bestand: Nicht bewertet
Eptesicus
anatolicus Felten, 1971 (Küstenfledermaus/Anatolian
Serotine):
- Bestand: Nicht bewertet
Eptesicus bottae (Peters, 1869) (Botta-Breitflügelfledermaus/Botta’s
Serotine):
- Bestand: Nicht gefährdet
Eptesicus floweri (de Winton, 1901) (Warzen-Breitflügelfledermaus/Horn-skinned Serotine):
- Bestand: Nicht gefährdet
Eptesicus platyops (Thomas, 1901) (Lagos-Breitflügelfledermaus/Lagos
Serotine):
- Bestand: Daten defizitär
Eptesicus
hottentotus (A. Smith, 1833) (Hottentotten- Breitflügelfledermaus/Hottentot Serotine):
- Bestand: Nicht gefährdet
Eptesicus
pallidior Shortridge, 1942 (Südafrikanische Langschwanz-Breitflügelfledermaus/Long-tailed
Serotine):
- Bestand: Nicht bewertet
Eptesicus
nilssonii (Keyserling & Blasius, 1839) (Nordfledermaus/Northern Bat):
- Bestand: Nicht gefährdet
Eptesicus
isabellinus Temminck, 1840 (Isabellfledermaus/Isabelle
Serotine):
- Bestand: Nicht gefährdet
Eptesicus
pachyomus Tomes, 1857 (Indische Breitflügelfledermaus/Thick-muzzled Serotine):
- Bestand: Nicht bewertet.
- Literatur: Lin, Lee & Cheng (1997).
Eptesicus
serotinus (Schreber, 1774) (Europäische Breitflügelfledermaus/Common Serotine):
- Alternative Bezeichnung: Spätfliegende Fledermaus
- Bestand: Nicht gefährdet.
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Eptesicini > Histiotus
Genus
Histiotus Gervais,
1856 (Gattung Braune
Großohrfledermäuse):
-
7 Arten
Histiotus alienus Thomas, 1916 (Fremde Braune Großohrfledermaus/Strange
Big-eared Brown Bat):
- Alternative Bezeichnung: Seltsame Braune Großohrfledermaus
- Bestand: Daten defizitär
Histiotus
humboldti Handley, 1996 (Humboldt-Großohrfledermaus/Humboldt’s
Big-eared Brown Bat):
- Bestand: Daten defizitär
Histiotus
laephotis Cabrera, 1958 (Thomas-Großohrfledermaus/Thomas’ Big-eared Brown Bat):
- Bestand: Potenziell gefährdet (Vorwarnliste)
Histiotus macrotus (Poeppig, 1835) (Gemeine Braune Großohrfledermaus/Common
Big-eared Brown Bat):
- Bestand: Nicht gefährdet
Histiotus
magellanicus Philippi, 1866 (Südliche Braune Großohrfledermaus/Southern Big-eared Brown Bat):
- Bestand: Nicht gefährdet
Histiotus montanus (Philippi & Landbeck, 1861) (Kleine Braune Großohrfledermaus/Small
Big-eared Brown Bat):
- Bestand: Nicht gefährdet
Histiotus velatus (I. Geoffroy, 1824) (Tropische Braune Großohrfledermaus/Tropical
Big-eared Brown Bat):
- Bestand: Daten defizitär
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Eptesicini > Ia
|
Ia |
|
|
|
|
Genus Ia Thomas, 1902 (Gattung Große Abendfledermäuse):
-
1 Art
Ia io Thomas, 1902 (Große Abendfledermaus/Great Evening Bat):
- Alternative Bezeichnung: Ostasiatischer Frühabendsegler
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Eptesicini > Scotomanes
|
Scotomanes |
|
|
|
|
Genus
Scotomanes Dobson,
1875 (Gattung Harlekinfledermäuse):
-
1 Art
Scotomanes ornatus (Blyth, 1851) (Harlekinfledermaus/Harlequin
Bat):
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Eptesicini > Arielulus
Genus
Arielulus Hill &
Harrison, 1987 (Gattung Koboldfledermäuse):
-
5 Arten
Arielulus aureocollaris Kock & Storch, 1996 (Goldkragen-Koboldfledermaus/Collared Pipistrelle):
- Bestand: Nicht gefährdet
Arielulus
circumdatus (Temminck, 1840) (Bronzene Koboldfledermaus/Black-gilded
Pipistrelle):
- Bestand: Nicht gefährdet
Arielulus cuprosus Hill & Francis, 1984 (Kupferne Koboldfledermaus/Collared
Pipistrelle):
- Bestand: Daten defizitär
Arielulus
societatis Hill, 1972 (Gesellige Koboldfledermaus/Social Pipistrelle):
- Bestand: Gefährdet
Arielulus
torquatus Csorba & Lee, 1999 (Halsband-Koboldfledermaus/Necklace Pipistrelle):
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Eptesicini > Lasionycteris
|
Lasionycteris |
|
|
|
|
Genus Lasionycteris Peters,
1865 (Gattung
Silberhaarfledermäuse):
-
1 Art
Lasionycteris noctivagans (Le Conte, 1831) (Silberhaarfledermaus/Silver-haired
Bat):
- Bestand: Nicht gefährdet.
- Literatur: McMurtrie (1831).
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Eptesicini > Glauconycteris
Genus
Glauconycteris
Dobson, 1875 (Gattung
Schmetterlingsfledermäuse):
-
12 Arten
Glauconycteris alboguttata J. A. Allen, 1917 (Gestreifte Schmetterlingsfledermaus/Striped
Butterfly Bat):
- Bestand: Nicht gefährdet
Glauconycteris argentata (Dobson, 1875) (Silberne Schmetterlingsfledermaus/Common Butterfly Bat):
- Bestand: Nicht gefährdet
Glauconycteris
beatrix Thomas, 1901 (Kleine
Schmetterlingsfledermaus/Beatrix Butterfly Bat):
- Bestand: Nicht gefährdet
Glauconycteris
curryae Eger & Schlitter, 2001 (Curry-Schmetterlingsfledermaus/Curry’s Butterfly Bat):
- Bestand: Daten defizitär
Glauconycteris
egeria Thomas, 1913 (Bibundi-Schmetterlingsfledermaus/Bibundi Butterfly Bat):
- Bestand: Daten defizitär
Glauconycteris
gleni Peterson & Smith, 1973 (Glen-Schmetterlingsfledermaus/Glen’s Butterfly Bat):
- Bestand: Daten defizitär
Glauconycteris humeralis J. A. Allen, 1917 (Gefleckte Schmetterlingsfledermaus/Spotted
Butterfly Bat):
- Bestand: Daten defizitär
Glauconycteris kenyacola Peterson, 1982 (Kenia-Schmetterlingsfledermaus/Kenyacola Butterfly Bat):
- Bestand: Daten defizitär
Glauconycteris machadoi Hayman, 1963 (Machado-Schmetterlingsfledermaus/Machado’s Butterfly Bat):
- Bestand: Daten defizitär
Glauconycteris
poensis (Gray, 1842) (Abo-Schmetterlingsfledermaus/Abo
Butterfly Bat):
- Bestand: Nicht gefährdet
Glauconycteris
superba Hayman, 1939 (Schwarzweiße Schmetterlingsfledermaus/Pied Butterfly Bat):
- Bestand: Nicht gefährdet
Glauconycteris variegata (Tomes, 1861) (Genetzte Schmetterlingsfledermaus/Variegated
Butterfly Bat):
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Eptesicini > Hesperoptenus
Genus
Hesperoptenus
Peters, 1868 (Gattung
Falsche Breitflügelfledermäuse):
-
5 Arten
Hesperoptenus blanfordi (Dobson, 1877) (Blanford-Breitflügelfledermaus/Blanford’s False Serotine):
- Bestand: Nicht gefährdet
Hesperoptenus
doriae (Peters, 1868) (Doria-Breitflügelfledermaus/Doria’s False Serotine):
- Bestand: Daten defizitär
Hesperoptenus
gaskelli Hill, 1983 (Sulawesi-Breitflügelfledermaus/Gaskell’s False Serotine):
- Bestand: Daten defizitär
Hesperoptenus
tickelli (Blyth, 1851) (Tickell-Breitflügelfledermaus/Tickell’s False Serotine):
- Bestand: Nicht gefährdet
Hesperoptenus
tomesi Thomas, 1905 (Tomes-Breitflügelfledermaus/Tomes’
False Serotine):
- Bestand: Gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Eptesicini > Philetor
Genus
Philetor Thomas,
1902 (Gattung Rohu-Fledermäuse):
-
1 Art
Philetor
brachypterus (Temminck, 1840) (Rohu-Fledermaus/Rohu’s Bat):
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Eptesicini > Nycticeius
Genus Nycticeius Rafinesque, 1819 (Gattung Amerikanische Abendsegler):
-
3 Arten
Nycticeius
aenobarbus (Temminck, 1840) (Temminck-Abendsegler/Temminck’s Evening Bat):
- Nur ein Exemplar bekannt, das möglicherweise nicht aus Südamerika stammt; Gattungszugehörigkeit unsicher
- Bestand: Daten defizitär
Nycticeius cubanus Gundlach, 1861 (Kubanischer Abendsegler/Cuban Evening Bat):
- Bestand: Potenziell gefährdet (Vorwarnliste)
Nycticeius
humeralis (Rafinesque, 1818) (Schwarzschulter-Abendsegler/Black-shouldered Evening Bat):
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Eptesicini > Scoteanax
Genus
Scoteanax Troughton, 1943 (Gattung Rüppell-Breitnasenfledermäuse):
-
1 Art
Scoteanax
rueppellii (Peters, 1866) (Rüppell-Breitnasenfledermaus/Rüppell’s Broad-nosed Bat):
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Eptesicini > Scotorepens
Genus
Scotorepens
Troughton, 1943 (Gattung Kleine Breitnasenfledermäuse):
-
4 Arten
Scotorepens
balstoni (Thomas, 1906) (Westliche Breitnasenfledermaus/Western Broad-nosed
Bat):
- Bestand: Nicht gefährdet
Scotorepens greyii (Gray, 1842) (Kleine Breitnasenfledermaus/Little Broad-nosed
Bat):
- Bestand: Nicht gefährdet
Scotorepens orion (Troughton, 1937) (Östliche Breitnasenfledermaus/Eastern
Broad-nosed Bat):
- Bestand: Nicht gefährdet
Scotorepens
sanborni (Troughton, 1937) (Nördliche Breitnasenfledermaus/Northern
Broad-nosed Bat):
- Bestand: Nicht gefährdet
Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Hypsugini
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Hypsugini |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Tribus Hypsugini
(Gattungsgruppe Tropische Glattnasen):
-
84 Arten
Genus
Tylonycteris
Peters, 1872 (Gattung Bambusfledermäuse):
-
6 Arten
Genus Laephotis Thomas,
1901 (Gattung Afrikanische
Langohrfledermäuse):
-
4 Arten
Genus Neoromicia Roberts,
1926 (Gattung Afrikanische
Zwergfledermäuse):
-
15 Arten
Genus
Nycticeinops
Hill & Harrison, 1987 (Gattung Afrikanische Abendfledermäuse):
-
1 Art
Genus Hypsugo Gray,
1821 (Gattung Asiatische
Zwergfledermäuse):
-
18 Arten
Genus
Mimetillus Thomas, 1904 (Gattung Moloney-Flachkopffledermäuse):
-
1 Art
Genus Vespadelus Troughton, 1943 (Gattung Australische Wald- und
Höhlenfledermäuse):
-
9 Arten
Genus Eudiscopus Osgood,
1932 (Gattung
Scheibenfußfledermäuse):
-
1 Art
Genus
Chalinolobus
Peters, 1866 (Gattung
Lappenfledermäuse):
-
7 Arten
Genus Falsistrellus Troughton, 1943 (Gattung Falsche Zwergfledermäuse):
-
5 Arten
Genus Nyctophilus Leach,
1821 (Gattung Australische
Langohrfledermäuse):
-
16 Arten
Genus
Pharotis Thomas,
1914 (Gattung
Neuguinea-Langohrfledermäuse):
-
1 Art
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Hypsugini > Tylonycteris
Genus
Tylonycteris
Peters, 1872 (Gattung
Bambusfledermäuse):
-
6 Arten
Tylonycteris
fulvida (Blyth, 1859) (Blyth-Bambusfledermaus/Blyth’s Bamboo Bat):
- Bestand: Nicht bewertet
Tylonycteris malayana Chasen, 1940 (Malaiische Bambusfledermaus/Malayan Bamboo Bat):
- Bestand: Nicht bewertet
Tylonycteris pachypus (Temminck, 1840) (Kleine Bambusfledermaus/Lesser Bamboo Bat):
- Bestand: Nicht gefährdet
Tylonycteris
pygmaeus Feng, Li & Wang, 2008 (Zwerg-Bambusfledermaus/Pygmy Bamboo Bat):
- Bestand: Nicht bewertet
Tylonycteris
robustula Thomas, 1915 (Große Bambusfledermaus/Common
Greater Bamboo Bat):
- Bestand: Nicht gefährdet
Tylonycteris tonkinens Tu, Csorba, Ruedi & Hassanin, 2017 (Tonkin-Bambusfledermaus/Tonkin’s
Greater Bamboo Bat):
- Bestand: Nicht bewertet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Hypsugini > Laephotis
Genus
Laephotis Thomas,
1901 (Gattung Afrikanische
Langohrfledermäuse):
-
4 Arten
Laephotis
angolensis Monard, 1935 (Angola-Langohr/Angolan Long-eared Bat):
- Bestand: Daten defizitär
Laephotis
botswanae Setzer, 1971 (Botswana-Langohr/Botswanan Long-eared Bat):
- Bestand: Nicht gefährdet
Laephotis
namibensis Setzer, 1971 (Namibia-Langohr/Namibian Long-eared Bat):
- Bestand: Nicht gefährdet
Laephotis wintoni Thomas, 1901 (De-Winton-Langohr/De Winton’s Long-eared Bat):
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Hypsugini > Neoromicia
Genus
Neoromicia Roberts,
1926 (Gattung Afrikanische
Zwergfledermäuse):
-
15 Arten
Neoromicia
brunneus (Thomas, 1880) (Dunkelbraune Zwergfledermaus/Dark-brown Serotine):
- Bestand: Potenziell gefährdet (Vorwarnliste)
Neoromicia
capensis (A. Smith, 1829) (Kap-Zwergfledermaus/Cape Serotine):
- Bestand: Nicht gefährdet
Neoromicia
guineensis (Bocage, 1889) (Guinea-Zwergfledermaus/Guinean Serotine):
- Bestand: Nicht gefährdet
Neoromicia helios (Heller, 1912) (Heller-Zwergfledermaus/Heller’s Serotine):
- Bestand: Daten defizitär
Neoromicia malagasyensis Peterson, Eger & Mitchell, 1995 (Isalo-Zwergfledermaus/Isalo Serotine):
- Bestand: Stark gefährdet
Neoromicia matroka Thomas & Schwann, 1905 (Madagaskar-Zwergfledermaus/Malagasy
Serotine):
- Bestand: Nicht gefährdet
Neoromicia
melckorum Roberts, 1919 (Melck-Zwergfledermaus/Melck’s
Serotine):
- Bestand: Daten defizitär
Neoromicia nanus (Peters, 1852) (Bananen-Zwergfledermaus/Banana
Serotine):
- Bestand: Nicht gefährdet
Neoromicia
rendalli (Thomas, 1889) (Rendall-Zwergfledermaus/Rendall’s Serotine):
- Bestand: Nicht gefährdet
Neoromicia
robertsi Goodman, Taylor, Ratrimomanarivo
& Hoofer, 2012 (Roberts-Zwergfledermaus/Roberts’ Serotine):
- Bestand: Nicht bewertet
Neoromicia roseveari Monadjem, Richards, Taylor & Stoffberg, 2013 (Rosevear-Zwergfledermaus/Rosevear’s
Serotine):
- Bestand: Nicht bewertet
Neoromicia
somalicus (Thomas, 1901) (Somalia-Zwergfledermaus/Somali
Serotine):
- Bestand: Nicht gefährdet
Neoromicia stanleyi Goodman, Kearney, Ratsimbazafy & Hassanin, 2017 (Stanley-Zwergfledermaus/Stanley’s
Serotine):
- Bestand: Nicht bewertet
Neoromicia
tenuipinnis (Peters, 1872) (Weißflügel-Zwergfledermaus/White-winged Serotine):
- Bestand: Nicht gefährdet
Neoromicia
zuluensis (Roberts, 1924) (Zulu-Zwergfledermaus/Aloe
Serotine):
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Hypsugini > Nycticeinops
|
Nycticeinops |
|
|
|
|
Genus
Nycticeinops
Hill & Harrison, 1987 (Gattung Afrikanische Abendfledermäuse):
-
1 Art
Nycticeinops schlieffeni Peters, 1859 (Schlieffen-Abendfledermaus/Schlieffen’s
Twilight Bat):
- Alternative Bezeichung: Savannenfledermaus
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Hypsugini > Hypsugo
Genus
Hypsugo Gray,
1821 (Gattung Asiatische
Zwergfledermäuse):
-
18 Arten
Hypsugo
alaschanicus (Bobrinskii, 1926) (Ala-Shan-Zwergfledermaus/Alashanian Pipistrelle):
- Bestand: Nicht gefährdet
Hypsugo anchietae (Seabra, 1900) (Anchieta-Zwergfledermaus/Anchieta’s Pipistrelle):
- Bestand: Nicht gefährdet
Hypsugo anthonyi (Tate, 1942) (Myanmar-Zwergfledermaus/Anthony’s
Pipistrelle):
- Bestand: Daten defizitär
Hypsugo arabicus (Harrison, 1979) (Arabische Zwergfledermaus/Arabia
Pipistrelle):
- Bestand: Daten defizitär
Hypsugo ariel (Thomas, 1904) (Elfen-Zwergfledermaus/Fairy Pipistrelle):
- Bestand: Daten defizitär
Hypsugo
bodenheimeri (Harrison, 1960) (Bodenheimer-Zwergfledermaus/Bodenheimer’s Pipistrelle):
- Bestand: Nicht gefährdet
Hypsugo cadornae (Thomas, 1916) (Cadorna-Zwergfledermaus/Cadorna’s
Pipistrelle):
- Bestand: Nicht gefährdet
Hypsugo crassulus (Thomas, 1904) (Breitköpfige Zwergfledermaus/Broad-headed
Pipistrelle):
- Bestand: Nicht gefährdet
Hypsugo
eisentrauti (Hill, 1968) (Eisentraut-Zwergfledermaus/Eisentraut’s Pipistrelle):
- Bestand: Daten defizitär
Hypsugo imbricatus (Horsfield, 1824) (Indonesische Zwergfledermaus/Indonesia
Pipistrelle):
- Bestand: Nicht gefährdet
Hypsugo joffrei (Thomas, 1915) (Joffre-Zwergfledermaus/Northern
Burma Pipistrelle):
- Bestand: Daten defizitär
Hypsugo kitcheneri (Thomas, 1916) (Rotbraune Zwergfledermaus/Red Brown Pipistrelle):
- Bestand: Daten defizitär
Hypsugo lophurus (Thomas, 1915) (Tenasserim-Zwergfledermaus/Tenasserim
Pipistrelle):
- Bestand: Daten defizitär
Hypsugo macrotis (Temminck, 1840) (Großohr-Zwergfledermaus/Big-eared Pipistrelle):
- Bestand: Nicht gefährdet
Hypsugo musciculus (Thomas, 1913) (Mäuschen-Zwergfledermaus/Mouse-like
Pipistrelle):
- Bestand: Daten defizitär
Hypsugo pulveratus (Peters, 1871) (Chinesische Zwergfledermaus/Chinese
Pipistrelle):
- Bestand: Nicht gefährdet
Hypsugo savii (Bonaparte, 1837) (Alpenfledermaus/Savi’s Pipistrelle):
- Bestand: Nicht gefährdet
Hypsugo
vordermanni (Jentink, 1890) (Vordermann-Zwergfledermaus/Vordermann’s Pipistrelle):
- Bestand: Daten defizitär
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Hypsugini > Mimetillus
|
Mimetillus |
|
|
|
|
Genus
Mimetillus Thomas, 1904 (Gattung Moloney-Flachkopffledermäuse):
-
1 Art
Mimetillus
moloneyi (Thomas, 1891) (Moloney-Schmalflügelfledermaus/Moloney’s Mimic Bat):
- Alternative Bezeichung: Moloney-Flachkopffledermaus
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Hypsugini > Vespadelus
Genus
Vespadelus Troughton, 1943 (Gattung Australische Wald- und
Höhlenfledermäuse):
-
9 Arten
Vespadelus
baverstocki Kitchener, Jones & Caputi, 1987 (Baverstock-Waldfledermaus/Baverstock’s Forest Bat):
- Bestand: Nicht gefährdet
Vespadelus
caurinus Thomas, 1914 (Nördliche Höhlenfledermaus/Northern Cave Bat):
- Bestand: Nicht gefährdet
Vespadelus
darlingtoni Allen, 1933 (Große Waldfledermaus/Large
Forest Bat):
- Bestand: Nicht gefährdet
Vespadelus
douglasorum Kitchener, 1976 (Gelblippen-Höhlenfledermaus/Kimberley Cave Bat):
- Bestand: Nicht gefährdet
Vespadelus
finlaysoni Kitchener, Jones & Caputi, 1987 (Finlayson-Höhlenfledermaus/Inland Cave Bat):
- Bestand: Nicht gefährdet
Vespadelus pumilus Gray, 1841 (Östliche Waldfledermaus/Eastern Forest Bat):
- Bestand: Nicht gefährdet
Vespadelus regulus (Thomas, 1906 (Südliche Waldfledermaus/Southern Forest
Bat):
- Bestand: Nicht gefährdet
Vespadelus
troughtoni Kitchener, Jones & Caputi, 1987 (Troughton-Waldfledermaus/Troughton’s Forest Bat):
- Bestand: Nicht gefährdet
Vespadelus
vulturnus Thomas, 1914 (Kleine Waldfledermaus/Little
Forest Bat):
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Hypsugini > Eudiscopus
Genus
Eudiscopus Osgood,
1932 (Gattung
Scheibenfußfledermäuse):
-
1 Art
Eudiscopus
denticulus Osgood, 1932 (Scheibenfußfledermaus/Disk-footed
Bat):
- Alternative Bezeichnung: Diskusfüßige Fledermaus
- Bestand: Daten defizitär
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Hypsugini > Chalinolobus
|
|
|
|
|
|
|
|||
|
|
|
||
|
|
|||
|
|
|
||
|
|
|||
|
Chalinolobus |
|
|
|
|
|
|||
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
Genus
Chalinolobus
Peters, 1866 (Gattung
Lappenfledermäuse):
-
7 Arten
Chalinolobus
dwyeri Ryan, 1966 (Große Lappenfledermaus/Large Wattled
Bat):
- Bestand: Potenziell gefährdet (Vorwarnliste)
Chalinolobus
gouldii (Gray, 1841) (Gould-Lappenfledermaus/Gould’s Wattled Bat):
- Bestand: Nicht gefährdet
Chalinolobus
morio (Gray, 1841) (Schokoladen-Lappenfledermaus/Chocolate Wattled Bat):
- Bestand: Nicht gefährdet
Chalinolobus neocaledonicus
Revilliod, 1913 (Neukaledonien-Lappenfledermaus/New
Caledonia Wattled Bat):
- Bestand: Stark gefährdet
Chalinolobus nigrogriseus (Gould, 1852) (Schwarzgraue Lappenfledermaus/Hoary Wattled Bat):
- Bestand: Nicht gefährdet
Chalinolobus
picatus (Gould, 1852) (Kleine Lappenfledermaus/Little Wattled
Bat):
- Bestand: Potenziell gefährdet (Vorwarnliste)
Chalinolobus tuberculatus (Forster, 1844) (Neuseeland-Lappenfledermaus/Long-tailed Wattled Bat):
- Alternative Bezeichnung: Langschwanz-Lappenfledermaus
- Bestand: Gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Hypsugini > Falsistrellus
|
|
|
|
|
|
|
|||
|
|
|
||
|
|
|||
|
Falsistrellus |
|
|
|
|
|
|||
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
Genus Falsistrellus Troughton, 1943 (Gattung Falsche Zwergfledermäuse):
-
5 Arten
Falsistrellus
affinis (Dobson, 1871) (Schokoladen-Zwergfledermaus/Chocolate
Pipistrelle):
- Bestand: Nicht gefährdet
Falsistrellus mackenziei Kitchener, Caputi
& Jones, 1986 (Westliche
Falsche Zwergfledermaus/Western
False Pipistrelle):
- Bestand: Potenziell gefährdet (Vorwarnliste)
Falsistrellus
mordax (Peters, 1866) (Pilz-Zwergfledermaus/Fungus
Pipistrelle):
- Bestand: Daten defizitär
Falsistrellus
petersi (A. Meyer, 1899) (Peters-Zwergfledermaus/Peters’
Pipistrelle):
- Bestand: Daten defizitär
Falsistrellus tasmaniensis (Gould, 1858) (Östliche Falsche Zwergfledermaus/Eastern False Pipistrelle):
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Hypsugini > Nyctophilus
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
Nyctophilus |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Genus Nyctophilus Leach,
1821 (Gattung Australische
Langohrfledermäuse):
-
16 Arten
Nyctophilus arnhemensis Johnson, 1959 (Arnhem-Langohr/Arnhem Long-eared
Bat):
- Bestand: Nicht gefährdet
Nyctophilus bifax Thomas, 1915 (Ostaustralisches Langohr/Eastern Long-eared Bat):
- Bestand: Nicht gefährdet
Nyctophilus
corbeni Parnaby, 2009 (Corben-Langohr/South-eastern
Long-eared Bat):
- Bestand: Nicht bewertet
Nyctophilus
daedalus Thomas, 1915 (Nordaustralisches Langohr/Northern Long-eared Bat):
- Bestand: Nicht gefährdet
Nyctophilus
geoffroyi Leach, 1821 (Geoffroy-Langohr/Lesser
Long-eared Bat):
- Bestand: Nicht gefährdet
Nyctophilus gouldi Tomes, 1858 (Gould-Langohr/Gould’s Long-eared Bat):
- Bestand: Nicht gefährdet
Nyctophilus heran Kitchener, How
& Maharadatunkamsi, 1991 (Sunda-Langohr/Sundan
Long-eared Bat):
- Bestand: Daten defizitär
Nyctophilus
howensis McKean, 1975 (Lord-Howe-Langohr/Lord
Howe Long-eared Bat):
- Bestand: Vom Aussterben bedroht
Nyctophilus
major Gray, 1844 (Westaustralisches Langohr/Western Long-eared Bat):
- Bestand: Nicht bewertet
Nyctophilus
microdon Laurie & Hill, 1954 (Kleinzähniges Langohr/Small-toothed Long-eared Bat):
- Bestand: Daten defizitär
Nyctophilus
microtis Thomas, 1888 (Papua-Langohr/Papuan
Long-eared Bat):
- Bestand: Nicht gefährdet
Nyctophilus
nebulosus Parnaby, 2002 (Neukaledonien-Langohr/New
Caledonia Long-eared Bat):
- Bestand: Vom Aussterben bedroht
Nyctophilus
sherrini Thomas, 1915 (Tasmanisches Langohr/Tasmanian Long-eared Bat):
- Bestand: Daten defizitär
Nyctophilus
shirleyae Parnaby, 2009 (Shirley-Langohr/Shirley’s Long-eared Bat):
- Bestand: Nicht bewertet
Nyctophilus timoriensis (É. Geoffroy, 1806) (Timor-Langohr/Greater
Long-eared Bat):
- Bestand: Daten defizitär
Nyctophilus
walkeri Thomas, 1892 (Walker-Langohr/Walker’s Long-eared Bat):
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Hypsugini > Pharotis
|
Pharotis |
|
|
|
|
Genus
Pharotis Thomas,
1914 (Gattung
Neuguinea-Langohrfledermäuse):
-
1 Art
Pharotis imogene Thomas, 1914 (Neuguinea-Langohr/New
Guinea Big-eared Bat):
- Bestand: Vom Aussterben bedroht
Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Vespertilionini
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Vespertilionini |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
||
|
|
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Tribus Vespertilionini
Gray, 1821 (Gattungsgruppe
Altwelt-Glattnasen):
-
58 Arten
Genus Vespertilio Linnaeus, 1758 (Gattung
Zweifarbfledermäuse):
-
2 Arten
Genus Scotoecus Linnaeus, 1758 (Gattung Kleine
Hausfledermäuse):
-
5 Arten.
Genus Nyctalus Bowdich, 1825 (Gattung Eurasische
Abendsegler):
-
10 Arten.
-
Identifizierung/Beschreibung: Bei Fledermäusen dieser Gattung handelt es sich um gute, schnelle Flieger, die teils über 50 km/h erreichen können. Die Nasenöffnungen sind nach vorne
gerichtet und die kurzen, dreieckigen Ohren durch einen
behaarten Zwischenraum relativ weit voneinander
getrennt;
der Tragus ist pilz- oder scheibenförmig verbreitert; Flügel schmal und lang;
der fünfte Finger ist verkürzt und entspricht
von der Länge her etwa den Mittelhandknochen des dritten und vierten
Fingers ; Spornbein mit breiten
Kiel, durch Knorpelstab verstärkt; 34 Zähne (I 2/3
C 1/1 P 2/2 M 3/3).
-
Literatur: Krapp (2011).
Genus Glischropus Dobson,
1875 (Gattung
Dickdaumenfledermäuse):
-
3 Arten
Genus Pipistrellus Kaup,
1829 (Gattung Eigentliche
Zwergfledermäuse):
-
37 Arten
Genus Scotozous Dobson,
1875 (Gattung Dormer-Zwergfledermäuse):
-
1 Art
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Vespertilionini
> Vespertilio
|
|
|
|
|
|
Vespertilio |
|
|
|
|
|
|
||
|
|
|
|
Genus Vespertilio Linnaeus, 1758 (Gattung
Zweifarbfledermäuse):
-
2 Arten
Vespertilio
murinus Linnaeus, 1758 (Europäische Zweifarbfledermaus/European
Parti-colored Bat):
- Bestand: Nicht gefährdet
Vespertilio
sinensis (Thomas, 1899) (Asiatische Zweifarbfledermaus/Asian Parti-colored
Bat):
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Vespertilionini
> Scotoecus
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
||
|
Scotoecus |
|
|
||
|
|
|
|
||
|
|
|
|
||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
Genus Scotoecus Linnaeus, 1758 (Gattung Kleine
Hausfledermäuse):
-
5 Arten.
Scotoecus
albofuscus (Thomas, 1890) (Weißflügel-Hausfledermaus/Light-winged Lesser House Bat):
- Unterarten: Westliche Weißflügel-Hausfledermaus (S. albofuscus albofuscus (Thomas, 1890)), Östliche Weißflügel-Hausfledermaus (S. albofuscus woodi Thomas, 1917)
- Bestand: Daten defizitär.
- Literatur: Thomas (1890, 1917).
Scotoecus
pallidus (Dobson, 1876) (Fahle Hausfledermaus/Desert Yellow Lesser House Bat):
- Bestand: Nicht gefährdet.
Scotoecus albigula Thomas, 1909 (Weißkehl-Hausfledermaus/White-throated Lesser House Bat):
- Taxonomie: Eventuell Unterart oder Synonym von Scotoecus hirundo.
- Bestand: Daten defizitär.
Scotoecus hindei Thomas, 1901 (Hinde-Hausfledermaus/Hinde’s Lesser House Bat):
- Taxonomie: Immer wieder als Unterart oder Synonym von Scotoecus hirundo gelistet, unterstützen die Analysen von Monadjem et al. (2021) den Artstatus.
- Bestand: Daten defizitär.
- Literatur: Monadjem et al. (2021); Thomas (1901).
Scotoecus hirundo (de Winton, 1899) (Schwarzflügel-Hausfledermaus/Dark-winged Lesser House Bat):
- Bestand: Nicht gefährdet.
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Vespertilionini
> Nyctalus
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
Nyctalus |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Genus Nyctalus Bowdich, 1825 (Gattung
Eurasische Abendsegler):
-
10 Arten.
-
Identifizierung/Beschreibung: Bei Fledermäusen dieser Gattung handelt es sich um gute, schnelle Flieger, die teils über 50 km/h erreichen können. Die Nasenöffnungen sind nach vorne
gerichtet und die kurzen, dreieckigen Ohren durch einen
behaarten Zwischenraum relativ weit voneinander
getrennt;
der Tragus ist pilz- oder scheibenförmig verbreitert; Flügel schmal und lang;
der fünfte Finger ist verkürzt und entspricht
von der Länge her etwa den Mittelhandknochen des dritten und vierten
Fingers ; Spornbein mit breiten
Kiel, durch Knorpelstab verstärkt; 34 Zähne (I 2/3
C 1/1 P 2/2 M 3/3).
-
Literatur: Krapp (2011); Salgueiro et al. (2006).
Nyctalus labiatus Hodgson, 1835 (Südasiatischer
Abendsegler/South Asian Noctule):
- Taxonomie: Meist als Unterart von N. noctula oder N. plancyi gelistet. Es bestehen aber deutliche morphologische Unterschiede, die einen Status als separate Art stützen.
- Bestand: Nicht bewertet.
- Literatur: Moratelli et al. (2019, 2020).
Nyctalus plancyi Gerbe, 1880 (Nordchinesischer
Abendsegler/Northern Chinese Noctule):
- Bestand: Nicht gefährdet; von IUCN inkl. N. velutinus bewertet.
- Literatur: Jiang et al. (2019); Moratelli et al. (2019, 2020); Shi, Yu & Wu (2020).
Nyctalus velutinus Allen, 1923 (Südchinesischer
Abendsegler/Southern Chinese Noctule):
- Taxonomie: Gelegentlich als Unterart von N. plancyi gelistet (Moratelli et al., 2019).
- Bestand: Nicht gefährdet; von IUCN mit N. plancyi bewertet.
- Literatur: Lin, Lee & Cheng (1997); Moratelli et al. (2019, 2020); Shi, Yu & Wu (2020).
Nyctalus noctula (Schreber, 1774) (Großer Abendsegler/Common
Noctule):
- Taxonomie: Zunächst als Vespertilio noctula beschrieben.
- Unterarten: Gewöhnlicher Großabendsegler (N. noctula noctula (Schreber, 1774), Libanon-Großabendsegler (N. noctula lebanotius D. L. Harrison, 1962), Mecklenburz-Großabendsegler (N. noctula mecklenburzevi Kuzyakin, 1934).
- Biologie: Der Große Abendsegler ist ursprünglich eine waldbewohnende Art, kommt heute aber auch im Siedlungsbereiche vor. Sommerquartiere finden sich in Baumhöhlen, v.a. Spechthöhlen am Waldrand, als auch hinter Fassadenverkleidungen von Gebäuden, in Rollladenkästen. Fledermauskästen werden von der Art ebenfalls gut angenommen. Als Winterquartiere dienen Spalten an Gebäuden und Brücken, dickwandige Baumhöhlen sowie Felsspalten und Höhlen. N. noctula ist ein Jäger im freien Lauftraum, bevorzugt in 10-50 m Höhe. Die Nahrung setzt sich hauptsächlich aus Zweiflüglern, Käfern, Schmetterlingen, Wanzen und Köcherfliegen zusammen.
- Bestand: Nicht gefährdet; Rote Liste Deutschland Potenziell gefährdet (Vorwarnliste); Rote Liste Bayern Nicht gefährdet.
- Literatur: Blohm (2003); Boonman (2000); Csorba & Hutson (2016); Dietz, Nill & von Helversen (2016); Gloor, Stutz & Ziswiler (1995); Heise (1985, 1993); Heise & Schmidt (1979); Kaňuch & Cel’uch (2004); Kaňuch, Janečková & Krištín (2005); Kronwitter (1988); Kugelschafter & Harrje (1996); Meinig et al. (2020); Moratelli et al. (2019, 2020); Ruczyński & Bogdanowicz (2005); Ruedi, Tupinier & de Paz (1998); Qian et al. (2015); Rudolph et al. (2017); Stratmann (1978); Vedder (1999); Weid (2002).
Nyctalus aviator Thomas, 1911 (Großer Ostasiatischer Abendsegler/Bird-like
Noctule):
- Taxonomie: Früher auch als Unterart von N. lasiopterus betrachtet (Tate, 1942). Unterschiede in der Morphologie unterstützen aber den Rang als eigenständige Art (Corbet, 1978).
- Bestand: Potenziell gefährdet (Vorwarnliste); Population abnehmend.
- Literatur: Corbet (1978); Fukui, Sano & Kruskop (2019); Lee et al. (2019); Moratelli et al. (2019, 2020); Tate (1942).
Nyctalus
lasiopterus (Schreber, 1780) (Riesenabendsegler/Giant
Noctule):
- Taxonomie: Ursprünglich als Vespertilio lasiopterus beschrieben. Schwesterart von N. aviator, die früher auch als Unterart gezählt wurde.
- Bestand: Gefährdet.
- Literatur: Alcaldé, Juste & Paunović (2016); Dietz, Nill & von Helversen (2016); Moratelli et al. (2019, 2020).
Nyctalus azoreum (Thomas, 1901) (Azoren-Abendsegler/Azorean
Noctule):
- Taxonomie: Ursprünglich als Pterygistes azoreum beschrieben und später oft als Unterart von N. leisleri geführt (Corbet, 1978). Genetisch zeigt sich auch eine enge Verwandtschaft zu N. leisleri. Morphologisch und ökologisch lassen sich beide Arten aber gut unterscheiden.
- Bestand: Gefährdet.
- Verbreitung: Europa (Portugal: Azoren).
- Literatur: Corbet (1978); Dietz, Nill & von Helversen (2016); Irwin & Speakman (2003); Moratelli et al. (2019, 2020); Palmeirim (1991); Piraccini (2016); Salgueiro et al. (2004, 2006); Speakman & Webb (1993).
Nyctalus leisleri (Kuhl, 1817) (Kleiner Abendsegler/Leisler’s Noctule):
- Taxonomie: Zunächst als Vespertilio leisleri beschrieben.
- Unterarten: Gewöhnlicher Kleinabendsegler (N. leisleri leisleri (Kuhl, 1817)), Madeira-Kleinabendsegler (N. leisleri verrucosus Bowdich, 1825).
- Bestand: Nicht gefährdet.
- Literatur: Dietz, Nill & von Helversen (2016); Juste & Paunović (2016); Moratelli et al. (2019, 2020).
Nyctalus montanus (Barrett-Hamilton, 1906) (Bergabendsegler/Mountain Noctule):
- Taxonomie: Ursprünglich als Pterygistes montanus beschrieben und später als Unterart von N. leisleri gelistet (Ellerman & Morrison-Scott, 1951). Inzwischen wird die Form aber als eigene Art anerkannt.
- Bestand: Nicht gefährdet.
- Verbreitung : Asien (Afghanistan; Pakistan; Indien; Nepal)
- Literatur: Moratelli et al. (2019, 2020); Srinivasulu & Srinivasulu (2019).
Nyctalus furvus Imaizumi & Yoshiyuki, 1968 (Japanischer Abendsegler/Japanese Noctule):
- Taxonomie: In der Vergangenheit häufig als Unterart von N. noctula gelistet (Corbet, 1978).
- Bestand: Stark gefährdet; Population abnehmend.
- Verbreitung: Asien (Japan).
-
Literatur: Corbet (1978); Fukui
& Sano (2020); Moratelli et al. (2019,
2020).
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Vespertilionini
> Glischropus
Genus Glischropus Dobson,
1875 (Gattung
Dickdaumenfledermäuse):
-
3 Arten
Glischropus
bucephalus Csorba, 2011 (Indochinesische Dickdaumenfledermaus/Indochinese Thick-thumbed Bat):
- Bestand: Nicht bewertet
Glischropus
javanus Chasen, 1939 (Java-Dickdaumenfledermaus/Javan Thick-thumbed Bat):
- Bestand: Daten defizitär
Glischropus
tylopus Dobson, 1875 (Gemeine Dickdaumenfledermaus/Common Thick-thumbed
Bat):
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Vespertilionini
> Pipistrellus
Genus
Pipistrellus
Kaup, 1829 (Gattung
Eigentliche Zwergfledermäuse):
-
37 Arten
Pipistrellus
adamsi Kitchener, Caputi & Jones, 1986 (Cape-York-Zwergfledermaus/Cape
York Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus aero Heller, 1912 (Luftige Zwergfledermaus/Mount Gargues Pipistrelle):
- Alternative Bezeichnung: Mount-Gargues-Zwergfledermaus
- Bestand: Daten defizitär
Pipistrellus
angulatus Peters, 1880 (Neuguinea-Zwergfledermaus/Angulate
Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus babu Thomas, 1915 (Babu-Zwergfledermaus/Babu Pipistrelle):
- Bestand: Nicht bewertet
Pipistrellus ceylonicus (Kelaart, 1852) (Kelaart-Zwergfledermaus/Kelaart’s Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus
collinus Thomas, 1910 (Große Papua-Zwergfledermaus/Greater Papuan Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus coromandra (Gray, 1838) (Koromandel-Zwergfledermaus/Coromandel
Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus grandidieri (Dobson, 1876) (Gelbe Zwergfledermaus/Grandidier’s
Pipistrelle):
- Bestand: Daten defizitär
Pipistrellus inexspectatus
Aellen, 1959 (Unerwartete
Zwergfledermaus/Aellen’s Pipistrelle):
- Alternative Bezeichnung: Aellen-Zwergfledermaus
- Bestand: Daten defizitär
Pipistrellus mimus Wroughton, 1899 (Kleine Indische Zwergfledermaus/Indian Pygmy Pipistrelle):
- Bestand: Nicht bewertet
Pipistrellus minahassae (A. Meyer, 1899) (Minahassa-Zwergfledermaus/Minahassa Pipistrelle):
- Bestand: Daten defizitär
Pipistrellus
murrayi Andrews, 1900 (Murray-Zwergfledermaus/Christmas
Island Pipistrelle):
- Bestand: vom Aussterben bedroht
Pipistrellus
nanulus Thomas, 1904 (Kleine Zwergfledermaus/Tiny Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus
papuanus Peters & Doria, 1881 (Kleine Papua-Zwergfledermaus/Lesser Papuan Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus
peguensis Sinha, 1969 (Pegu-Zwergfledermaus/Pegu Pipistrelle):
- Bestand: Daten defizitär
Pipistrellus
permixtus Aellen, 1957 (Verwechselte Zwergfledermaus/Dar-es-Salaam Pipistrelle):
- Alternative Bezeichnung: Daressalam-Zwergfledermaus)
- Bestand: Daten defizitär
Pipistrellus
rusticus (Tomes, 1861) (Rustikale Zwergfledermaus/Rustic
Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus stenopterus (Dobson, 1875) (Schmalflügel-Zwergfledermaus/Narrow-winged Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus
sturdeei Thomas, 1915 (Sturdee-Zwergfledermaus/Bonin Pipistrelle):
- Bestand: Daten defizitär
Pipistrellus
tenuis (Temminck, 1840) (Timor-Zwergfledermaus/Timor
Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus
wattsi Kitchener, 1986 (Watts-Zwergfledermaus/Watts’
Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus
westralis Koopman, 1973 (Koopman-Zwergfledermaus/Koopman’s Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus
abramus Temminck, 1840 (Japanische Zwergfledermaus/Japanese
Pipistrelle):
- Bestand: Nicht gefährdet.
- Literatur: Lin, Lee & Cheng (1997).
Pipistrellus endoi Imaizumi, 1959 (Endo-Zwergfledermaus/Endo’s Pipistrelle):
- Bestand: Stark gefährdet
Pipistrellus
javanicus (Gray, 1838) (Java-Zwergfledermaus/Javan Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus paterculus Thomas, 1915 (Mount-Popa-Zwergfledermaus/Paternal Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus
raceyi Bates et al., 2006 (Racey-Zwergfledermaus/Racey’s Pipistrelle):
- Bestand: Daten defizitär
Pipistrellus rueppellii (J. Fischer, 1829) (Rüppell-Zwergfledermaus/Rüppell’s Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus
nathusii (Keyserling & Blasius, 1839) (Rauhautfledermaus/Nathusius’ Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus pipistrellus (Schreber, 1774) (Gemeine Zwergfledermaus/Common Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus
hanaki Hulva & Benda, 2004 (Hanák-Zwergfledermaus/Hanák’s Pipistrelle):
- Bestand: Daten defizitär
Pipistrellus
pygmaeus (Leach, 1825) (Mückenfledermaus/Soprano
Pipistrelle):
- Bestand: Nicht gefährdet
Pipistrellus hesperidus (Temminck, 1840) (Abendstern-Zwergfledermaus/Dusk Pipistrelle):
- Bestand: Nicht gefährdet
- Verbreitung: Afrika (Kapverden; Liberia; Nigeria; Kamerun; Äquatorial-Guinea; DR Kongo; Äthiopien; Eritrea; Kenia; Tansania; Uganda; Ruanda; Burundi; Malawi; Sambia; Simbabwe; Südafrika; Mosambik; Madagaskar)
Pipistrellus
lepidus Blyth, 1845 (Östliche Weißrandfledermaus/Pale White-boarded
Pipistrelle):
- Bestand: Nicht bewertet
Pipistrellus maderensis (Dobson, 1878) (Madeira-Weißrandfledermaus/Madeira
Pipistrelle):
- Bestand: Stark gefährdet
- Verbreitung: Afrika (Portugal: Madeira; Spanien: Kanarische Inseln)
Pipistrellus
deserti Thomas, 1902 (Wüsten-Weißrandfledermaus/Desert Pipistrelle):
- Alternative Bezeichung: Wüsten-Zwergfledermaus
- Bestand: Nicht gefährdet
Pipistrellus
kuhlii (Kuhl, 1817) (Westliche Weißrandfledermaus/Kuhl’s White-boarded Pipistrelle):
- Bestand: Nicht gefährdet
Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Vespertilioninae
> Vespertilionini
> Scotozous
|
Scotozous |
|
|
|
|
Genus Scotozous Dobson,
1875 (Gattung Dormer-Zwergfledermäuse/Dormer’s Bats):
-
1
Art.
Scotozous dormeri Dobson, 1875 (Dormer-Zwergfledermaus/Dormer’s Bat):
- Bestand: Nicht gefährdet; Populationsentwicklung stabil.
- Verbreitung: Asien (Bangladesch; Indien; Pakistan).
-
Literatur: Moratelli et
al. (2019, 2020); Choudhury (2016);
Roberts (1977); Srinivasulu & Srinivasulu (2019).
Laurasiatheria > Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Myotinae
Subfamilia
Myotinae Tate, 1942 (Unterfamilie Mausohrfledermäuse):
-
134 Arten.
-
Taxonomie: Von Tate
ursprünglich als Tribus Myotini innerhalb der Vespertilioninae eingeführt, erhob Simmons
(1998) den Zweig der Mausohren aufgrund der Ergebnisse karyologischer Analysen von Volleth & Heller
(1994) später in den Rang einer Unterfamilie.
-
Literatur: Simmons
(1998); Tate (1942);
Volleth & Heller (1994).
Genus Myotis Kaup,
1829 (Gattung Mausohren):
-
134 Arten
Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Myotinae > Myotis
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
Myotis |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Genus Myotis Kaup,
1829 (Gattung Mausohren):
-
134 Arten.
Myotis latirostris
Kishida, 1932 (Breitmaul-Bartfledermaus/Broad-muzzled
Whiskered Bat):
- Bestand: Nicht bewertet.
- Literatur: Lin, Lee & Cheng (1997).
Myotis
peninsularis Miller, 1898 (Niederkalifornisches Mausohr/Peninsular Myotis):
- Bestand: Stark gefährdet.
Myotis auriculus R. H. Baker & Stains, 1955 (Mexikanisches Mausohr/Southwestern Myotis):
- Taxonomie: Zunächst als Unterart Myotis evotis auriculus beschrieben.
- Unterarten: Südwestliches Mausohr (M. auriculus auriculus R. H. Baker & Stains, 1955), Apachen-Mausohr (M. auriculus apache Hoffmeister & Krutzsch, 1955).
- Bestand: Nicht gefährdet.
- Verbreitung : Nordamerika (Vereinigte Staaten: Arizona, Neumexiko; Mexiko: Jalisco, Veracruz; Guatemala).
- Literatur: Arroyo-Cabrales et al. (2017); Moratelli et al. (2019, 2020).
Myotis
septentrionalis (Trouessart, 1897) (Nordamerikanisches
Mausohr/Northern Myotis):
- Terra typica: Halifax in Neuschottland, Kanada.
- Taxonomie: Von Trouessart zunächst als Vespertilio gryphus var. septentrionalis beschrieben, ordneten Miller & Allen (1928) die Form als Unterart von Myotis keenii ein. Van Zyll de Jong (1979) bezeichnete sie schließlich als eigenständige Art Myotis septentrionalis. Die Art gilt als monotypisch.
- Bestand: Potenziell gefährdet (Vorwarnliste).
- Verbreitung: Nordamerika (Kanada: Alberta, Britisch-Kolumbien, Labrador, Manitoba, Neubraunschweig, Neufundland, Nordwest-Territorien, Neuschottland, Ontario, Prinz-Edward-Insel, Québec, Sakatchewan); Vereinigte Staaten: Alabama, Arkansas, Connecticut, Delaware, Distrikt von Columbia, Florida, Georgia, Idaho, Illinois, Kansas, Kentucky, Maine, Maryland, Massachusetts, Michigan, Minnesota, Mississippi, Missouri, Montana, Nebraska, Nevada, Neuhampshire, Neujersey, Neuyork, Norddakota, Ohio, Oklahoma, Pennsylvanien, Rode Island, Südkarolina, Süddakota, Tennessee, Vermont, Virginia, Westvirginia, Wisconsin).
-
Literatur: Caceres & Barclay (2000); Miller & Allen (1928);
Moratelli et al. (2019, 2020);
Solari (2018); Trouessart (1897); Van Zyll de Jong (1979).
Myotis leibii (Audubon & Bachman, 1842) (Östliches Kleinfuß-Mausohr/Eastern Small-footed Myotis):
- Taxonomie: Einst als Vespertilio leibii beschrieben, später aber in die Gattung Myotis überführt. Die Taxa ciliolabrum und melanorhinus wurden zeitweise als Unterarten betrachtet. Eletrophoretische Daten unterstützen jedoch eine Trennung von ciliolabrum und leibii.
- Bestand: Stark gefährdet.
- Verbreitung: Nordamerika (Kanada: Ontario, Québec; Vereinigte Staaten: Alabama, Arizona, Connecticut, Delaware, Georgia, Kentucky, Maine, Maryland, Massachusetts, Missouri, Neuhampshire, Neujersey, Neuyork, Nordkarolina, Ohio, Oklahoma, Pennsylvania, Südkarolina, Tennessee, Vermont, Virginia, Westvirginia).
- Literatur: Herd (1987); Moratelli et al. (2019, 2020); Solari (2018).
Myotis
californicus (Audubon & Bachman, 1842) (Kalifornisches
Mausohr/California Myotis):
-
Unterarten: Gewöhnliches Kalifornien-Mausohr (M.
californicus californicus
(Audubon & Bachman,
1842)), Nördliches Kalifornien-Mausohr
(M. californicus
caurinus G.
S. Miller, 1897), Mexikanisches Kalifornien-Mausohr (M.
californicus mexicanus Saussure, 1860), Stephen-Kalifornien-Mausohr (M. californicus stephensi Dalquest, 1946).
- Bestand: Nicht gefährdet.
- Literatur: Arroyo-Cabrales & Perez (2017); Moratelli et al. (2019, 2020).
Myotis ciliolabrum (Merriam, 1886) (Westliches Kleinfuß-Mausohr/Western Small-footed
Myotis):
- Taxonomie: Zunächst als Vespertilio ciliolabrum beschrieben, wurde die Form zeitweise auch in Myotis leibii eingegliedert. Van Zyll de Jong (1984) führte sie schließlich als Myotis ciliolabrum. Eletrophoretische Daten unterstützen eine Separarierung von ciliolabrum und leibii.
- Bestand: Nicht gefährdet.
- Verbreitung: Nordamerika (Kanada: Alberta, Britisch-Kolumbien, Saskatchewan; Vereinigte Staaten: Arizona, Kalifornien, Colorado, Idaho, Kansas, Montana, Nebraska, Nevada, Neumexiko, Norddakota, Oklahoma, Oregon, Süddakota, Texas, Utah, Washington, Wyoming; Mexiko).
-
Literatur: Arroyo-Cabrales & Álvarez-Castañeda (2017);
Herd (1987); Holloway &
Barclay (2001); Moratelli et al. (2019, 2020);
Van Zyll
de Jong (1984).
Myotis
melanorhinus (Merriam, 1886) (Dunkelnasen-Kleinfuß-Mausohr/Dark-nosed Small-footed Myotis):
- Taxonomie: Ursprünglich als Vespertilio melanorhinus beschrieben. Morphometrische Analysen stützen den Artstatus, aber in der Vergangenheit war melanorhinus auch als Unterart von Myotis leibii oder M. ciliolabrum (Holloway & Barclay, 2001; Van Zyll de Jong, 1984) geführt worden.
- Bestand: Nicht gefährdet.
- Verbreitung : Nordamerika (Kanada; Vereinigte Staaten; Mexiko).
-
Literatur: Arroyo-Cabrales & Álvarez-Castañeda (2017);
Holloway
& Barclay (2001);
Moratelli et al. (2019, 2020);
Van Zyll de Jong (1984).
Myotis sodalis Miller & Allen, 1928 (Indiana-Mausohr/Indiana
Myotis):
- Bestand: Stark gefährdet.
Myotis volans (H. Allen, 1866) (Langbeiniges
Mausohr/Long-legged Myotis):
- Bestand: Nicht gefährdet.
Myotis occultus Hollister, 1909 (Arizona-Mausohr/Arizona
Myotis):
- Bestand: Nicht gefährdet
Myotis
lucifugus (Le Conte, 1831) (Kleines Braunes Mausohr/Little Brown Myotis):
-
Unterarten: Braunes
Georgia-Mausohr (M.
lucifugus lucifugus (Le Conte,
1831)), Braunes Alaska-Mausohr (M. lucifugus
alascensis G.
S. Miller, 1897), Braunes Montana-Mausohr (M. lucifugus
carissimus Thomas,
1904), Braunes Alberta-Mausohr
(M. lucifugus pernox
Hollister, 1911), Braunes Inyo-Mausohr (M. lucifugus relictus
A. H. Harris, 1974).
- Bestand: Stark gefährdet.
- Literatur: McMurtrie (1831); Moratelli et al. (2019, 2020); Solari (2018).
Myotis thysanodes Miller, 1897 (Nordamerikanische Fransenfledermaus/Fringed
Myotis):
- Unterarten: Tehachapi-Fransenfledermaus (M. thysanodes thysanodes Miller, 1897), Azteken-Fransenfledermaus (M. thysanodes aztecus G. S. Miller & G. M. Allen, 1928), Wyoming-Fransenfledermaus (M. thysanodes pahasapensis J. K. Jones & Genoways, 1967), Abend-Fransenfledermaus (M. thysanodes vespertinus Manning & J. K. Jones, 1988).
- Bestand: Nicht gefährdet
-
Literatur: Arroyo-Cabrales & de Grammont (2017);
Moratelli et al. (2019, 2020).
Myotis evotis (H. Allen, 1864) (Langohriges Mausohr/Long-eared Myotis):
-
Unterarten: Westliches Langohr-Mausohr (M. evotis evotis (H. Allen, 1864)), Nördliches
Langohr-Mausohr (M.
evotis chrysonotus J.
A. Allen, 1896), Kaibab-Langohr-Mausohr (M.
evotis jonesorum Manning, 1993), Mexikanisches
Langohr-Mausohr (M.
evotis micronyx Nelson & Goldman, 1909), Miller-Langohr-Mausohr (M. evotis milleri Elliot,
1903), Pazifisches Langohr-Mausohr
(M. evotis pacificus Dalquest, 1943).
- Bestand: Nicht gefährdet.
-
Literatur: Arroyo-Cabrales & Álvarez-Castañeda (2017);
Moratelli et al. (2019, 2020).
Myotis keenii (Merriam, 1895) (Keen-Mausohr/Keen’s Myotis):
- Bestand: Nicht gefährdet.
-
Literatur: Arroyo-Cabrales & Álvarez-Castañeda (2017);
Moratelli et al. (2019, 2020).
Myotis brandtii (Eversmann, 1845) (Brandtfledermaus/Brandt’s
Myotis):
- Bestand: Nicht gefährdet
- Verbreitung: Eurasien.
- Literatur: Schmidt (2007).
Myotis
gracilis Ognev, 1927 (Ussuri-Fledermaus/Ussuri Myotis):
- Bestand: Nicht gefährdet
Myotis cobanensis Goodwin, 1955 (Guatemala-Mausohr/Guatemalan Myotis):
- Bestand: Daten defizitär
Myotis findleyi Bogan, 1978 (Findley-Mausohr/Findley’s
Myotis):
- Bestand: Stark gefährdet
Myotis fortidens Miller
& Allen, 1928 (Zimtbraunes Mausohr/Cinnamon
Myotis):
- Bestand: Nicht gefährdet
Myotis planiceps
Baker, 1955 (Flachköpfiges Mausohr/Flat-headed Myotis):
- Bestand: Stark gefährdet
Myotis keaysi J. A. Allen, 1914 (Haarfüßiges Mausohr/Hairy-legged Myotis):
- Bestand: Nicht gefährdet
Myotis ruber (E. Geoffroy, 1806) (Rotes Mausohr/Red
Myotis):
- Bestand: Potenziell gefährdet (Vorwarnliste)
Myotis riparius Handley, 1960 (Ufermausohr/Riperian Myotis):
- Bestand: Nicht gefährdet
Myotis elegans Hall, 1962 (Geziertes Mausohr/Elegant Myotis):
- Bestand: Nicht gefährdet
Myotis simus
Thomas, 1901 (Samtiges Mausohr/Velvety Myotis):
- Bestand: Daten defizitär
Myotis vivesi Menegaux, 1901 (Fischfressendes Mausohr/Fish-eating Myotis):
- Bestand: Gefährdet
Myotis aelleni Baud, 1979 (Argentinisches
Mausohr/Argentina Myotis):
- Bestand: Daten defizitär
Myotis chiloensis (Waterhouse, 1840) (Chilenisches Mausohr/Chilean Myotis):
- Bestand: Nicht gefährdet
Myotis albescens (E.
Geoffroy, 1806) (Silberspitzen-Mausohr/Silver-tipped Myotis):
- Bestand: Nicht gefährdet
Myotis diminutus Moratelli & Wilson, 2011 (Winziges Mausohr/Diminutive Myotis):
- Bestand: Vom Aussterben bedroht
Myotis oxyotus (Peters,
1867) (Gebirgsmausohr/Montane Myotis):
- Bestand: Nicht gefährdet
Myotis izecksohni Moratelli, Peracchi, Dias & de Oliveira, 2011 (Izecksohn-Mausohr/Izecksohn’s Myotis):
- Bestand: Vom Aussterben bedroht
Myotis lavali Moratelli, Peracchi, Dias & de Oliveira, 2011 (Laval-Mausohr/Laval’s
Myotis):
- Bestand: Vom Aussterben bedroht
Myotis dinellii Thomas, 1902 (Dinnell-Mausohr/Dinnell’s Myotis):
- Bestand: Nicht gefährdet
Myotis levis
(I. Geoffroy, 1824) (Gelbliches Mausohr/Yellowish Myotis):
- Bestand: Nicht gefährdet
Myotis nigricans (Schinz, 1821) (Schwarzes Mausohr/Black Myotis):
- Bestand: Nicht gefährdet
Myotis
austroriparius (Rhoads, 1897) (Südöstliches Mausohr/Southeastern Myotis):
- Bestand: Nicht gefährdet
Myotis grisescens A. H. Howell, 1909 (Graues Mausohr/Grey Myotis):
- Bestand: Potenziell gefährdet (Vorwarnliste)
Myotis velifer (J.
A. Allen, 1890) (Höhlenmausohr/Cave Myotis):
- Bestand: Nicht gefährdet
Myotis yumanensis (H. Allen, 1864) (Yuma-Mausohr/Yuma Myotis):
- Bestand: Nicht gefährdet
Myotis
dominicensis Miller, 1902 (Dominika-Mausohr/Dominican Myotis):
- Bestand: Gefährdet
Myotis
martiniquensis LaVal, 1973 (Martinique-Mausohr/Schwartz’s Myotis):
- Bestand: Gefährdet
Myotis nyctor LaVal & Schwartz, 1975 (Barbados-Mausohr/Barbuda Islands
Myotis):
- Bestand: Gefährdet
Myotis sp. 3 [Larsen et al.,
2012] (Suriname-Mausohr/Suriname Myotis):
- Bestand: Nicht bewertet
Myotis atacamensis (Lataste, 1892) (Atacama-Mausohr/Atacaman Myotis):
- Bestand: Potenziell gefährdet (Vorwarnliste)
Myotis sp. 1 [Larsen et al., 2012] (Tobago-Mausohr/Tobago Myotis):
- Bestand: Nicht bewertet
Myotis sp. 2 [Larsen et al., 2012] (Venezuela-Mausohr/Venezuelan
Myotis):
- Bestand: Nicht bewertet
Myotis larensis LaVal, 1973 (Lara-Mausohr/Lara Myotis):
- Bestand: Nicht bewertet
Myotis nesopolus Miller, 1900 (Curaçao-Mausohr/Curaçao
Myotis):
- Bestand: Nicht gefährdet
Myotis tricolor (Temminck, 1832) (Dreifarb-Mausohr/Temminck’s Myotis):
- Bestand: Nicht gefährdet
Myotis flavus Shamel, 1944 (Chinesische Gelbfledermaus/Chinese Yellow Bat):
- Bestand: Nicht bewertet
Myotis emarginatus (E. Geoffroy, 1806) (Wimperfledermaus/Geoffroy’s Bat):
- Bestand: Nicht gefährdet
- Verbreitung: Eurasien, Nordafrika
Myotis scotti Thomas, 1927 (Scott-Mausohr/Scott’s
Myotis):
- Bestand: Gefährdet
Myotis
anjouanensis Dorst, 1960 (Anjouan-Mausohr/Anjouan
Myotis):
- Bestand: Daten defizitär
Myotis goudoti (A. Smith, 1834) (Madagaskar-Mausohr/Malagasy Myotis):
- Bestand: Nicht gefährdet
Myotis bocagii (Peters, 1870) (Östliches Kupferfarbenes
Mausohr/Eastern Rufous Myotis):
- Bestand: Nicht gefährdet
Myotis cupreolus Thomas, 1904 (Westliches Kupferfarbenes Mausohr/Western Rufous Myotis):
- Bestand: Nicht bewertet
Myotis bartelsi Jentink, 1910 (Bartelfledermaus/Bartel’s
Bat):
- Bestand: Nicht bewertet
- Verbreitung: Asien (Indonesien: Java, Bali)
Myotis formosus (Hodgson, 1835) (Hodgsonfledermaus/Hodgon’s
Bat):
- Bestand: Nicht gefährdet
- Verbreitung: Asien (Afghanistan; Indien; Nepal; China; Taiwan; Vietnam).
- Literatur: Lin, Lee & Cheng (1997).
Myotis hermani Thomas, 1923 (Hermanfledermaus/Herman’s Bat):
- Bestand: Daten defizitär
- Verbreitung: Asien (Indonesien; Thailand; Malaysia)
Myotis rufopictus (Waterhouse, 1845) (Orangefinger-Fledermaus/Orange-fingered Myotis):
- Bestand: Daten defizitär
- Verbreitung: Asien (Indonesien: Sulawesi)
Myotis weberi (Jentink, 1890) (Weber-Fledermaus/Weber`s
Myotis):
- Bestand: Nicht bewertet
Myotis rufoniger (Tomes, 1858) (Shanghai-Fledermaus/Shanghai Myotis):
- Bestand: Nicht bewertet
- Verbreitung: Asien (Nordkorea; Südkorea; Japan; China; Taiwan)
Myotis welwitschii (Gray, 1866) (Welwitsch-Mausohr/Welwitch’s Myotis):
- Bestand: Nicht gefährdet
Myotis alcathoe von Helversen & Heller, 2001 (Nymphenfledermaus/Alcathoe Whiskered Bat):
- Bestand: Daten defizitär
- Verbreitung: Eurasien
- Literatur: Wimmer (2021).
Myotis dasycneme (Boie,
1825) (Teichfledermaus/Pond Myotis):
- Bestand: Potenziell gefährdet (Vorwarnliste)
- Verbreitung: Eurasien
Myotis morrisi Hill, 1971 (Morris-Mausohr/Morris’
Myotis):
- Bestand: Daten defizitär
Myotis hajastanicus Argyropulo, 1939 (Armenische Bartfledermaus/Armenian Whiskered Bat):
- Bestand: Vom Aussterben bedroht
- Verbreitung: Asien
Myotis nipalensis (Dobson,
1871) (Nepalesische
Bartfledermaus/Nepal Whiskered Bat):
- Bestand: Nicht gefährdet
- Verbreitung: Asien
Myotis oreias (Temminck, 1840) (Singapur-Bartfledermaus/Singapore
Whiskered Bat):
- Bestand: Daten defizitär
Myotis altarium Thomas, 1911 (Sichuan-Bartfledermaus/Szechwan Myotis):
- Bestand: Nicht gefährdet
Myotis ikonnikovi Ognev, 1912 (Kurzohr-Bartfledermaus/Ikonnikov’s Bat):
- Bestand: Nicht gefährdet
Myotis aurascens Kuzyakin, 1935
(Steppen-Bartfledermaus/Steppe Whiskered Bat):
- Bestand: Nicht gefährdet
- Verbreitung: Eurasien
Myotis mystacinus (Kuhl,
1817) (Kleine
Bartfledermaus/European Whiskered Bat):
- Unterarten: Europäische Bartfledermaus (M. mystacinus mystacinus), Balkan-Bartfledermaus (M. mystacinus bulgaricus), Iberische Bartfledermaus (M. mystacinus occidentalis)
- Bestand: Nicht gefährdet
- Verbreitung: Eurasien, Nordafrika.
- Literatur: Ogneff & Heptner (1928).
Myotis ater (Peters, 1866) (Schwarze Bartfledermaus/Peters’ Whiskered
Bat):
- Bestand: Nicht gefährdet
Myotis
australis (Dobson, 1878) (Australische Bartfledermaus/Small-footed Whiskered Bat):
- Bestand: Daten defizitär
Myotis
gomantongensis Francis & Hill, 1998 (Gomantong-Bartfledermaus/Gomantong Whiskered Bat):
- Bestand: Nicht gefährdet
Myotis muricola (Gray, 1846) (Südasiatische Bartfledermaus/Wall-roosting Whiskered Bat):
- Bestand: Nicht gefährdet
Myotis annectans (Dobson, 1871) (Mittlere Bartfledermaus/Intermediate Whiskered Bat):
- Bestand: Nicht gefährdet
Myotis montivagus (Dobson, 1874) (Burmesische Bartfledermaus/Burmese Whiskered Bat):
- Bestand: Nicht gefährdet
Myotis pruinosus Yoshiyuki, 1971 (Honshu-Bartfledermaus/Blackish
Whiskered Bat):
- Bestand: Stark gefährdet
Myotis secundus Ruedi, Csorba, Lin & Chou, 2015 (Taoyuan-Bartfledermaus/Taoyuan Whiskered Bat):
- Bestand: Nicht bewertet
Myotis yanbarensis Maeda & Matsumara, 1998 (Yanbaru-Bartfledermaus/Yanbaru
Whiskered Bat):
-
Holotypus/Terra
typica: NSMT-M31306 (Nationales Wissenschaftsmuseum
Tokio), erwachsenes Männchen (Haut und Schädel), gesammelt am 12. Oktober 1996
in einem Wald am Oberlauf des Funga-Flusses, Aha, Kunigami-mura, Okinawa, Japan.
-
Etymologie:
Die Art wurde nach dem Gebiet (Yanbaru/Yambaru) im Norden der Okinawa-Hauptinsel benannt, wo sie
entdeckt wurde.
-
Bestand: Vom
Aussterben bedroht.
-
Literatur: Asari, Kimoto &
Noda (2021); Maeda & Matsumara (1998); Preble, Vincenot
& Ohte (2020).
Myotis dieteri Happold, 2005 (Kock-Mausohr/Kock’s Myotis):
- Bestand: Daten defizitär
Myotis ridleyi Thomas, 1898 (Ridley-Langfußfledermaus/Ridley’s Myotis):
- Bestand: Potenziell gefährdet (Vorwarnliste)
Myotis rosseti (Oey, 1951) (Dickdäumige Langfußfledermaus/Thick-thumbed Myotis):
- Bestand: Nicht gefährdet
Myotis browni Taylor, 1934 Brown-Langfußfledermaus/Brown’s Myotis):
- Bestand: Nicht bewertet
Myotis horsfieldii (Temminck, 1840) (Horsfield-Langfußfledermaus/Horsfield’s Myotis):
- Bestand: Nicht gefährdet
Myotis hasseltii (Temminck, 1840) (Kleine Langfußfledermaus/Lesser Large-footed
Myotis):
- Bestand: Potenziell gefährdet (Vorwarnliste)
Myotis macropus (Gould, 1854) (Südliche
Langfußfledermaus/Southern Large-footed Myotis):
- Bestand: Nicht gefährdet
Myotis macrotarsus (Waterhouse, 1845) (Blasse Langfußfledermaus/Pallid Large-footed Myotis):
- Bestand: Potenziell gefährdet (Vorwarnliste)
Myotis stalkeri Thomas, 1910 (Stalker-Langfußfledermaus/Stalker’s Large-footed Myotis):
- Bestand: Daten defizitär
Myotis capaccinii (Bonaparte, 1837) (Mittelmeer-Langfußfledermaus/Capaccinii’s Myotis):
- Bestand: Gefährdet
- Verbreitung: Eurasien, Nordafrika
Myotis csorbai Topal, 1997 (Csorba-Langfußfledermaus/Csorba’s Myotis):
- Bestand: Daten defizitär
Myotis laniger Peters, 1871 (Chinesische Wasserfledermaus/Chinese Water Myotis):
- Bestand: Nicht gefährdet
Myotis annamiticus Kurskop & Tsytsulina, 2001 (Annam-Langfußfledermaus/Annamit Myotis):
- Bestand: Daten defizitär
Myotis longipes (Dobson, 1873) (Kaschmir-Langfußfledermaus/Kashmir Myotis):
- Bestand: Daten defizitär
Myotis phanluongi Borisenko, Kruskop & Ivanova,
2008 (Vietnamesische Langfußfledermaus/Phan
Luong’s Myotis):
- Bestand: Nicht bewertet
Myotis davidii Kurskop & Tsytsulina, 2001 (David-Langfußfledermaus/David’s
Myotis):
- Bestand: Nicht gefährdet
Myotis
darjilingensis (Horsfield, 1855) (Bengalen-Langfußfledermaus/Darjeelling Myotis):
- Bestand: Nicht bewertet
Myotis
siligorensis (Horsfield, 1855) (Himalaya-Langfußfledermaus/Small-toothed Myotis):
- Bestand: Nicht gefährdet.
Myotis sicarius Thomas, 1915 (Mandelli-Wasserfledermaus/Mandelli’s Myotis):
- Bestand: Gefährdet.
Myotis bechsteinii (Kuhl, 1817) (Bechsteinfledermaus/Bechstein’s Myotis):
- Bestand: Potenziell gefährdet (Vorwarnliste).
- Verbreitung: Eurasien.
Myotis daubentonii (Kuhl, 1817) (Europäische Wasserfledermaus/Western Daubenton’s
Myotis):
- Bestand: Nicht gefährdet.
- Verbreitung: Eurasien.
Myotis nathalinae Tupinier, 1977 (Iberische
Wasserfledermaus/Nathaline Myotis):
- Bestand: Nicht bewertet.
- Verbreitung: Europa.
Myotis bucharensis Kuzyakin, 1950 (Buchara-Wasserfledermaus/Bokhara Myotis):
- Alternative Bezeichung: Buchara-Mausohr.
- Bestand: Daten defizitär.
Myotis frater G. M. Allen, 1923 (Korea-Wasserfledermaus/Fraternal Myotis):
- Bestand: Daten defizitär.
Myotis longicaudatus Ognev, 1927 (Langschwanz-Wasserfledermaus/Long-tailed
Myotis):
- Alternative Bezeichnung: Langschwanz-Mausohr.
- Unterarten: Amur-Wasserfledermaus (M. longicaudatus longicaudatus Ognev, 1927), Altai-Wasserfledermaus (M. longicaudatus eniseensis Tsytsulina & Strelkov, 2001), Aomori-Wasserfledermaus (M. longicaudatus kaguyae Imaizumi, 1956).
- Bestand: Daten defizitär.
Myotis soror Ruedi, Csorba, Lin & Chou, 2015 (Rote Taiwan-Wasserfledermaus/Reddish Myotis):
- Alternative Bezeichnung: Rotes Taiwan-Mausohr.
- Bestand: Daten defizitär.
Myotis macrodactylus (Temminck, 1840) (Ostasiatische Wasserfledermaus/Eastern Big-footed Myotis):
-
Unterarten: Japanische Wasserfledermaus (M. macrodactylus macrodactylus (Temminck,
1840)), Festland-Wasserfledermaus (M. macrodactylus continentalis Tiunov, 1997), Sachalin-Wasserfledermaus (M. macrodactylus insularis
Tiunov,
1997).
- Bestand: Nicht gefährdet.
Myotis petax Hollister, 1912 (Sibirische Wasserfledermaus/Eastern Daubenton’s
Myotis):
- Unterarten: Westsibirische Wasserfledermaus (M. petax petax Hollister, 1912), Ostsibirische Wasserfledermaus (M. petax loukashkini Shamel, 1942), Ussuri-Wasserfledermaus (M. petax ussuriensis Ognev, 1927).
- Bestand: Nicht bewertet.
Myotis fimbriatus
Peters, 1871 (Haarige Wasserfledermaus/Fringed Big-footed Myotis):
- Bestand: Nicht gefährdet.
Myotis taiwanensis Ärnbäck-Christie-Linde, 1908 (Haarige Taiwan-Wasserfledermaus/Formosan Big-footed Myotis):
- Bestand: Nicht bewertet.
- Literatur: Lin, Lee & Cheng (1997).
Myotis adversus (Horsfield, 1824) (Südasiatische
Wasserfledermaus/Southern Big-footed Myotis):
- Bestand: Nicht gefährdet
Myotis insularum
(Dobson, 1878) (Samoa-Wasserfledermaus/Insular Big-footed
Myotis):
- Bestand: Daten defizitär
Myotis moluccarum
Thomas, 1915 (Molukken-Wasserfledermaus/Moluccan
Big-footed Myotis):
- Bestand: Nicht gefährdet
Myotis pilosus (Peters, 1869) (Rickett-Wasserfledermaus/Rickett’s
Big-footed Myotis):
- Bestand: Potenziell gefährdet (Vorwarnliste).
Myotis pequinius
Thomas, 1908 (Peking-Mausohr/Pekin
Myotis):
- Bestand: Nicht gefährdet.
- Verbreitung: Asien (China).
- Literatur: Feng & Jiang (2019); Findley (1972); Jiang et al. (2015); Jones et al. (2006); Moratelli et al. (2019, 2020); Smith & Xie (2008, 2013).
Subgenus Isotus Kaup,
1829 (Untergattung
Fransenfledermäuse):
-
11 Arten.
Myotis escalerai Cabrera, 1904 (Iberische Fransenfledermaus/Escalera’s Myotis):
- Taxonomie: Von Cabrera aufgrund morphologischer Daten als eigene Art beschrieben, später aber häufig mit M. nattereri synonymisiert. Genetische Daten stützen aber den Rang als separate Art.
- Bestand: Nicht gefährdet.
- Verbreitung: Europa (Portugal; Spanien; Frankreich).
- Literatur: Cabrera (1904); Ibáñez et al. (2006); Ibáñez & Juste (2017); Juste et al. (2019); Moratelli et al. (2019, 2020); Salicini et al. (2011, 2013); Smirnov et al. (2020); Uvizl & Benda (2021).
Myotis zenatius Ibáñez, Juste, Salicini, Puechmaille & Ruedi, 2019 (Zenati-Fransenfledermaus/Zenati Myotis):
- Alternative Bezeichnung: Zenati-Mausohr.
- Taxonomie: Exemplare der Art wurden früher zu M. nattereri gezählt. Genetische und morphologische Untersuchungen stützen aber den Rang einer eigenständigen Art.
- Bestand: Nicht bewertet.
- Verbreitung: Afrika (Marokko; Algerien; möglicherweise auch Tunesien).
- Literatur: Juste et al. (2019); Moratelli et al. (2019, 2020); Smirnov et al. (2020); Uvizl & Benda (2021).
Myotis tschuliensis Kuzyakin, 1935 (Kaukasische
Fransenfledermaus/Caucasian Myotis):
- Taxonomie: Zumeist als Unterart von M. nattereri betrachtet. Genetische Untersuchungen von Kruskop & Solovyeva (2021) unterstützen aber den Artstatus.
- Bestand: Nicht bewertet.
- Verbreitung: Asien
- Literatur: Juste et al. (2019); Kruskop & Solovyeva (2021); Moratelli et al. (2019, 2020); Smirnov et al. (2020); Uvizl & Benda (2021).
Myotis hoveli D. L. Harrison, 1964 (Hovel-Fransenfledermaus/Hovel’s
Myotis):
- Bestand: Nicht bewertet.
- Verbreitung: Asien
- Literatur: Moratelli et al. (2019, 2020); Smirnov et al. (2020); Uvizl & Benda (2021).
Myotis schaubi
Kormos, 1934
(Schaub-Fransenfledermaus/Schaub’s Myotis):
- Alterantive Bezeichnung: Schaub-Mausohr.
- Bestand: Daten defizitär.
- Verbreitung: Asien (Iran; Armenien).
- Literatur: Juste et al. (2019); Moratelli et al. (2019, 2020); Piraccini (2016); Smirnov et al. (2020); Uvizl & Benda (2021).
Myotis chinensis (Tomes, 1857) (Chinesisches Mausohr/Chinese Large Myotis):
- Taxonomie: Ursprünglich als Vespertilio chinensis beschrieben und später in die Gattung Myotis überführt.
- Bestand: Nicht gefährdet.
- Verbreitung: Asien (Myanmar; Thailand; Vietnam; China: Yunnan, Anhui, Chongqing, Hongkong; möglicherweise auch Laos).
- Literatur: Bates et al. (1999, 2001); Jiang et al. (2015); Jiang & Feng (2019); Liu, Shi & Wang (2010); Moratelli et al. (2019, 2020); Smirnov et al. (2020); Smith & Xie (2008, 2013); Wang (2003).
Myotis amurensis Ognev, 1927 (Japanische Fransenfledermaus/Japanese Myotis):
- Taxonomie: Meist noch als Unterart oder Synonym von M. bombinus gelistet. Analysen deuten aber auf getrennte genetische Linien zwischen japanischen Populationen und jenes des Kontinents hin (Smirnov et al., 2020), die eine Einstufung der japanischen Tiere als separate Art stützen.
- Bestand: Nicht bewertet; von IUCN als Synonym von M. bombinus eingestuft.
- Verbreitung: Asien (Japan).
-
Literatur: Bobrinskiy, Kuznetsov & Kuzyakin
(1965); Fukui, Sano & Kruskop (2019); Funakoshi (1988); Horáček & Hanák (1984);
Kawai (2015); Kawai et al. (2003);
Kruskop et al. (2012); Moratelli et al. (2019, 2020);
Smirnov et
al. (2020); Smith & Xie
(2013); Yoon (1990).
Myotis bombinus Thomas, 1906 (Östliche Fransenfledermaus/Far Eastern Myotis):
- Taxonomie: Ursprünglich als Unterart Myotis nattereri bombinus beschrieben.
- Bestand: Potenziell gefährdet (Vorwarnliste).
- Verbreitung: Asien (Mongolei; China; Russland; Nordkorea; Südkorea).
-
Literatur: Bobrinskiy, Kuznetsov & Kuzyakin
(1965); Fukui, Sano & Kruskop (2019); Funakoshi (1988); Horáček & Hanák (1984);
Kawai (2015); Kawai et al. (2003);
Kruskop et al. (2012); Moratelli et al. (2019, 2020);
Smirnov et
al. (2020); Smith & Xie
(2013); Yoon (1990).
Myotis nattereri (Kuhl,
1817) (Europäische
Fransenfledermaus/Natterer’s Myotis):
- Bestand: Nicht gefährdet
- Verbreitung: Europa (Albanien; Belgien; Bosnien-Herzegowina; Bulgarien; Dänemark; Deutschland; Estland; Finnland; Frankreich; Griechenland; Irland; Kroatien; Lettland; Liechtenstein; Litauen; Luxemburg; Montenegro; Niederland; Nordmazedonien; Norwegen; Österreich; Polen; Rumänien; Russland; Schweden; Schweiz; Serbien; Slowakei; Slowenien; Tschechien; Türkei; Ukraine; Ungarn; Vereinigtes Königreich; Weißrussland).
- Literatur: Gazaryan, Kruskop & Godlevska (2020); Juste et al. (2019); Moratelli et al. (2019, 2020); Smirnov et al. (2020); Uvizl & Benda (2021).
Myotis crypticus Ruedi, Ibáñez, Salicini, Juste & Puechmaille, 2019 (Kryptische Fransenfledermaus/Cryptic Myotis):
- Alternative Bezeichnung: Kryptisches Mausohr.
- Taxonomie: Exemplare der Art wurden früher zu M. nattereri gezählt. Genetische und morphologische Untersuchungen stützen aber den Rang einer eigenständigen Art.
- Bestand: Nicht bewertet.
- Verbreitung : Europa (Spanien; Frankreich; Italien; Österreich).
- Literatur: Juste et al. (2019); Moratelli et al. (2019, 2020); Smirnov et al. (2020); Uvizl & Benda (2021).
Myotis sp. C [Puechmaille et al.,
2012] (Korsische
Fransenfledermaus/Corsican Natterer’s Bat):
- Bestand: Nicht bewertet.
- Literatur: Smirnov et al. (2020).
Subgenus Myotis Kaup,
1829 (Untergattung Eigentliche
Mausohren):
-
6 Arten.
Myotis punicus
Felten, Spitzenberger & Storch, 1977 (Punisches Mausohr/Maghreb
Myotis):
- Taxonomie: Ursprünglich als Unterart Myotis blythii punicus beschrieben. Ruedi & Mayer (2001) konnten mit ihren Untersuchungen aber eine separate Stellung belegen.
- Bestand: Daten defizitär.
- Verbreitung: Europa (Frankreich: Korsika; Italien: Sardinien; Malta), Nordafrika (Marokko; Algerien; Tunesien; Libyen).
- Literatur: Juste & Paunović (2016); Moratelli et al. (2019, 2020); Ruedi & Mayer (2001).
Myotis ancilla Thomas, 1910 (Chinesisches Kleines Mausohr/Chinese Lesser Myotis):
- Bestand: Nicht bewertet
Myotis blythii (Tomes, 1857) (Indisches Kleines Mausohr/Indian Lesser Myotis):
- Bestand: Nicht gefährdet.
- Literatur: Juste & Paunović (2016); Moratelli et al. (2019, 2020); Ruedi & Mayer (2001).
Myotis myotis (Borkhausen, 1797) (Großes
Mausohr/Greater Myotis):
- Unterarten: Gemeines Mausohr (M. myotis myotis (Borkhausen, 1797)), Südliches Mausohr (M. myotis macrocephalicus D. L. Harrsion & Lewis, 1961)
- Bestand: Nicht gefährdet.
- Verbreitung: Eurasien (Albanien; Andorra; Belgien; Bosnien-Herzegowina; Bulgarien; Deutschland; Frankreich; Griechenland; Israel; Italien; Kroatien; Libanon; Liechtenstein; Litauen; Luxemburg; Mazedonien; Malta; Montenegro; Niederlande; Österreich; Polen; Portugal; Rumänien; San Marino; Schweden; Schweiz; Serbien; Slowakei; Slowenien; Spanien; Syrien; Tschechien; Türkei; Ukraine; Ungarn; Vatikan; Weißrussland; Zypern; im Vereinigten Königreich möglicherweise ausgestorben).
- Literatur: Coroiu, Juste & Paunović (2016); Moratelli et al. (2019, 2020).
Myotis omari Thomas, 1906 (Westasiatisches Kleines Mausohr/Omar Lesser Myotis):
- Bestand: Nicht bewertet
Myotis oxygnathus Monticelli, 1885 (Europäisches Kleines Mausohr/Mediterranean
Lesser Myotis):
- Bestand: Nicht gefährdet
- Verbreitung: Eurasien
- Literatur: Juste & Paunović (2016); Moratelli et al. (2019, 2020).
Laurasiatheria > Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Kerivoulinae
Subfamilia Kerivoulinae G. S. Miller, 1907 (Unterfamilie
Wollfledermäuse/Woolly Bats):
-
35 Arten; nominotypische Gattung Kerivoula Gray, 1842; nominotypische Art Kerivoula picta (Pallas, 1767).
-
Literatur: Gray (1842);
Miller (1907); Pallas (1767).
Genus Kerivoula Gray, 1842 (Gattung Eigentliche Wollfledermäuse/Painted Woolly Bats):
-
31 Arten; Generotypus Kerivoula picta (Pallas, 1767).
-
Literatur: Douangboubpha (2014); Douangboubpha et al. (2016); Gray (1842); Khan et al. (2010); Kuo
et al. (2017); Pallas (1767); Tu et al. (2018).
Genus
Phoniscus G. S. Miller, 1905 (Gattung Trompetenohrfledermäuse/Trumpet-eared Bats):
-
4 Arten; Generotypus Phoniscus atrox G. S. Miller,
1905.
-
Literatur: G. S. Miller
(1905).
Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Kerivoulinae > Kerivoula
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Kerivoula |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Genus Kerivoula Gray, 1842 (Gattung Eigentliche Wollfledermäuse/Painted Woolly Bats):
-
31 Arten; Generotypus Kerivoula picta (Pallas, 1767).
-
Literatur: Douangboubpha (2014); Douangboubpha et al. (2016); Gray (1842); Khan et al. (2010); Kuo
et al. (2017); Pallas (1767); Tu et al. (2018).
Kerivoula
picta (Pallas, 1767) (Bunte Wollfledermaus/Painted Woolly Bat):
- Unterarten: Gewöhnliche Bunte Wollfledermaus (K. picta picta (Pallas, 1767)), Chinesische Bunte Wollfeldermaus (K. picta bellissima Thomas, 1906).
- Bestand: Potenziell gefährdet (Vorwarnliste).
- Verbreitung : Asien (Sri Lanka; Indien; Nepal; Bangladesch; Myanmar; Thailand; Malaysia; Indonesien; Laos; Kambodscha; Vietnam; China).
-
Literatur: Funakoshi et al. (2015); Hawkeswood & Sommung (2017); Huang, Lim & Chakravarty
(2020); Kruskop
(2013); Lee et al. (2015); Madhavan, Rajasekar &
Isaac (2014); Moratelli et al. (2019,
2020); Pallas, 1767; Smith & Xie (2008); Sripathi,
Raghuram & Thiruchenthil
Nathan (2006); Thomas,
1906).
Kerivoula
pellucida (Waterhouse, 1845) (Transparentflügel-Wollfledermaus/Clear-winged Woolly Bat):
- Bestand: Potenziell gefährdet (Vorwarnliste).
- Verbreitung: Asien (Philippinen: Cebu, Jolo, Mindanao, Mindoro, Palawan; Indonesien: Kalimantan, Java, Sumatra; Siberut; Brunei; Malaysia; Thailand).
-
Literatur: Bumrungsri et al. (2006); Douangboubpha et al. (2016);
Esselstyn, Widmann & Heaney (2004); Hasan &
Abdullah (2011);
Heaney et al. (1998);
Hill (1965); Khan et al. (2010); Mohd-Azlan, Neuchlos &
Abdullah (2005); Moratelli et al. (2019, 2020); Nor Zalipah
(2020); Sedlock et al. (2020);
Struebig, Galdikas & Suatma (2006); Taylor (1934); Waterhouse (1845).
Kerivoula pusilla Thomas, 1894 (Helle Wollfledermaus Wollfledermaus/Malayan Woolly Bat):
-
Unterarten: Borneo-Wollfledermaus
(K. pusilla pusilla Thomas,
1894); Zweifarbige Wollfledermaus
(K. pusilla
bicolor Thomas, 1904).
- Bestand: Nicht gefährdet; von IUCN als Bestandteil von K. whiteheadi bewertet.
- Verbreitung: Asien (Thailand; Indonesien: Kalimantan; Malaysia: Sabah, Sarawak).
- Literatur: Moratelli et al. (2019, 2020).
Kerivoula
whiteheadi Thomas, 1904 (Whitehead-Wollfledermaus/Whitehead’s Woolly Bat):
- Bestand: Nicht gefährdet.
- Verbreitung : Asien (Philippinen: Bohol, Camguin Norte, Cebu, Lubang, Luzon, Mindanao, Mindoro, Palawan, Sicogon, Siquijor, Tumaguin).
-
Literatur: Duya et al. (2019); Esselstyn, Widmann & Heaney
(2004); Heaney et al. (1998);
Moratelli et al. (2019,
2020); Sanborn
(1952); Sedlock
(2001); Sedlock et al. (2020);
Taylor (1934);
Thomas (1904).
Kerivoula
argentata Tomes, 1861 (Damara-Wollfledermaus/Damara
Woolly Bat):
- Unterarten: Silberne Wollfledermaus (K. argentata argentata Tomes, 1861), Nidi-Wollfledermaus (K. argentata nidicola Kirk, 1865), Zulu-Wollfledermaus (K. argentata zuluensis Roberts, 1924).
- Bestand: Nicht gefährdet.
- Verbreitung : Afrika (Demokratische Republik Kongo; Burundi; Kenia; Tansania; Sambia; Malawi; Mosambik; Simbabwe; Südafrika; Namibia).
- Literatur: Monadjem et al. (2017); Moratelli et al. (2019, 2020).
Kerivoula
eriophora (Heuglin, 1877) (Äthiopien-Wollfledermaus/Ethiopian
Woolly Bat):
- Bestand: Daten defizitär.
- Verbreitung: Afrika (Äthiopien).
- Literatur: Fahr (2019); Heuglin (1877); Moratelli et al. (2019, 2020).
Kerivoula lanosa (A. Smith, 1847) (Kleinere Wollfledermaus/Lesser Woolly Bat):
- Taxonomie: Ursprünglich als Vespertilio lanosus beschrieben. Vermutlich handelt es sich um einen Komplex aus mehreren Arten.
- Unterarten: Südafrikanische Kleinere Wollfledermaus (K. lanosa lanosa (A. Smith, 1847)), Ostafrikanische Kleinere Wollfledermaus (K. lanosa harrisoni Thomas, 1901), Zentralafrikanische Kleinere Wollfledermaus (K. lanosa lucia Hinton, 1920), Westafrikanische Kleinere Wollfledermaus (K. lanosa muscilla Thomas, 1906).
- Bestand: Nicht gefährdet.
- Verbreitung: Afrika (Sierra Leone; Gabun; Ghana; Guinea; Liberia; Elfenbeinküste; Benin; Togo; Nigeria; Kongo; Zentralafrikanische Republik; Demokratische Republik Kongo; Angola; Botswana; Südafrika; Swasiland; Sambia; Simbabwe; Mosambik; Malawi; Tansania; Burundi; Ruanda; Uganda; Kenia; Südsudan; Äthiopien).
-
Literatur: Cotterill (1996); Hill (1977); Hinton (1920); Monadjem et al.
(2017); Moratelli et al. (2019, 2020); Rathbun
(2005); Roberts (1951); A. Smith (1847); Taylor (2000); Thomas (1901, 1906).
Kerivoula africana Dobson, 1878 (Tansania-Wollfledermaus/Tanzanian Woolly Bat):
- Bestand: Stark gefährdet.
- Verbreitung: Afrika (Tansania).
-
Literatur: Cockle et al. (1998); Cooper-Bohannon, Fahr & Jacobs (2020); Dobson (1878); Matschie
(1895); Moratelli et al. (2019,
2020); Swynnerton & Hayman
(1951).
Kerivoula cuprosa Thomas, 1912 (Kupferfarbige Wollfledermaus/Coppery Woolly Bat):
- Bestand: Daten defizitär.
- Verbreitung : Afrika (Liberia; Guinea; Elfenbeinküste; Kamerun; Demokratische Republik Kongo; Kenia).
- Literatur: Fahr (2019); Koopman, Kofrin & Chapman (1995); Moratelli et al. (2019, 2020).
Kerivoula phalaena Thomas, 1912 (Spurrell-Wollfledermaus/Spurrell’s Woolly Bat):
- Bestand: Nicht gefährdet.
- Verbreitung : Afrika (Gabun; Ghana; Liberia; Elfenbeinküste; Kamerun; Kongo; Demokratische Republik Kongo; Ruanda; Uganda).
- Literatur: Koopman, Kofrin & Chapman (1995); Kuhn (1965); Monadjem & Fahr (2017); Moratelli et al. (2019, 2020); Rosevear (1965).
Kerivoula smithii Thomas, 1880 (Smith-Wollfledermaus/Smith’s Woolly Bat):
- Bestand: Nicht gefährdet; Populationsentwicklung unbekannt.
- Verbreitung : Afrika (Nigeria; Kamerun; Demokratische Republik Kongo; Kenia; Uganda).
- Literatur: Monadjem & Fahr (2017); Moratelli et al. (2019, 2020).
Kerivoula muscina Tate, 1941 (Neuguinea-Wollfledermaus/Fly
River Woolly Bat):
- Bestand: Nicht gefährdet.
- Verbreitung: Asien (Papua-Neuguinea).
-
Literatur: Aplin & Armstrong (2017); Bonaccorso (1998); Flannery
(1995); Moratelli et al. (2019,
2020); Shearman et al. (2009);
Tate (1941).
Kerivoula agnella Thomas, 1908 (Misima-Wollfledermaus/Saint
Aignan’s Woolly Bat):
- Bestand: Stark gefährdet; Population abnehmend.
- Verbreitung: Asien (Papua-Neuguinea).
-
Literatur: Aplin & Armstrong (2020); Bonaccorso (1998); Flannery (1995); Moratelli et al. (2019, 2020); Shearman et al. (2009);
Thomas (1908).
Kerivoula myrella Thomas, 1914 (Bismarck-Archipel-Wollfledermaus/Bismarck’s Woolly Bat):
- Taxonomie: Bei den Populationen von Manus und dem Bismarck-Archipel handelt es sich möglicherweise um getrennte Arten.
- Bestand: Gefährdet.
- Verbreitung: Ozeanien (Papua-Neuguinea: Manus-Insel, Bismarck-Archipel).
-
Literatur: Aplin & Armstrong (2021); Bonaccorso (1998); Flannery
(1995); Hill (1965); Hill & Rozendaal
(1989); Koopman (1979); Moratelli et al. (2019, 2020); Thomas (1914).
Kerivoula
hardwickii (Horsfield, 1824) (Hardwicke-Wollfledermaus/Hardwicke’s Woolly Bat):
- Taxonomie: Zunächst als Vespertilio hardwickii beschrieben.
- Bestand: Nicht gefährdet.
- Literatur: Douangboubpha et al. (2015, 2016); Hasan & Abdullah (2011); Horsfield (1824); Khan et al. (2010); Kruskop (2011); Kuo et al. (2017), Moratelli et al. (2019, 2020); Tu et al. (2018, 2020); Yu et al. (2018).
Kerivoula depressa G. S. Miller, 1906 (Flachkopf-Wollfledermaus/Flat-skulled Woolly Bat):
- Taxonomie: Enge Verwandtschaft zu K. hardwickii, in welche depressa zeitweise als Unterart eingeordnet war. Vor allem durch die Schädelmorphologie lässt sich der Rang als eigenständige Art aber gut belegen.
- Bestand: Nicht gefährdet.
- Verbreitung : Asien (Myanmar; Thailand; Laos; Kambodscha; Vietnam).
-
Literatur: Douangboubpha et al.
(2016); G. S. Miller (1906);
Moratelli et al. (2019,
2020); Tu et al. (2018); Tu, Furey & Csorba (2021).
Kerivoula
crypta Wroughton & Ryley, 1913 (Kryptische Wollfledermaus/Cryptic Woolly Bat):
- Taxonomie: Teil des hardwickii-Artenkomplexes, eng verwandt mit K. malapsi, welche zum Teil auch als Unterart oder Synonym betrachtet wird.
- Bestand: Nicht gefährdet.
- Verbreitung: Asien (Indien).
-
Literatur: Bates
& Harrison (1997); Korad, Yardi & Raut (2007); Moratelli et al. (2019,
2020); Tu et al. (2018); Tu, Furey & Csorba (2021); Wroughton & Ryley
(1913).
Kerivoula malpasi W. W. A. Phillips, 1932 (Sri-Lanka-Wollfledermaus/Sri Lankan Woolly Bat):
- Taxonomie: Teil des hardwickii-Artenkomplexes, eng verwandt mit K. crypta, möglicherweise auch eine Unterart von dieser.
- Bestand: Nicht bewertet.
- Verbreitung: Asien (Sri Lanka).
- Literatur: Edirisinghe et al. (2018); Gabadage et al. (2018); Moratelli et al. (2019, 2020); Phillips (1932); Tu et al. (2018).
Kerivoula furva Kuo, Soisook, Ho, Csorba, Wang & Rossiter, 2017 (Dunkle Wollfledermaus/Dark Woolly Bat):
- Taxonomie: Teil des hardwickii-Artenkomplexes.
- Bestand: Nicht gefährdet.
- Verbreitung : Asien (Pakistan; Indien; Nepal; Myanmar; Laos; Vietnam; Taiwan; China).
- Literatur: Bates & Harrison (1997); Hsu et al. (2021); Kuo et al. (2017); Moratelli et al. (2019, 2020); Tu et al. (2018); Tu, Furey & Csorba (2021); Yu et al. (2018).
Kerivoula
kachinensis Bates, Struebig, Rossiter, Kingston, Oo & Mya, 2004 (Kachin-Wollfledermaus/Kachin Woolly Bat):
- Holotypus/Terra typica: HZM.1.35288 (Harrison-Institut Sevenoaks), erwachsenes Weibchen (Körper in Alkohl und Schädel), gesammelt von Matthew J. Struebig, Sai Sein Lin Oo, Sein Sein Win, Moe Moe Aung und Aye Aye Nwe am 11. April 2003 im Namdee-Wald bei Bhamo, Kachin-Staat, Myanmar.
- Taxonomie/Etymologie: Der wissenschaftliche Name kachinensis leitet sich von Kachin ab, dem Namen des Staats in Myanmar, in welchem das Typusexemplar gefunden wurde. Nach genetischen und morphologischen Analysen gehört die Art zum hardwickii-Komplex.
- Bestand: Nicht gefährdet.
- Verbreitung: Asien (China; Myanmar; Thailand; Laos; Vietnam).
-
Literatur: Bates et al. (2004);
Bates, Thong
& Soisook (2019);
Douangboubpha et al. (2016);
Khan et al. (2010); Moratelli et al. (2019,
2020); Soisook et al. (2007);
Struebig et al. (2005);
Thomas et
al. (2013); Thong
et al. (2006); Yu et al. (2022).
Kerivoula
dongduongana Tu, Hassanin, Furey, Son & Csorba, 2018 (Indochinesische Wollfledermaus/Indochinese Woolly Bat):
-
Holotypus/Terra typica: MNHN (CG) 2017-2723 (), adultes Weibchen
(Körper in Alkohol und Schädel), gesammelt
von Vuong Tan Tu und Alexandre Hassnin
am 28. November 2011 im Ngoc-Linh-Naturreservat, Provinz Kon Tum,
Vietnam.
- Taxonomie/Etymologie: Der wissenschaftliche Name dongduongana leitet sich vom vienamesischen Wort Ðông Dựợng für „Indochina“ ab und bezieht sich auf das Verbreitungsgebiet der Art. Nach genetischen und morphologischen Untersuchungen ist K. dongduongana Teil des hardwickii-Artenkomplexes.
- Bestand: Nicht gefährdet.
- Verbreitung : Asien (Thailand; Laos; Kambodscha; Vietnam).
-
Literatur: Douangboubpha et al.
(2016); Kuo
et al. (2017); Moratelli et al. (2019,
2020); Son et al. (2021);
Tu et al. (2018);
Tu, Furey &
Csorba (2021).
Kerivoula
krauensis Francis, Kingston
& Zubaid, 2007 (Krau-Wollfledermaus/Krau
Woolly Bat):
- Bestand: Potenziell gefährdet (Vorwarnliste).
- Verbreitung: Asien (Thailand; Malysia; Indonesien: Sumatra, Kalimantan; Brunei).
-
Literatur: Douangboubpha et al.
(2016); Francis, Kingston & Zubaid
(2007); Moratelli et al. (2019, 2020); Nor Zalipah (2020);
Struebig et al. (2017).
Kerivoula
titania Bates, Struebig, Hayes, Furey, Mya, Thong, Tien, Son, Harrison, Francis & Csorba, 2007 (Titania-Wollfledermaus/Titania’s Woolly Bat):
- Holotypus/Terra typica: HNHM 2005.81.58 (Ungarisches Museum für Naturgeschichte Budapest), adultes Weibchen (Körper in Alkohl und Schädel), gesammelt von Gabor Csorba, H. S. Hong und C. Chen am 15. Juli 2015 im Seima-Schutzgebiet für Biodiversität, Mondul-Kiri-Provinz, Kambodscha.
- Etymologie: Benannt nach Titania, der Feenkönigin aus William Shakespeares Sommernachtstraum.
- Bestand: Nicht gefährdet.
- Verbreitung: Asien (Myanmar; Thailand; Laos; Kambodscha; Vietnam; China; Taiwan).
-
Literatur: Bates et al. (2007);
Bates, Soisook
& Thong (2019); Douangboubpha et al. (2016);
Li et al. (2016); Moratelli et al. (2019,
2020); Thomas et al. (2013); Wu et al. (2012); Yu et al. (2022).
Kerivoula
minuta G. S. Miller, 1898 (Zwerg-Wollfledermaus/Least
Woolly Bat):
- Bestand: Potenziell gefährdet (Vorwarnliste).
- Verbreitung: Asien (Indonesien: Kalimantan; Malaysia; möglicherweise auch Thailand).
-
Literatur: Douangboubpha et al.
(2016); Khan et al. (2010); Kumaran et al. (2006);
G. S. Miller (1898); Moratelli et al. (2019,
2020); Nor Zalipah
(2020); Struebig, Galdikas & Suatma (2006).
Kerivoula
intermedia Hill & Francis, 1984 (Kleine Wollfledermaus/Small Woolly Bat):
- Taxonomie: Gelegentlich als Synonym von K. minuta betrachtet.
- Bestand: Potenziell gefährdet (Vorwarnliste).
- Verbreitung : Asien (Indonesien: Kalimantan; Brunei; Malaysia; möglicherweise auch Thailand).
-
Literatur: Hasan & Abdullah
(2011); Hill &
Francis (1984); Khan et al. (2010);
Kumaran et al. (2006);
Mohd-Azlan, Neuchlos & Abullah (2005); Moratelli et al. (2019, 2020); Nor Zalipah
(2020); Struebig, Galdikas & Suatma (2006).
Kerivoula
papillosa (Temminck, 1840) (Warzen-Wollfledermaus/Papillose Woolly Bat):
- Bestand: Nicht gefährdet; Populationsentwicklung stabil.
- Verbreitung : Asien (Vietnam; Kambodscha; Laos; Thailand; Malaysia; Brunei; Indonesien: Kalimantan, Sulawesi, Java, Sumatra)
- Literatur: Blundell, A. G. (1996); Douangboubpha et al. (2016); Hasan & Abdullah (2011); Hutson & Kingston (2021); Jeanes & Meijaard (2000); Khan et al. (2010); Moratelli et al. (2019, 2020) ; Vanitharani et al. (2003).
Kerivoula
bantadica Douangboubpha, 2014 (Khao-Bantad-Wollfledermaus/Khao
Bantad Thailand Woolly Bat):
- Holotypus/Terra typica: PSUZC-MM2011.2 (Prinzessin-Maha-Chakri-Sirindhorn-Museum für Naturgeschichte, Prinz-von-Songkla-Universität Hat Yai), Männchen, gesammelt im Khao-Bantad-Wildschutzgebiet, Provinz Trang, Thailand (vorläufige Angaben).
- Taxonomie/Etymologie: Nach Analysen von Douangboubpha (2014) eng mit K. malayana verwandt. Der Name leitet sich vom Fundort im Khao-Bantad-Gebirge ab.
- Bestand: Nicht bewertet.
- Verbreitung: Asien (Thailand; Malaysia; Indonesien: Java, Sumatra).
- Literatur: Douangboubpha (2014).
Kerivoula lenis Thomas, 1916 (Sanfte Wollfledermaus/Lenis Woolly Bat):
- Taxonomie: Zeitweise als Unterart von K. papillosa betrachtet. Vanitharani et al. (2003) belegten jedoch, dass es sich bei lenis um eine eigenständige Art handelt.
- Bestand: Nicht gefährdet.
- Verbreitung : Asien (Indien; Malaysia; Indonesien: Kalimantan).
-
Literatur: Hasan & Abdullah
(2011); Khan et al. (2010);
Moratelli et al. (2019,
2020); Srinivasulu & Srinivasulu
(2019); Struebig, Galdikas & Suatma (2006); Vanitharani et al.
(2003).
Kerivoula malayana Chasen, 1940 (Malaiische Wollfledermaus/Malayan Woolly Bat):
- Taxonomie: Meist noch als Unterart von K. papillosa gelistet. Analysen von Douangboubpha (2014) stützen aber den Status einer separaten Art.
- Bestand: Nicht bewertet.
- Verbreitung: Asien (Vietnam; Kambodscha; Laos; Thailand; Malaysia; Indonesien).
- Literatur: Douangboubpha (2014); Moratelli et al. (2019, 2020).
Kerivoula thailandensis Douangboubpha, 2014 (Thailändische
Wollfledermaus/Thailand Woolly Bat):
-
Holotypus/Terra typica: PSUZC-MM2008.57 (Prinzessin-Maha-Chakri-Sirindhorn-Museum für Naturgeschichte, Prinz-von-Songkla-Universität Hat Yai), Männchen, gesammelt im Mai-Nam-Pha-Chi-Wildschutzgebiet, Provinz Ratchaburi, Thailand (vorläufige Angaben).
- Taxonomie: Nach Analysen von Douangboubpha (2014) eng mit K. malayana verwandt.
- Unterarten: Große Thailändische Wollfledermaus (K. thailandensis thailandensis Douangboubpha, 2014), Kleine Thailändische Wollfledermaus (K. thailandensis minima Douangboubpha, 2014 (PSUZC-MM2011.53, Weibchen, gesammelt im Klom-Luang-Chumporn-Wildschutzgebiet Süd, Provinz Ranong, Thailand (vorläufige Angaben))).
- Bestand: Nicht bewertet.
- Verbreitung: Asien (Thailand).
- Literatur: Douangboubpha (2014).
Kerivoula
flora Thomas, 1914 (Flores-Wollfledermaus/Flores
Woolly Bat):
- Bestand: Gefährdet.
- Verbreitung: Asien (Indonesien: Flores, Bali, Lombak, Sumbawa, Sumba; Malaysia: Sabah).
-
Literatur: Corbet & Hill (1992); Moratelli et al. (2019, 2020); Thomas (1914); Waldien & Wiantoro (2021).
Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Kerivoulinae > Phoniscus
Genus
Phoniscus G. S. Miller, 1905 (Gattung Trompetenohrfledermäuse/Trumpet-eared Bats):
-
4 Arten; Generotypus Phoniscus atrox G. S. Miller,
1905.
-
Literatur: G. S. Miller
(1905).
Phoniscus aerosa (Tomes, 1858) (Zweifelhaftes Trompetenohr/Dubious Trumpet-eared Bat):
- Holotypus/Terra typica: Tomes gab als Herkunft für das Typusexemplar ursprünglich Südafrika an. Dabei handelt es sich aber wohl um einen Fehler. Vermutlich stammt das Exemplar von der indonesischen Insel Sulawesi.
- Taxonomie: Ursprünglich als Kerivoula aerosa beschrieben.
- Bestand: Daten defizitär.
- Verbreitung: Asien (möglicherweise Indonesien: Sulawesi)
-
Literatur: Corbet & Hill (1992); Hutson
(2008); Moratelli et al. (2019,
2020); Tomes (1858).
Phoniscus atrox G. S. Miller, 1905 (Furchenzahn-Trompetenohr/Groove-toothed Trumpet-eared Bat):
- Bestand: Potenziell gefährdet (Vorwarnliste).
- Verbreitung : Asien (Thailand; Malaysia; Indonesien (Sumatra; Kalimantan).
- Literatur: Huang et al. (2014); Jayaraj (2020); G. S. Miller (1905); Moratelli et al. (2019, 2020); Thong et al. (2006).
Phoniscus jagorii (Peters, 1866) (Peters-Trompetenohr/Peters’
Trumpet-eared Bat):
- Taxonomie: Ursprünglich von Peters als Vespertilio (Kerivoula) jagorii beschrieben. Exemplare aus Laos stellen möglicherweise eine eigene Art dar.
- Bestand: Nicht gefährdet.
-
Verbreitung : Asien (Myanmar; Thailand; Malaysia; Indonesien;
Laos; Vietnam; Philippinen).
-
Literatur: Heaney et al. (1998); Moratelli et al. (2019, 2020); Oo et al. (2019);
Thong et al. (2006).
Phoniscus
papuensis (Dobson, 1878) (Papua-Trompetenohr/Papuan Trumpet-eared Bat):
- Taxonomie: Von Dobson als Kerivoula papuensis beschrieben.
- Bestand: Gefährdet.
- Verbreitung : Ozeanien (Australien: Neusüdwales, Queensland; Papua-Neuguinea; Indonesien: Papua).
-
Literatur: Bonaccorso (1998); Dobson
(1878); Flannery (1995); Law & Chidel
(2004); Loyd & Pennay (2021);
Moratelli et al. (2019,
2020); Rhodes (1995); Schulz (2000a, b); Schulz
& Eyre (2000); Schulz & Wainer (2009).
Laurasiatheria > Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Murininae
|
|
|
|
|
|
|
Murininae |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Subfamilia Murininae G. S. Miller, 1907 (Unterfamilie
Röhrennasenfledermäuse):
-
46 Arten
-
Literatur: Miller (1907).
Genus
Harpiocephalus
Gray, 1842 (Gattung Haarflügelfledermäuse):
-
1 Arten.
-
Literatur: Gray (1842).
Genus Harpiola Thomas,
1915 (Gattung Gleichzahnige
Röhrennasen):
-
2 Arten.
Genus Murina Gray, 1842 (Gattung Eigentliche Röhrennasen):
-
43 Arten.
-
Literatur: Chen et al. (2017);
Gray (1842); Zeng et al. (2018).
Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Murininae > Harpiocephalus
|
Harpiocephalus |
|
|
|
|
Genus
Harpiocephalus
Gray, 1842 (Gattung Haarflügelfledermäuse):
-
1 Arten.
-
Literatur: Gray (1842).
Harpiocephalus
harpia (Temminck, 1840) (Haarflügelfledermaus/
Hairy-winged Bat):
- Taxonomie: Von Temminck zunächst als Vespertilio harpa beschrieben und später in die eigene Gattung Harpiocephalus gestellt. Möglicherweise gehört die Art aber in die Gattung Murina. Die teils in der Literatur als separate Art genannte H. mordax ist ein Synonym. Bei den zu H. harpia beschriebenen Unterschieden, handelt es sich lediglich um Geschlechtsdimorphismus (Chen et al., 2015; Son et al., 2016).
- Unterarten: Sunda-Haarflügelfledermaus (H. harpia harpia (Temminck, 1840)), Nordindische Haarflügelfledermaus (H. harpia lasyurus Hodgson, 1847), Südindische Haarflügelfledermaus (H. harpia madrassius Thomas, 1923), Indochinesische Haarflügelfledermau H. harpia rufulus G. M. Allen, 1913).
- Synonym: Große Haarflügefledermaus (Hapriocephalus mordax Thomas, 1923).
- Bestand: Nicht gefährdet.
- Verbreitung: Asien (Indien; Myanmar; Thailand; Laos; Vietnam; China; Taiwan; Philippinen; Indonesien; Malaysia).
-
Literatur: Bates &
Harrison (1997); Chen et al. (2015); Csorba et al.
(2021); Das (1986); Heaney
et al. (1998); Ingle (1992); Lin, Lee &
Cheng (1997); Matveev (2005); Moratelli et al. (2019,
2020); Smith
& Xie (2008); Son et al. (2016);
Srinvasulu, Srinivasulu &
Sinha (2012); Tang, Yu & Wu (2020).
Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Murininae > Harpiola
|
|
|
|
|
|
Harpiola |
|
|
|
|
|
|
||
|
|
|
|
Genus Harpiola Thomas,
1915 (Gattung Gleichzahnige
Röhrennasen):
-
2 Arten.
Harpiola grisea Peters, 1872 (Graue Röhrennase/Grey Tube-nosed Bat):
-
Terra
typica: Jeripane, Mussooree,
Dehra Du, Uttar Pradesh, Indien.
- Taxonomie: Möglicherweise besteht eine nähere Verwandtschaft zu Murina harpioloides und M. chrysochaetes, so dass diese entweder in die Gattung Harpiola zu stellen oder die Taxa isodon und grisea in die Gattung Murina zu integrieren wären. Zur Klärung besteht noch weiterer Forschungsbedarf.
- Bestand: Daten defizitär.
- Verbreitung: Asien (Indien: Mizoram, Uttarakhand).
- Literatur: Bhattacharyya (2002); Csorba et al. (2016); Kuo et al. (2006); Moratelli et al. (2019, 2020); Peters (1872).
Harpiola isodon Kuo et al., 2006 (Goldgelbe Formosa-Röhrennase/Formosan
Golden Tube-nosed Bat):
- Holotypus/Terra typica: ZMNTU 1998.5.3 (Zoologisches Museum der Nationaluniversität Taiwan), adultes Männchen (Haut und Schädel), gesammelt von D. S. Ding und K. Y. Wang am 02. Mai 1998 im Yuli-Wildrefugium (2.000 m Höhe), nahe Jhuosi, Hualien, Taiwan.
- Taxonomie/Etymologie: Möglicherweise besteht eine nähere Verwandtschaft zu Murina harpioloides und M. chrysochaetes, so dass diese entweder in die Gattung Harpiola zu stellen oder die Taxa isodon und grisea in die Gattung Murina zu integrieren wären. Zur Klärung besteht noch weiterer Forschungsbedarf. Der wissenschaftliche Name isodon für „gleichzahnig“ bezieht sich auf die annähernd gleiche Basalfläche von Eckzähen, ersten und zweiten Premolaren.
- Bestand: Nicht gefährdet.
- Verbreitung: Asien (Vietnam; Taiwan).
- Literatur: Kruskop, Kalyakin & Abramov (2006); Kruskop & Shchinov (2010); Kuo et al. (2006); Kuo & Huang (2020); Moratelli et al. (2019, 2020).
Scrotifera > Volitantia > Chiroptera > Vespertilioniformes > Yangochiroptera > Vespertilionoidea > Vespertilionidae
> Murininae > Murina
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Murina |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Genus Murina Gray, 1842 (Gattung Eigentliche Röhrennasen):
-
43 Arten.
-
Literatur: Chen et al. (2017);
Gray (1842); Zeng et al. (2018).
Murina
chrysochaetes Eger & Lim, 2011 (Goldbraune Röhrennase/Golden-haired Tube-nosed Bat):
- Holotypus/Terra typica: ROM MAM 116181 (Königliches Ontario-Museum), adultes Männchen (Haut, Schädel und Skelett), gesammelt am 05. Oktober 2004 von Burton K. Lim und Judith L. Eger im Jing-Xi-Naturreservat (978 m Höhe), Jing Xi, Guangxi Zhuang, China.
- Taxonomie/Etymologie: Die Art ist eng mit M. harpioloides verwandt. Der wissenschaftliche Name leitet sich von den griechischen Wörtern χρυσός für „Gold“ χαίτη für „Haar“ ab.
- Bestand: Daten defizitär.
- Verbreitung: Asien (China; Vietnam).
- Literatur: Bouillard (2021); Eger & Lim (2011); Moratelli et al. (2019, 2020).
Murina
harpioloides Kruskop & Eger, 2008 (Vietnamesische
Röhrennase/Hairy-winged
Tube-nosed Bat):
- Bestand: Stark gefährdet.
- Verbreitung: Asien (Vietnam).
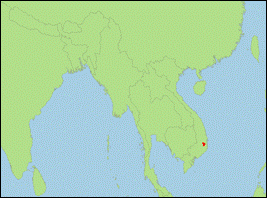
- Literatur: Kruskop & Eger (2008); Moratelli et al. (2019, 2020).
Murina harrisoni Csorba & Bates, 2005 (Harrison-Röhrennase/Harrison’s Tube-nosed Bat):
- Bestand: Daten defizitär.
Murina tiensa Csorba, Vu, Bates & Furey, 2007 (Bac-Kan-Röhrennasenfledermaus/Mystery Tube-nosed Bat):
- Holotypus/Terra typica: HZM.2.38178 (Harrison-Institut Sevenoaks), erwachsenes Weibchen (Körper in Spiritus, Schädel), gesammelt von N. Furey am 03. März 2007 im Kim-Hy-Naturreservat (750 m Höhe), bei An Tinh, Provinz Bac Kan, Vietnam.
- Bestand: Nicht bewertet.
- Literatur: Csorba et al. (2007).
Murina huttoni (Peters, 1872) (Hutton-Röhrennase/Hutton’s
Tube-nosed Bat):
- Taxonomie/Etymologie: Ursprünglich von Peters als Harpyiocephalus huttonii beschrieben. Die Art ist nach Captain Thomas Hutton benannt, der das Typusexemplar fing.
- Unterarten: Weißbauch-Röhrennase (M. huttoni huttoni (Peters, 1872)), Rötel-Röhrennase (M. huttoni rubella Thomas 1914).
- Bestand: Nicht gefährdet.
- Verbreitung : Asien (China; Nepal; Indien; Myanmar; Malaysia; Thailand; Laos; Vietnam).
- Literatur: Csorba et al. (2007); Csorba, Srinivasulu & Srinivasulu (2019); Das (2003); Peters (1872); Smith & Xie (2008); Son et al. (2015); Srinivasulu & Srinivasulu (2012); Thomas (1914); Zhang et al. (2016).
Murina puta Kishida, 1924 (Taiwanesische Röhrennase/Taiwan
Tube-nosed Bat):
- Bestand: Potenziell gefährdet (Vorwarnliste).
- Literatur: Lin, Lee & Cheng (1997).
Murina ryukyuana Maeda & Matsumura, 1998 (Ryukyu-Röhrennase/Ryukyu Tube-nosed Bat):
- Holotypus/Terra typia: NSMT-M31305 (Nationales Wissenschaftsmuseum Tokio), adultes Männchen (Haut und Schädel), gesammelt am 12. Oktober 1996 in einem Wald am Oberlauf des Funga-Flusses, Aha, Kunigami-mura, Okinawa, Japan.
- Bestand: Stark gefährdet.
- Verbreitung : Asien (Japan: Okinawa Hontō, Tokunoshima, Amami-Ōshima).
-
Literatur: Asari & Kimoto (2018);
Asari, Kimoto &
Noda (2021); Fukui & Sano (2019); Funakoshi
(2010); Funakoshi et al. (2019); Kawai (2015); Kawai et al. (2002); Maeda, Akazawa & Matsumura (2001); Maeda & Matsumura
(1998); Maeda, Nishii & Oguri (2002);
Moratelli et al. (2019,
2020); Preble, Vincenot & Ohte (2020) ;
Watari & Funakoshi (2013).
Murina ussuriensis Ognev, 1913 (Ussuri-Röhrennase/Ussuri Tube-nosed Bat):
- Taxonomie: Die Formen silvatica, katerinae und tenebrosa könnten Unterarten oder Synonyme von ussuriensis sein. Genauere Analysen hierzu stehen noch aus.
- Bestand: Nicht gefährdet.
- Literatur: Funakoshi (2010); Kawai et al. (2002); Moratelli et al. (2019, 2020); Ognev (1913).
Murina silvatica Yoshiyuki, 1983 (Japanische Röhrennase/Forest Tube-nosed Bat):
- Taxonomie: Häufig als Unterart oder Synonym von M. ussurienses gelistet. Das Taxon katerinae könnte auch ein Synonym von silvatica oder ussuriensis sein. Genauere Untersuchungen zum Status der Arten bzw. Unterarten sind noch ausstehend.
- Unterarten: Waldröhrennase (M. silvatica silvatica Yoshiyuki, 1983), Katerina-Röhrennase (M. silvatica katerinae Kruskop, 2005).
- Bestand: Nicht gefährdet; aktuell von der IUCN unter M. ussuriensis bewertet.
- Literatur: Kruskop (2005); Moratelli et al. (2019, 2020); Yoshiyuki (1983).
Murina tenebrosa Yoshiyuki, 1970 (Düstere Röhrennasenfledermaus/Gloomy
Tube-nosed Bat):
- Alternative Bezeichnung: Tsushima-Röhrennase.
- Taxonomie: Möglicherweise handelt es sich um eine Unterart oder ein Synonym von M. ussuriensis. Hier sind entsprechende Analysen derzeit noch ausstehend.
- Bestand: Vom Aussterben bedroht; möglicherweise bereits ausgestorben.
- Verbreitung : Asien (Japan: Tsushima, eventuell auch Yaku).
-
Literatur: Fukui
& Sano (2019); Kawai
(2015); Kawai et al. (2007);
Moratelli et al. (2019,
2020); Yoshiyuki
(1970).
Murina jinchui Yu, Csorba & Wu, 2020 (Jinchu-Röhrennase/Jinchu’s
tube-nosed Bat):
- Holotypus/Terra typica: GZHU 14463 (Guangzhou-Universität), adultes Männchen (Haut, Körper in Alkohol, Schädel), gesammelt am 13. August 2014 von Yi Wu, Feng Li, Bo-Cheng Chen und Qi-Ping Zhang im Hetaoping-Panda-Trainingslager des Wolong-National-Naturreservats (1.800 m Höhe), Wenchuan, Sichuan, China.
- Taxonomie/Etymologie: Die Art wurde nach Professor Jinchu Hu (Experte für Große Pandas und einer der Gründer des Hetaoping-Panda-Trainingslagers und des Wolong-Naturreservats), der die ökologische Forschung in China sehr unterstützte. Genetische Analysen stellen die Art in eine Schwesterbeziehung zum Komplex der Taxa hilgendorfi, fusca, rongjangensis, fanjingshanensis, shuipuensis, und leucogaster.
- Bestand: Nicht bewertet.
- Verbreitung: Asien (China: Sichuan).
- Literatur: Moratelli et al. (2020); Yu, Csorba & Wu (2020).
Murina fusca Sowerby, 1922 (Dunkle Röhrennase/Dusky Tube-nosed Bat):
- Taxonomie: In der Vergangenheit oft als Unterart von M. leucogaster gelistet (Corbet, 1978; Ellerman & Morrison-Scott, 1951). Wang (1959) hält fusca für ein Synonym von hilgendorfi.
- Bestand: Daten defizitär.
- Verbreitung : Asien (China: Heilongjiang).
- Literatur: Corbet (1978); Ellerman & Morrison-Scott (1951); Sowerby (1922); Moratelli et al. (2019, 2020); Smith & Xie (2008); Wang (1959); Wu & Yu (2020).
Murina hilgendorfi Peters, 1880 (Hilgendorf-Röhrennase/Hilgendorf’s Tube-nosed Bat):
-
Unterarten: Große Röhrennase (M. hilgendorfi hilgendorfi Peters, 1880), Ognev-Röhrennase
(M. hilgendorfi
ognevi Kishida &
Mori, 1931), Sibirische Röhrennase
(M. hilgendorfi
sibirica Kastschenko 1905).
- Bestand: Nicht gefährdet.
- Verbreitung : Asien (Russland; Mongolei; China; Nordkorea; Südkorea; Japan).
-
Literatur: Fukui,
Agetsuma & Hill (2004); Fukui, Sano & Kruskop
(2019); Kawai
(2015); Kruskop et al. (2012);
Peters, 1880; Moratelli et al. (2019, 2020); Smith & Xie (2008).
Murina
rongjangensis Chen, Liu, Deng, Xiao & Zhou, 2017 (Rongjang-Röhrennase/Rongjiang tube-nosed Bat):
- Holotypus/Terra typica: GZNU20160826001 (Guizhou Allgemeine Universität Guiyang), adultes Weibchen (in Alkohol), gesammelt am 26. August 2016 in einer verlassenen Mine (570 m Höhe) bei Xinghua, Rongjang, Provinz Guizhou, China.
- Bestand: Nicht bewertet.
- Verbreitung: Asien (China: Guizhou).
- Literatur: Chen et al. (2017); Moratelli et al. (2019, 2020).
Murina
bicolor Kuo, Fang, Csorba & Lee, 2009 (Zweifarbige Röhrennase/Bicolored tube-nosed Bat):
- Holotypus/Terra typica: ZMNTU 2002.2.1 (Zoologisches Museum der Nationaluniversität Taiwan), adultes Weibchen (Haut, Schädel, Skelett), gesammelt von H.-C. Cheng am 25. Februar 2002 am Hehuanshang im Taroko-Nationalpark (3.020 m Höhe), bei Renai, Nantou, Taiwan.
- Bestand: Nicht gefährdet.
- Verbreitung: Asien (Taiwan).
- Literatur: Kuo et al. (2009); Lee & Kuo (2017); Moratelli et al. (2019, 2020).
Murina fanjingshanensis He, Xiao & Zhou, 2015 (Fanjingshan-Röhrennase/Fang
He tube-nosed Bat):
- Holotypus/Terra typica: GZNU N20140224001 (Guizhou Allgemeine Universität Guiyang), adultes Männchen (Haut und Schädel), gesammelt am 24. Februar 2014 in einer verlassenen Goldmine (1.069 m Höhe) im Fanjingshan-Nationalnaturreservat, bei Luojiawan, nahe Wuluo, Songtao, Provinz Guizhou, China.
- Taxonomie/Etymologie: Der wissenschaftliche Name bezieht sich auf den Fangjingshan-Nationalnaturservat, in dem das Typusexemplar gefunden wurde. Nach genetischen Untersuchungen ist die Art eng mit M. leucogaster und M. shuipuensis verwandt.
- Bestand: Nicht bewertet.
- Verbreitung: Asien (China: Guizhou, Hunan, Sichuan).
- Literatur: He, Xiao & Zhou (2015); Huang et al. (2018); Liu & Wang (2021); Moratelli et al. (2019, 2020).
Murina leucogaster Milne-Edwards, 1872 (Rötliche Röhrennase/Rufous Tube-nosed Bat):
- Unterarten: Östliche Rote Röhrennase (M. leucogaster leucogaster Milne-Edwards, 1872), Westlich Rote Röhrennase (M. leucogaster rubex Thomas, 1916).
- Bestand: Nicht gefährdet.
- Verbreitung : Asien (China; Vietnam; Indien; möglicherweise auch Nepal).
-
Literatur: Bates
& Harrison (1997); Francis
& Eger (2012); McBee et al. (1986);
Milne-Edwards (1872); Moratelli et al. (2019, 2020); Pearch (2011); Smith
& Xie (2008); Stubbe et al. (2016);
Wu (1982) ; Zhang (1997).
Murina shuipuensis Eger & Lim,
2011 (Shuipu-Röhrennase/Shuipu Tube-nosed Bat):
- Holotypus/Terra typica: ROM MAM 118531 (Königliches Ontario-Museum), erwachsenes Männchen (Haut, Schädel und Skelett), gesammelt am 31. März 2007 von Burton K. Lim und Judith L. Eger bei Shuipu (650 m Höhe), nahe Yuping, Libo, Guizhou, China.
- Taxonomie/Etymologie: Der wissenschaftliche Name bezieht sich auf das Dorf Shuipu, wo das Typusexemplar gefunden wurde, und soll die Dorfbewohner für ihre Unterstützung ehren. Nach genetischen Analysen ist die Art eng mit M. leucogaster verwandt.
- Bestand: Daten defizitär.
- Verbreitung: Asien (China: Guizhou, Guangdong, Jiangxi).
- Literatur: Eger & Lim (2011); Huang et al. (2019); Jiang et al. (2015); Moratelli et al. (2019, 2020); Wang et al. (2016); Yu & Wu (2020).
Murina rozendaali Hill & Francis, 1984 (Rozendaal-Röhrennase/Gilded Tube-nosed Bat):
- Bestand: Gefährdet.
Murina eleryi Furey, Thong, Bates & Csorba, 2009 (Elery-Röhrennase/Eleryi’s Tube-nosed Bat):
- Bestand: Nicht bewertet.
- Literatur: Xu et al. (2014).
Murina balaensis Soisook, Karapan, Satasook
& Bates, 2013 (Bala-Röhrennase/Bala
Tube-nosed Bat):
- Bestand: Nicht bewertet.
- Literatur: Moratelli et al. (2019, 2020); Soisook et al. (2013).
Murina aurata Milne-Edwards, 1872 (Kleine Röhrennase/Little Tube-nosed Bat):
- Bestand: Daten defizitär.
- Verbreitung : Asien (China: Gansu, Sichuan, Yunnan; bei den Nachweisen in Indien, Nepal, Myanmar, Thailand und Laos handelt es sich möglicherweise um M. eleryi).
-
Literatur: Bates
& Harrison (1997); Furey et al.
(2009); Jiang et
al. (2015); Milne-Edwards
(1872); Moratelli et al. (2019,
2020); Smith & Xie (2008); Srinivasulu, Srinivasulu &
Sinha (2012); Xu et al.
(2014); Yu & Wu (2020).
Murina
gracilis Kuo, Fang, Csorba & Lee, 2009 (Zierliche Röhrennase/Gracile
Tube-nosed Bat):
- Holotypus/Terra typica: ZMNTZU 1996.10.3 (Zoologisches Museum der Nationaluniversität Taiwan), adultes Männchen (Körper in Alkohol, Schädel und Skelett), gesammelt von S.-H. Yang und P.-J. Chiang am 30. Oktober 1996 im Yuanyang-See-Naturreservat (1.670 m Höhe), bei Datung, Ilan, Taiwan.
- Taxonomie: Nach Kuo et al. (2015) besteht eine nahe Verwandtschaft zu M. recondita.
- Bestand: Nicht gefährdet.
- Verbreitung : Asien (Taiwan).
-
Literatur: Kuo et al. (2009, 2014, 2015); Lee & Kuo (2017); Moratelli et al.
(2019, 2020); Son
et al. (2015).
Murina recondita Kuo, Fang, Csorba & Lee, 2009 (Versteckte Röhrennase/Cryptic Tube-nosed Bat):
- Holotypus/Terra typica: ZMNTZU 2003.8.1 (Zoologisches Museum der Nationaluniversität Taiwan), adultes Männchen (Körper in Alkohol, Schädel), gesammelt von Hao-Chih Kuo und C.-C. Huang am 01. August 2003 an der Rueisuei-Forststraße nahe Jhuosi, Hualien, Taiwan.
- Taxonomie: Nach Kuo et al. (2015) besteht eine nahe Verwandtschaft zu M. gracilis.
- Bestand: Nicht gefährdet.
- Verbreitung: Asien (Taiwan).
-
Literatur: Kuo et al. (2009, 2014, 2015); Lee & Kuo (2017); Moratelli et al.
(2019, 2020); Son et al. (2015).
Murina hkakaboraziensis Soisook, Thaw, Kyaw, Oo, Pimsai,
Suarez-Rubio & Renner, 2017 (Hkakabo-Razi-Röhrennase/Hkakabo Razi Tube-nosed Bat):
- Holotypus/Terra typica: UMZC PS160218.6 (Zoologische Sammlung Universität Mandalay), adultes Männchen (Körper in Alkohol, Schädel, Baculum), gesammelt von Pipat Soisook, Sai Sein Lin Oo und Awatsaya Pimsai am 18. Februar 2016 im Hkakabo-Razi-Nationalpark (510 m Höhe), 6 km nördlich von Mali Raing, nahe Putao, Kachin, Myanmar.
- Taxonomie/Etymologie: Nach genetischen Untersuchungen besteht eine nahe Verwandtschaft zu M. kontumensis. Die Art wurde nach der Landschaft Hkakabo-Razi benannt, in der sie gefunden wurde.
- Bestand: Nicht bewertet.
- Verbreitung: Asien (Myanmar).
-
Literatur: Moratelli et al. (2019, 2020); Soisook et al. (2017).
Murina kontumensis Son, Csorba, Tu, Thong, Wu, Harada, Oshida, Endo & Motokawa, 2015 (Kon-Tum-Röhrennase/Kon Tum Tube-nosed
Bat):
- Holotypus/Terra typica: IEBR-M5697 (Institut für ökologische und biologische Resourcen Hanoi), adultes Weibchen (Haut, Schädel), gesammelt von Vuong Tuan Tu, Masaharu Motokawa und Nguyen Truong Son am 20. September 2014 im Ngoc-Linh-Naturreservat (1.780 m Höhe), nahe Xop, Distrikt Dak Glei, Provinz Kon Tum, Vietnam.
- Taxonomie/Etymologie: Nach genetischen Untersuchungen besteht eine nahe Verwandtschaft zu M. kontumensis. Die Art wurde nach der Landschaft Hkakabo-Razi benannt, in der sie gefunden wurde.
- Bestand: Nicht bewertet.
- Verbreitung: Asien (Vietnam).
-
Literatur: Moratelli et al. (2019, 2020); Son et al. (2015).
Murina cyclotis Dobson, 1872 (Rundohr-Röhrennase/Round-eared
Tube-nosed Bat):
- Bestand: Nicht gefährdet.
- Literatur: Yue et al. (2019).
Murina
peninsularis Hill, 1964 (Malaiische Röhrennase/Malaysia Tube-nosed
Bat):
- Bestand: Nicht bewertet.
Murina fionae Francis & Eger, 2012 (Fiona-Röhrennase/Fiona’s Tube-nosed Bat):
- Bestand: Nicht bewertet.
Murina liboensis Zeng, Chen, Deng, Xiao
& Zhou, 2018 (Libo-Röhrennase/Libo Tube-nosed Bat):
- Holotypus/Terra typica: GZNU20160727022 (Guizhou Allegemeine Universität Guiyang), adultes Weibchen (Körper in Alkohol, Schädel und Haut), gesammelt am 27. Juli 2016 in einer verlassenen Höhle in Libo, Provinz Guizhou, China.
- Bestand: Nicht bewertet.
- Verbreitung: Asien (China: Guizhou).
- Literatur: Moratelli et al. (2019, 2020); Zeng et al. (2018).
Murina eileenae W. W. A. Phillips, 1932 (Eileena-Röhrennase/Eileena’s
Tube-nosed Bat):
- Bestand: Nicht gefährdet; von IUCN als Bestandteil von M. cyclotis bewertet.
- Literatur: Yue et al. (2019).
Murina guilleni Soisook, Karapan, Satasook, Thong, Khan, Maryanto, Csorba, Furey, Aul & Bates, 2013 (Guillen-Röhrennase/Guillen’s Tube-nosed Bat):
- Holotypus/Terra typica: PSUZC-MM 2010.22 (Prinzessin-Maha-Chakri-Sirindhorn-Museum für Naturgeschichte, Prinz-von-Songkla-Universität Hat Yai), adultes Männchen (Körper in Alkohol, Schädel und Baculum), gesammelt am 19. April 2010 von Pipat Soisook bei Rajjaprabha Dam (80 m Höhe) im Distrikt Ban Takhun, Provinz Surat Thani, Thailand.
- Taxonomie/Etymologie: Die Art ist nach Antonio Guillén-Servent benannt, der das erste Exemplar gesammelt hat. Genetische Untersuchungen zeigen eine nahe Verwandtschaft zu M. liboensis und M. eileenae.
- Unterarten: Thai-Röhrennase (M. guilleni guilleni Soisook, Karapan, Satasook, Thong, Khan, Maryanto, Csorba, Furey, Aul & Bates, 2013), Nikobaren-Röhrennase (M. guilleni nicobarensis Soisook, Karapan, Satasook, Thong, Khan, Maryanto, Csorba, Furey, Aul & Bates, 2013 (HZM 14.35312, erwachsenes Männchen (Körper in Alkohol, Schädel), gesammelt (Datum unbekannt) auf Groß Nikobar, Indien; benannt nach den Nikobaren als Fundort)).
- Bestand: Nicht bewertet.
- Verbreitung: Asien (Thailand; Indien: Nikobaren).
- Literatur: Moratelli et al. (2019, 2020); Soisook et al. (2013).
Murina lorelieae Eger & Lim,
2011 (Lorelie-Röhrennase/Lorelie’s Tube-nosed Bat):
- Holotypus/Terra typica: ROM MAM 116171 (Königliches Ontario-Museum), adultes Männchen (Haut, Schädel, Skelett), gesammelt am 04. Oktober 2004 von Burton K. Lim und Judith L. Eger im Jing-Xi-Naturreservat, Jing Xi, Guangxi Zhuang, China.
- Taxonomie/Etymologie: Die Art wurde nach Dr. Lorelie Mitchell benannt, um ihr für ihre langjährige Unterstützung in der Fledermausforschung zu danken. M. loreliae ist nach genetischen Analysen das Schwestertaxon zum Artenkomplex annamitica, beelzebub, aenea, walstoni, florium und suilla.
- Unterarten: Chinesische Lorelie-Röhrennase (M. loreliae lorelia Eger & Lim, 2011), Ngoc-Linh-Röhrennase (M. loreliae ngoclinhensis Tu & Hassanin, 2015 (MNHN 2013-1078, adultes Männchen gesammelt am 03. Dezember 2011 von Alexandre Hassanin und Vuong Tan Tu im Ngoc-Linh-Naturreservat (1.682 m Höhe), Provinz Kon Tum, Vietnam; benannt nach dem Berg Ngoc Linh, wo die Exemplare der Unterart erstmals gefunden wurden).
- Bestand: Daten defizitär.
- Verbreitung : Asien (China; Guangxi, Yunnan; Vietnam).
- Literatur: Eger & Lim (2011); Jiang et al. (2015); Li et al. (2017); Moratelli et al. (2019, 2020); Tu et al. (2015); Yu & Wu (2020).
Murina aenea Hill, 1964 (Bronzefarbene Röhrennase/Bronze Tube-nosed Bat):
- Bestand: Gefährdet.
Murina walstoni Furey, Csorba & Son, 2011 (Walston-Röhrennase/Walston’s
Tube-nosed Bat):
- Holotypus/Terra typica: HNHM 2010.20.1 (Ungarisches Naturhistorisches Museum Budapest), adultes Männchen (Körper in Alkohol, Schädel), gesammelt von S. Phauk, Ith Saveng und Gabor Csorba am 01. März 2010 im Veun-Sai-Waldschutzgebiet (110 m Höhe), Distrikt Veun Sai, Provinz Ratanakiri, Kambodscha.
- Bestand: Daten defizitär.
- Verbreitung: Asien (Laos; Kambodscha; Vietnam).
-
Literatur: Csorba et al. (2011); Csorba, Furey & Görföl (2020); Francis & Eger (2012); Moratelli et al. (2019,
2020); Son et al. (2015).
Murina florium Thomas, 1908 (Flores-Röhrennase/Flores Tube-nosed Bat):
- Bestand: Nicht gefährdet.
- Literatur: Kutt & Schulz (2000); Schulz & Hannah (1998).
Murina suilla (Temminck, 1840) (Braune Röhrennase/Brown
Tube-nosed Bat):
- Bestand: Nicht gefährdet.
- Literatur: Volleth (2006).
Murina annamitica Francis & Eger, 2012 (Annam-Röhrennase/Annam
Tube-nosed Bat):
- Bestand: Nicht bewertet.
Murina pluvialis Ruedi, Biswas & Csorba,
2012 (Regenwald-Röhrennase/Rainforest Tube-nosed Bat):
- Holotypus/Terra typica: MHNG 1976.071 (Naturhistorisches Museum Genua), erwachsenes Weibchen (Körper in Spiritus und Schädel), gesammelt von Manuel Ruedi und Jayant Biswas am 21. Februar 2011 in den Khasi-Hügeln, bei Laitkynsew (780 m Höhe), Meghalaya, Indien.
- Taxonomie/Etymologie: Der Name pluvialis bezieht sich auf den Regenwald als Lebensraum der beschriebenen Art. Es besteht vermutlich eine Verwandtschaft mit der cyclotis-Artengruppe.
- Bestand: Daten defizitär.
-
Verbreitung: Asien (Indien).
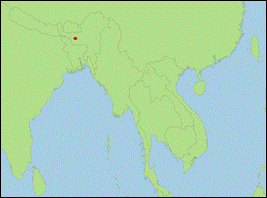
-
Literatur: Moratelli et al. (2019, 2020); Ruedi, Biswas & Csorba (2012); Ruedi & Csorba
(2017).
Murina jaintiana Ruedi, Biswas & Csorba,
2012 (Jaintia-Röhrennase/Jaintiana Tube-nosed Bat):
- Holotypus/Terra typica: MHNG 1976.072 (Naturhistorisches Museum Genua), adultes Männchen (Körper in Spiritus und Schädel), gesammelt am 12. Februar 2011 von Manuel Ruedi und Jayant Biswas in den Jaintia-Hügeln, ca. 2,3 km östlich von Kseh (720 m Höhe), Meghalaya, Indien.
- Taxonomie/Etymologie: Die wissenschaftliche Bezeichnung leitet sich von Jaintias ab, dem Namen für den lokalen Stamm und die Berge im Fundgebiet des Typusexemplars. Nach genetischen Analysen besteht eine enge Verwandtschaft zu M. cineracea.
- Bestand: Daten defizitär.
-
Verbreitung: Asien (Indien; Myanmar).
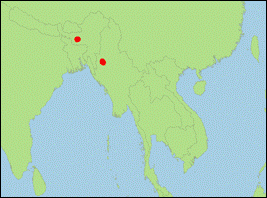
-
Literatur: Csorba et al. (2011); Francis & Eger
(2012); Moratelli et al. (2019,
2020); Ruedi, Biswas & Csorba (2012); Ruedi & Csorba
(2017).
Murina tubinaris (Scully, 1881) (Scully-Röhrennase/Scully’s
Tube-nosed Bat):
- Holotypus/Terra typica: Der Holotypus ging eventuell verloren. John Scully fing ihn wohl ursprünglich am 20. August 1880 in seiner Unterkunft in Gilgit in den nördlichen Gebieten von Pakistan.
- Taxonomie: Zunächst wurde die Art von Scully als Harpiocephalus tubinaris beschrieben, bevor sie von Miller (1907) in die Gattung Murina gestellt wurde. Ellermann & Morrison-Scott (1951) betrachteten sie als Unterart von M. huttoni, während beispielsweise Corbet & Hill (1992) tubinaris als vollwertige Art zählten. Csorba et al. (2011) konnten mit ihren Analysen den Status als eigenständige Art stützen.
- Bestand: Daten defizitär.
- Verbreitung : Asien (Pakistan; Indien: Jammu und Kaschmir).
-
Literatur: Bates
& Harrison (1997); Corbet &
Hill (1992); Csorba et al. (2011); Ellermann & Morrison-Scott
(1951); Francis & Eger (2012); Hill
(1963); Miller
(1907); Moratelli et al. (2019,
2020); Scully (1881); Son et al. (2015); Srinivasulu & Srinivasulu
(2012, 2019); Tate
(1941).
Murina beelzebub Son, Furey & Csorba, 2011 (Beelzebub-Röhrennase/Beelzebub’s Tube-nosed Bat):
-
Holotypus/Terra typica:
HNHM.2007.50.24 (Ungarisches Naturhistorisches Museum Budapest), adultes
Männchen (Körper in Alkohol, Schädel), gesammelt von Nguyen Truong Son, Pham
Duc Tien und Gabor Csorba am 10. November 2007 im Bac-Huong-Hoa-Naturreservat, Distrikt Huong Hoa, Provinz Quang Tri, Vietnam.
- Taxonomie/Etymologie: Exemplare der Form wurden früher teilweise M. tubinaris zugeordnet. Genetische Analysen lassen eine nahe Verwandtschaft zu M. feae annehmen. Der Name leitet sich von einem in der christlichen Mythologie als Beelzebub bezeichneten Dämon ab, dessen Name „Herr der Fliegen“ bedeutet. Mit der Namenswahl soll einerseits auf die diabolisch dunkle Färbung und andererseits auf die insektivore Ernährung hingewiesen werden.
- Bestand: Daten defizitär.
-
Verbreitung: Asien (Vietnam).
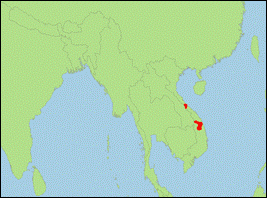
-
Literatur: Csorba et al. (2011, 2019); Moratelli et al.
(2019, 2020); Son et al. (2015).
Murina feae (Thomas, 1891) (Fea-Röhrennase/Fea’s
Tube-nosed Bat):
-
Taxonomie: Von Thomas
ursprünglich als Harpiocephalus feae beschrieben. Im weiteren Verlauf wurden Exemplare der Form zum Teil M. tubinaris zugeordnet (Ellermann & Morrison-Scott, 1951; Corbet & Hill, 1992). Csorba et al. (2011)
beschrieben sie als neue Art M. cineracea. Doch
bei einer Überprüfung des Holotypus von feae stellten Francis & Eger
(2012) fest, dass
cineracea als Synonym von feae einzustufen ist. Genetisch besteht wohl eine enge Verwandtschaft zu M. beelzebub.
-
Synonyme: Aschgraue Röhrennase (Murina cineracea Csorba & Furey, 2011 (HNHM 2005.81.35 (Ungarisches
Naturhistorisches Museum Budapest),
adultes Männchen (Körper in
Alkohol und Schädel, gesammelt von Gabor Csorba und S. H. Hout am 12. Juli 2005 im Seima Schutgebiet
für Biodiversität, nahe der Straße zwischen Seima und O’Rang (360 m Höhe), Provinz Mondulkiri, Kambodscha; cineracea
bezieht sich auf die aschgraue Fellfarbe am Rücken).
- Bestand: Nicht gefährdet.
-
Verbreitung: Asien (Myanmar; Thailand;
Laos; Kambodscha; Vietnam).
-
Literatur: Csorba (2020); Csorba et al. (2011); Francis & Eger (2012);
Moratelli et al. (2019,
2020); Ruedi, Biswas & Csorba (2012); Thomas (1891).
Referenzen:
1)
Alberdi, A., Aihartza, J., Aizpurua, O., Salsamendi, E., Brigham, M. & Garin,
I. (2015). Living above the treeline: roosting
ecology of the alpine bat Plecotus macrobullaris. European
Journal of Wildlife Research 61
(1): 17-25.
2) Alberdi, A. & Aizpurua, O. (2018). Plecotus macrobullaris (Chiroptera:
Vespertilionidae). Mammalian Species 50
(958): 26-33.
3)
Alberdi, A., Aizpurua, O., Aihartza, J. & Garin, I. (2014).
Unveiling the factors shaping the distribution of widely distributed
alpine vertebrates, using multi-scale ecological niche modelling of the bat Plecotus macrobullaris.
Frontiers in Zoology 11 (77): 1-13. doi:
10.1186/s12983-014-0077-6.
4)
Alberdi, A., Aizpurua, O., Aihartza, J. & Garin, I. (2016). Ecology, biogeography and evolutionary history
of the alpine long-eared bat Plecotus macrobullaris. Galemys 28: 1-14.
5)
Alberdi, A., Garin, I., Aizpurua, O. & Aihartza, J. (2012). The foraging ecology of the mountain
long-eared bat Plecotus macrobullaris
revealed with DNA mini-barcodes. PLoS ONE 7 (4): e35692: 1-10. doi: 10.1371/journal.pone.0035692.
6)
Alberdi, A., Garin, I., Aizpurua, O. & Aihartza, J. (2013).
Review on the geographic and
elevational distribution of the mountain long-eared bat Plecotus macrobullaris, completed by utilizing a
specific mist-netting technique. Acta Chiropterologica 15
(2): 451-461.
7)
Alberdi, A.,
Gilbert, M. T. P., Razgour, O., Aizpurua,
O., Aihartza, J. & Garin,
I. (2015). Contrasting population-level responses to Pleistocene climatic oscillations
in an alpine bat revealed by complete mitochondrial genomes and evolutionary
history inference. Journal of
Biogeography 42 (9): 1689-1700.
8)
Alcaldé, J., Juste, J. & Paunović,
M. (2016).
Nyctalus lasiopterus. The IUCN Red
List of Threatened Species 2016:
e.T14918A22015318.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T14918A22015318.en. Stand 30.
November 2021.
9)
Allen, G. M. (1908). Notes on Chiroptera.
Bulletin of the Museum of Comparative
Zoology at Harvard College 52
(3): 25-63.
10)
Allen, H. (1865). On a new genus of Vespertilionidae.
Proceedings of the Academy of Natural
Sciences of Philadelphia 17:
173-175.
11) Ancillotto, L., Bosso,
L., Smeraldo, S., Mori, E., Mazza, G., Herkt, M., Galimberti, A., Ramazzotti, F. & Russo, D. (2020). An African bat in Europe, Plecotus gaisleri: biogeographic and ecological insights from
molecular taxonomy and species distribution models. Ecology and Evolution 10
(12): 5785-5800.
12) Aplin, K. & Armstrong, K. D. (2017). Kerivoula muscina. The IUCN Red List of Threatened Species 2017:
e.T10979A22022252.
http://dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T10979A22022252.en. Stand 03. Dezember 2021.
13) Aplin, K. & Armstrong, K. D. (2020). Kerivoula agnella. The IUCN Red List of Threatened Species 2020:
e.T10968A21975540.
http://dx.doi.org/10.2305/IUCN.UK.2020-3.RLTS.T10968A21975540.en. Stand 03. Dezember 2021.
14) Aplin, K. & Armstrong, K. D. (2021). Kerivoula myrella. The IUCN Red List of Threatened Species 2021:
e.T10980A22022572. http://dx.doi.org/10.2305/IUCN.UK.2021-1.RLTS.T10980A22022572.en.
Stand 03. Dezember 2021.
15) Arroyo-Cabrales, J. & Álvarez-Castañeda,
S. T. (2017). Myotis ciliolabrum. The IUCN Red List of Threatened Species 2017:
e.T14153A22058110. http://dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T14153A22058110.en.
Stand 13. Dezember 2021.
16) Arroyo-Cabrales, J. & Álvarez-Castañeda,
S. T. (2017). Myotis melanorhinus. The IUCN Red List of Threatened Species 2017:
e.T136784A22033542.
http://dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T136784A22033542.en. Stand 13. Dezember 2021.
17) Arroyo-Cabrales, J., Miller, B., Reid, F., Cuarón,
A. D. & de Grammont, P. C. (2017). Myotis auriculus. The IUCN Red List of
Threatened Species 2017: e.T14145A22060698.
http://dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T14145A22060698.en. Stand 13. Dezember 2021.
18)
Aşan, N. &
Albayrak, İ. (2011).
Taxonomic status of Myotis myotis (Borkhausen, 1797) and
Myotis blythii
(Tomes, 1857) in Turkey (Mammalia: Chiroptera). Turkish Journal of Zoology 35 (3): 357-365.
19) Asari, Y. & Kimoto, Y. (2018). Bat species found during capturing and
acoustic surveys in Amami-Oshima Island, Japan. Fauna Ryukyuana
47: 1-6.
20) Asari, Y., Kimoto, Y. & Noda, K. (2021). Five
day-roosts of Myotis yanbarenis
and Murina ryukyuana on
the Amami-Oshima Island, Kagoshima, Japan. Mammalian Science 61 (1): 49-54.
21) Ashrafi, S., Rutishauser, M., Ecker, K., Obrist, M.
K., Arlettaz, R. & Bontadina,
F. (2013). Habitat selection of three cryptic Plecotus bat species
in the European Alps reveals contrasting implications for conservation. Biodiversity and Conservation 22 (12): 2751-2766.
22) Aulagnier, S. & Benda, P. (2019). Plecotus christii. The IUCN Red
List of Threatened Species 2019:
e.T44931A22045680. http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T44931A22045680.en.
Stand 24. November 2021.
23)
Baird, A.
B., Braun, J. K., Engstrom,
M. D., Holbert, A. C., Huerta, M. G., Lim, B. K.,
Mares, M. A., Patton, J. C. & Bickham, J. W. (2017).
Nuclear and mtDNA phylogenetic analyses
clarify the evolutionary history of two species of native Hawaiian bats and the
taxonomy of Lasiurini (Mammalia: Chiroptera).
PLoS ONE 12 (10): e0186085: 1-27. doi:
10.1371/journal.pone.0186085.
24)
Baird, A. B., Braun, J. K., Mares, M. A., Morales, J.
C., Patton, J. C., Tran, C. Q. & Bickham, J. W. (2015). Molecular systematic
revision of tree bats (Lasiurini): doubling the
native mammals of the Hawaiian Islands. Journal
of Mammalogy 96 (6): 1255-1274.
25) Barrett-Hamilton,
G. E. H. (1907). Descriptions of two new
species of Plecotus.
Annals and Magazine of Natural History, 7th
Series 20 (120): 520-521.
26)
Bates, P. J. J., Ratrimomanarivo, F. H., Harrison, D. L. & Goodman, S.
M. (2006). A description of a new species of Pipistrellus (Chiroptera:
Vespertilionidae) from Madagascar with a review of
related Vespertilioninae from the island. Acta Chiropterologica
8 (2): 299-324.
27) Bates, P. J.
J., Soisook, P. & Thong, V. D. (2019). Kerivoula titania. The IUCN Red List of Threatened Species 2019: e.T136817A22044302. http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T136817A22044302.en.
Stand 03. Dezember 2021.
28) Bates, P. J.
J., Struebig, M. J., Hayes, B. D., Furey, N. M., Mya, K. M., Thong, V. D., Tien, P. D., Son,
N. T., Harrison, D. L., Francis, C. M. & Csorba,
G. (2007). A new species of Kerivoula (Chiroptera:
Vespertilionidae) from Southeast Asia. Acta Chiropterologica
9 (2): 323-337.
29) Bates, P. J. J., Struebig, M. J., Rossiter, S. J., Kingston, T., Oo, S. S.
L. & Mya, K. M. (2004). A new
species of Kerivoula
(Chiroptera: Vespertilionidae)
from Myanmar (Burma). Acta Chiropterologica 6
(2): 219-226.
30) Bates, P. J.
J., Thong, V. D. & Soisook, P. (2019). Kerivoula kachinensis. The IUCN
Red List of Threatened Species 2019:
e.T136240A22001145. http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T136240A22001145.en.
Stand 03. Dezember 2021.
31) Bates, P. J.
J., Thong, V. D. & Soisook, P. (2019). Kerivoula titania. The IUCN Red List of Threatened Species 2019:
e.T136817A22044302. http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T136817A22044302.en.
Stand 03. Dezember 2021.
32)
Bekker, J.
P. & Boshamer, J. (2007). First records of Plecotus auritus (Linnaeus,
1758) and Plecotus macrobullaris
Kuzjakin,
1965 in the Republic of Macedonia. Results of a mammal survey in Galicica National Park (II). Lutra 50 (1): 43-48.
33) Benda, P.,
Dietz, C., Andreas, M., Hotový, J., Lučan, R. K., Maltby, A., Meakin,
K., Truscott, J. & Vallo, P. (2008). Bats (Mammalia: Chiroptera) of the
Eastern Mediterranean and Middle East. Part 6. Bats of Sinai (Egypt) with some
taxonomic, ecological and echolocation data on that fauna. Acta Societatis Zoologicae
Bohemicae 72
(1-2): 1-103.
34)
Benda, P. & Gvoždík, V. (2010). Taxonomy of the genus Otonycteris (Chiroptera: Vespertilionidae: Plecotini) as inferred from morphological and mtDNA data. Acta Chiropterologica 12
(1): 83-102.
35) Benda, P., Kiefer, A., Hanák,
V. & Veith, M. (2004). Systematic status of African
populations of long-eared bats, genus Plecotus (Mammalia: Chiroptera). Folia Zoologica 53 (Monograph 1): 1-47.
36)
Benda, P. & Mlíkovský, J. (2008).
Nomenclatural notes on the Asian forms of Barbastella bats (Chiroptera: Vespertilionidae). Lynx 39 (1): 31-46.
37)
Bobrinski, N. (1926). Note préliminaire
sur les Chiroptères de l’Asia
Centrale. Comptes Rendus de l’Academie des Sciences de l’URSS
A 1926: 95-98.
38)
Bogdanowicz,
W., van den Bussche, R. A., Gajewska, M., Postawa, T. & Harutyunyan, M.
(2009). Ancient and
contemporary DNA sheds light on the history of mouse-eared bats in Europe and
the Caucasus. Acta Chiropterologica
11 (2): 289-305.
39)
Borisenko, A.
V., Kruskop, S. & Ivanova, N. V. (2008). A new mouse-eared bat (Mammalia: Chiroptera: Vespertilionidae)
from Vietnam. Russian Journal of
Theriology 7 (2): 57-69.
40)
Brooks, D. M. & Bickham, J. W. (2014). New species of Scotophilus (Chiroptera: Vespertilionidae)
from Sub-Saharan Africa. Occasional
Papers Museum of Texas Tech University 326:
1-21.
41)
Budinski, I., Karapandža, B., Josipović,
V., Jovanovic, J. & Paunović, M. (2016). The first record of alpine long-eared bat Plecotus macrobullaris in Serbia. Turkish Journal of Zoology 40 (6): 984-988.
42)
Caceres, M. C. & Barclay, R. M. R. (2000). Myotis septentrionalis. Mammalian Species 32 (634): 1-4.
43) Carr, A.,
Weatherall, A., Fialas, P., Zeale,
M. R. K., Clare, E. L. & Jones, G. (2020). Moths
consumed by the barbastelle Barbastella barbastellus require larval host plants that occur
within the bat’s foraging habitats. Acta Chiropterologica 22
(2): 257-269.
44)
Cheesman, R. E.
& Hinton, M. A. C. (1924). On the mammals collected in the desert of Central Arabia by
Major R. E. Cheesman.
Annals and Magazine of Natural History, 9th
Series 14 (83): 548-558.
45)
Chen, J.,
Liu, T., Deng, H., Xiao, N. & Zhou, J. (2017). A new species of Murina bats was discovered in
Guizhou Province, China. Cave Research
2 (1): 1-10.
46) Choudhury,
A. (2016). Mammals in India. Gibbon Books, Guwahati.
47)
Cláudio, V. C.,
Barbosa, G. P., Novaes, R. L. M., Rassy,
F. B., Rocha, V. J. & Moratelli, R. (2018). Second record of Lasiurus ebenus (Chiroptera, Vespertilionidae), with comments on its taxonomic status. Zootaxa 4403 (3): 513-522.
48) Cole, T. C. H. (2015). Wörterbuch der Säugetiernamen. Springer-Verlag, Heidelberg.
49) Cooper-Bohannon, R., Fahr, J. & Jacobs, D.
(2020). Kerivoula africana. The IUCN Red
List of Threatened Species 2020:
e.T10966A21975149.
http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T10966A21975149.en. Stand 03. Dezember 2021.
50) Corbet, G. B. (1978). The mammals of the Palaearctic
region: a taxonomic review. British
Museum (Natural History), London.
51)
Corbet, G. B. & Hill, J. E. (1991). A world list of mammalian species. Third Edition. Natural History Museum Publications,
London & Oxford University Press,
Oxford.
52)
Coroiu, I., Juste, J. & Paunović, M.
(2016). Myotis myotis.
The IUCN Red
List of Threatened Species 2016: e.T14133A22051759.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T14133A22051759.en. Stand 30.
November 2021.
53)
Csorba, G. (2011). A new species of Glischropus from
the Indochinese subregion (Mammalia: Chiroptera: Vespertilionidae). Zootaxa 2925:
41-48.
54)
Csorba, G. (2020). Murina feae. The IUCN Red List of
Threatened Species 2020: e.T84561002A84561005.
http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T84561002A84561005.en. Stand 30.
November 2021.
55)
Csorba, G. &
Bates, P. J. J. (2005).
Description of a new species of Murina from Cambodia (Chiroptera: Vespertilionidae: Murinae). Acta Chiropterologica
7 (1): 1-7.
56) Csorba, G., Bumrungsri, S., Francis,
C., Bates, P., Rosell-Ambal, R. G. B., Tabaranza, B., Heaney, L., Molur, S. & Srinivasulu, C. (2019). Harpiocephalus harpia. The IUCN Red List of
Threatened Species 2019: e.T99711843A22045367.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T99711843A22045367.en. Stand 04. Dezember 2021.
57)
Csorba, G., Chou,
C.-H., Ruedi, M., Görföl, T.,
Motokawa, M., Wiantoro, S.,
Thong, V. D., Son, N. T., Lin, L.-K. & Furey, N. (2014). The reds and the yellows: a
review of Asian Chrysopteron
Jentink, 1910 (Chiroptera: Vespertilionidae:
Myotis). Journal of Mammalogy 95
(4): 663-678.
58) Csorba, G., Furey, N. & Görföl, T. (2020). Murina walstoni. The IUCN Red List of Threatened Species 2020:
e.T84562267A84562270.
http://dx.doi.org/10.2305/IUCN.UK.2020-3.RLTS.T84562267A84562270.en. Stand 04. Dezember 2021.
59) Csorba, G., Furey, N., Son, N. & Görföl, T. (2019). Murina beelzebub. The IUCN Red List of Threatened Species 2019:
e.T84488085A84488093.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T84488085A84488093.en. Stand 04. Dezember 2021.
60)
Csorba, G. &
Hutson, A. M. (2016). Nyctalus noctula. The IUCN Red
List of Threatened Species 2016: e.T14920A22015682.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T14920A22015682.en. Stand 30.
November 2021.
61) Csorba, G., Molur, S., Srinivasulu, C. & Chakravarty,
R. (2016). Harpiola grisea. The IUCN Red List of
Threatened Species 2016: e.T13941A22093890.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T13941A22093890.en. Stand 04. Dezember 2021.
62)
Csorba, G., Son,
N. T., Saveng, I. & Furey,
N. M. (2011). Revealing cryptic bat
diversity: three new Murina
and redescription of M. tubinaris from Southeast Asia. Journal of Mammalogy 92
(4): 891-904.
63) Csorba, G., Srinivasulu, B. & Srinivasulu, C. (2019). Murina huttoni. The IUCN Red
List of Threatened Species 2019:
e.T13942A22093516. http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T13942A22093516.en.
Stand 04. Dezember 2021.
64) Csorba, G., Thong,
V. D., Bates, P. J. J. & Furey, N. M. (2007). Description of a new species of Murina from Vietnam (Chiroptera: Vespertilionidae: Murinae). Occasional
Papers Museum of Texas Tech University 268:
1-12.
65)
Daniel, S., Korine, C & Pinshow, B. (2010).
Foraging behavior of desert dwelling arthopod-gleaning
bat (Otonycteris hemprichii)
during pregnancy and nursing. Acta Chiropterologica 12
(2): 293-299.
66)
Daniel, S., Korine, C. & Pinshow,
B. (2009).
The use of torpor in reproductive female Hemprich’s
long-eared bats (Otonycteris hemprichii). Physiologial and Biochemicahl
Zoology 83 (1): 142-148.
67) De Paz, O. (1994).
Systematic position of Plecotus
(Geoffroy, 1818) from the Iberian Peninsula
(Mammalia: Chiroptera). Mammalia 58 (3):
423-432.
68)
Dietrich,
S., Szameitat,
D. P., Kiefer, A., Schnitzler, H.-U. & Denzinger,
A. (2006). Echolocation signals of the plecotine bat, Plecotus macrobullaris Kuzyakin, 1965. Acta Chiropterologica
8 (2): 465-475.
69) Dietz, C. & Dietz, I. (2012). Große Abendfledermaus, Ia io Thomas, 1902. Nyctalus 17 (1-2): 213-215.
70) Dietz, C., Nill, D. & von Helversen, O.
(2016). Handbuch der Fledermäuse Europa und
Nordwestafrika. Franckh-Kosmos-Verlag,
Stuttgart.
71) Dobson, G. E. (1878). Catalogue of the Chiroptera
in the collection of the British Museum. Order of the Trustees of the British
Museum (Natural History), London.
72)
Dolch, D.,
Batsaikhan, N., Thiele, K., Burger, F. Scheffler, I.,
Kiefer, A., Mayer, F., Samjaa, R., Stubbe, A.,
Stubbe, M., Krall, L. & Steinhauser, D. (2007). Contributions to the Chiroptera of Mongolia with first evidences
on species communities and ecological niches. Erforschung biologischer Ressourcen
der Mongolei 10: 407-458.
73) Dos Santos, H. S. V. (2017). Combining molecular analyses with predictive modelling to study the
population history of Iberian cryptic bats. PhD
Thesis, University of Porto,
Porto.
74)
Douangboubpha, B. (2014). A systematic review of Kerivoula Gray, 1842 (Chiroptera:
Vespertilionidae: Kerivoulinae)
from Thailand. PhD Thesis, Prince of Songkla
University, Hat Yai.
75) Douangboubpha, B., Bumrungsri, S., Satasook, C., Wanna, W., Soisook, P. & Bates, P. J. J. (2016). Morphology, genetics and echolocation
calls of the genus Kerivoula
(Chiroptera: Vespertilionidae:
Kerivoulinae) in Thailand. Mammalia 80 (1): 21-47.
76)
Duya, M. R..,
Alvarez, J., Fidelino, J., Gatan-Balbas,
M., Pedregosa, M., Veluz,
M. J., Jakosalem, P. G., Tanalgo,
K., Mendoza, R. V., Cielo, K. L. S., Garcia, J. J. L., Cacho, M. A. &
Dionisio, T. (2019). Kerivoula whiteheadi. The IUCN Red
List of Threatened Species 2019:
e.T10987A22023276.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T10987A22023276.en. Stand 03. Dezember 2021.
77) Eger, J. L. & Lim, B. K. (2011). Three new species of Murina from southern China (Chiroptera:
Vespertilionidae). Acta Chiropterologica 13 (2): 227-243.
78) Ellermann, J. R. &
Morrison-Scott, T. C. S. (1951). Checklist of Paelaearctic
and Indian mammals 1758 to 1946. British
Museum (Natural History), London.
79)
Fahr, J. (2019). Kerivoula cuprosa. The IUCN Red
List of Threatened Species 2019:
e.T10971A21971772.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T10971A21971772.en. Stand 30.
November 2021.
80)
Fahr, J. (2019). Kerivoula eriophora. The IUCN Red
List of Threatened Species 2019:
e.T10972A21971992.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T10972A21971992.en. Stand 30.
November 2021.
81) Feng, J. & Jiang, T. L. (2019).
Myotis pequinius. The IUCN Red
List of Threatened Species 2019:
e.T14190A22066613. http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T14190A22066613.en.
Stand 23. Dezember 2021.
82)
Fenton, M. B., Shalmon, B.
& Makinc, D. (1999). Roost switching, foraging
behavior, and diet of the vespertilionid bat, Otonycteris hemprichii. Israel Journal of Zoology 45
(4): 501-506.
83) Fernandes,
M. M. (2017). Influence of land use changes on the
genetic structure of Plecotus auratus begognae
populations. M. Sc. Thesis, University of Porto, Porto.
84) Fischer, J. B. (1929). Synopsis Mammalium. J. G. Cotta, Stuttgart.
85)
Francis, C. M. & Eger, J. L. (2012). A review of tube-nosed bats (Murina) from Laos with
description of two new species. Acta Chiropterologica 14
(1): 15-38.
86)
Francis, C. M., Kingston, T. & Zubaid,
A. (2007). A new
species of Kerivoula
(Chiroptera: Vespertilionidae)
from peninsular Malaysia. Acta Chiropterologica 9
(1): 1-12.
87)
Fukui, D. (2015). Plecotus sacrimontis G. M. Allen,
1908. S. 90-91 in: Ohdachi, S. D., Ishibabshi, Y., Iwasa, M. A., Fukui, D. & Saitoh,
T. (Hrsg.) (2015). The Wild Mammals of Japan. Shoukadoh Book Sellers, Kyoto.
88) Fukui, D. (2019). Plecotus ariel. The IUCN Red
List of Threatened Species 2019:
e.T85534953A85534957.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T85534953A85534957.en. Stand 24.
November 2021.
89) Fukui, D. & Kruskop, S.
V. (2021).
Plecotus kozlovi. The IUCN Red
List of Threatened Species 2021:
e.T85535146A85535252. http://dx.doi.org/10.2305/IUCN.UK.2021-1.RLTS.T85535146A85535252.en.
Stand 24. November 2021.
90) Fukui, D. & Sano, A. (2019). Murina ryukyuana. The IUCN Red
List of Threatened Species 2019:
e.T29485A22066512. http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T29485A22066512.en.
Stand 24. November 2021.
91) Fukui, D. & Sano, A. (2019). Plecotus sacrimontis. The IUCN Red
List of Threatened Species 2019:
e.T136664A21988235.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T136664A21988235.en. Stand 27.
November 2021.
92) Fukui, D. & Sano, A. (2020). Nyctalus furvus. The IUCN Red
List of Threatened Species 2020:
e.T136765A22036466.
http://dx.doi.org/10.2305/IUCN.UK.2012-2.RLTS.T136765A22036466.en. Stand 30.
November 2021.
93) Fukui, D., Sano, A. & Kruskop, S. V. (2019). Murina hilgendorfi. The IUCN Red
List of Threatened Species 2019:
e.T136409A22017193.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T136409A22017193.en. Stand 04. Dezember 2021.
94) Fukui, D., Sano, A. & Kruskop, S. V. (2019). Myotis bombinus. The IUCN Red
List of Threatened Species 2019:
e.T14149A22061650.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T14149A22061650.en. Stand 23. Dezember 2021.
95) Fukui, D., Sano, A. & Kruskop, S. V. (2019). Nyctalus aviator. The IUCN Red
List of Threatened Species 2019:
e.T14921A22016483.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T14921A22016483.en. Stand 27.
November 2021.
96) Fukui, D., Tan Tu, V., Thanh,
H. T., Arai, S., Harada, M., Csorba, G. & Son, N.
T. (2020). First record of the genus Plecotus from Southeast Asia with
notes on the taxonomy, karyology and echolocation call
of P. homochrous
from Vietnam. Acta Chiropterologica
22 (1): 57-74.
97)
Funakoshi, K. (2010). Acoustic identification of thirteen insectivorous bat species
from the Kyushu District, Japan. Mammalian
Science 50 (2): 165-175.
98)
Funakoshi, K., Yamasita, K.,
Kitanokuchi, T., Tanaka, H., Otubo,
S., Ohira, R., Uchihara,
A., Osawa, T., Watanabe, K., Nagayama, T., Watari, Y. & Minami, T. (2019). Ecological studies on the bat species
of Tokunoshima Island and Amami-Oshima
Island, Japan, with special reference to Ryukyu tube-nosed bat, Murina ryukyuana. Mammalian Science 59 (1): 15-36.
99) Gässler, S., Hintsche, S., Hildenbrand, R. & Beutler, A. (2012). Überprüfung von Kolonien der Fledermausarten Plecotus austriacus und Eptesicus serotinus in Südbayern – Gebiete A und D. Planungsbüro Beutler, München, im Auftrag des Bayerischen Landesamts für Umwelt, Augsburg.
100)
Garin, I., García-Mudarra,
J. L., Aihartza, J. R., Goiti,
U. & Juste, J. (2003). Presence of Plecotus macrobullaris (Chiroptera: Vespertilionidae) in the Pyrenees. Acta Chiropterologica 5 (2): 243-250.
101)
Gazaryan, S. V. (2009). Distribution of Plecotus macrobullaris Kuzykin, 1965 in the Russian
Caucasus. S. 259-263 in: Rozhnov, V. V., Tembotova,
F. A., Lantzov, V. I. & Mihailov,
K. G. (Hrsg.) (2009). Animals of mountain
territories. KMK Scientific Press, Moskau.
102)
Gazaryan, S. & Godlevska, L. (2020). Plecotus auritus. The IUCN Red List of Threatened Species 2020:
eT85535522A195861341. http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T85535522A195861341.en.
Stand 25. November 2020.
103)
Gazaryan, S. & Godlevska,
L. (2021). Plecotus austriacus. The IUCN Red List of
Threatened Species 2021: e.T85533333A195862345.
http://dx.doi.org/10.2305/IUCN.UK.2021-1.RLTS.T85533333A195862345.en. Stand 23.
November 2021.
104)
Gazaryan, S., Kruskop, S. V. & Godlevska, L. (2020). Myotis nattereri. The IUCN
Red List of Threatened Species 2020: eT85733032A22052584. http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T85733032A22052584.en.
Stand 23. Dezember 2021.
105)
Gloor, S.,
Stutz, H.-P. B. & Ziswiler, V. (1995). Nutritional habits of the noctule bat Nyctalus noctula (Schreber, 1774) in Switzerland. Myotis 32-33: 231-242.
106)
Goodman, S. M., Jenkins, R. K. B. & Ratrimomanarivo, F. H. (2005). A review of the genus Scotophilus
(Mammalia, Chiroptera, Vespertilionidae)
on Madagascar, with the description of a new species. Zoosystema 27 (4): 867-882.
107)
Goodman, S. M., Kearney, T., Ratsimbazafy,
M. M. & Hassanin, A. (2017). Description of a new species of Neoromicia (Chiroptera: Vespertilionidae)
from southern Africa: A name for “N. cf. melckorum”. Zootaxa 4236 (2):
351-374.
108)
Goodman, S. M., Ratrimomanarivo,
F. H. & Randrianandrianina, F. H. (2006). A new species of Scotophilus (Chiroptera: Vespertilionidae)
from western Madagascar. Acta Chiropterologica 8
(1): 21-37.
109)
Gray, J. E. (1821). On the natural arrangement of vertebrose animals. The
London Medical Repository 15
(88): 296-310.
110)
Gray, J. E. (1838). A revision
of the genera of bats (Vespertilionidae), and the
description of some new genera and species. Magazine
of Zoology and Botany 2 (12):
483-505.
111)
Gray, J. E. (1842). Descriptions of some new
genera and fifty unrecorded species of Mammalia. Annals and Magazine of Natural History, 1st Series 10 (65): 255-267.
112)
Gromov, I. M.
& Baranova, G. A. (Hrsg.) (1981). Catalogue of mammals of USSR (Pliocene to
Recent).
113)
Han, N.-J., Zhang, J.-S., Reardon, T., Lin, L.-K.
Zhang, J.-P. & Zhang, S.-Y. (2010). Revalidation of Myotis taiwanensis Ärnbäck-Christie-Linde
1908 and its molecular relationship with M.
adversus (Horsfield
1824) (Vespertilionidae, Chiroptera).
Acta Chiropterologica
12 (2): 449-456.
114)
Happold, M. (2005). A new species of Myotis
(Chiroptera: Vespertilionidae)
from central Africa. Acta Chiropterologica 7
(1): 9-21.
115)
Happold, M. & Happold, D. C. D. (Hrsg.)
(2013). Mammals of Africa Volume IV: Hedgehogs, Shrews and Bats. Bloomsbury Publishing, London.
116)
Hasan, N. H. & Abdullah, M. T. (2011). A morphological analysis of Malaysian Kerivoula (Chiroptera,
Vespertilionidae). Mammal Study 36 (2):
87-97.
117)
He, F., Xiao, N. & Zhou, J. (2015). A new species of Murina from China (Chiroptera: Vespertilionidae). Cave
Research 2 (2): 1-6.
118) Heinicke, W. & Krauß, A. (1978). Zum Beutespektrum des Braunen Langohrs, Plecotus auritus L. Nyctalus 1 (1): 49-52.
119) Heise, G. & Schmidt, A. (1979). Wo überwintern im Norden der DDR beheimatete Abendsegler (Nyctalus noctula)? Nyctalus 1 (2): 81-84.
120)
Herd, R. M. (1987). Eletrophoretic
divergence of Myotis leibii
and Myotis ciliolabrum
(Chiroptera: Vespertilionidae).
Candian Journal of Zoology 65 (7): 1857-1860.
121)
Herdina, A. N. (2008). Light microscopy of the
penis bone (baculum) in the Plecotus species (Chiroptera) in
Austria. Diploma Thesis, Universität
Wien.
122)
Hernández-Montero,
J. R., Adam, M. & Kerth, G. (2021). Are echo-reflective cues effective to attract bats to newly placed
artificial roosts? Acta Chiropterologica 23
(1): 199-205.
123)
Holderied, M., Korine, C. & Moritz, T. (2011). Hemprich’s
long-eared bat (Otonycteris hemprichii)
as a predator of scorpions: whispering echolocation, passive gleaning
and prey selection. Journal of
Comparative Physiology A 197:
425-433.
124)
Holloway, G. L. & Barclay, R. M. R. (2001). Myotis ciliolabrum. Mammalian Species 33
(670): 1-5.
125)
Hoofer, S. R.
& van den Bussche, R. A. (2001). Phylogenetic
relationships of plecotine bats and allies based on
mitochondrial ribosomal sequences. Journal
of Mammalogy 82 (1): 131-137.
126)
Hoofer,
S. R. & van den Bussche, R. A. (2003). Molecular phylogenetics of the chiropteran
family Vespertilionidae. Acta Chiropterologica 5 (1): 1-63.
127) Horáček, I., Bogdanowicz, W. & Ðulić, B. (2004). Plecotus austriacus (Fischer, 1829) – Graues Langohr. S. 1001-1049 in: Krapp, F. (Hrsg.) (2005). Handbuch der Säugetiere Europas, Band 4/II: Fledertiere II. Aula-Verlag, Wiesbaden.
128) Horáček, I. & Ðulić, B. (2004). Plecotus auritus Linnaeus, 1758 – Braunes Langohr. S. 953-999 in: Krapp, F. (Hrsg.) (2005). Handbuch der Säugetiere Europas, Band 4/II: Fledertiere II. Aula-Verlag, Wiesbaden.
129)
Hsu, M. J. (1997). Population status and conservation of
bats (Chiroptera) in Kenting
National Park, Taiwan. Oryx 31 (4): 295-301
130)
Huang, J. C.-C., Ho, Y., Cheng, C., Chou, C. & Cheng, H.-C. (2019). Plecotus taivanus. The IUCN Red List of
Threatened Species 2019: e.T17601A21978172.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T17601A21978172.en. Stand 23.
November 2021.
131)
Huang, J. C.-C., Ho, Y.-Y. & Kuo, H.-C. (2020). Illustrated field keys to
the bats (Mammalia: Chiroptera) of Taiwan. Journal of Threatened Taxa 12 (6): 15675-15710.
132)
Huang, J. C.-C., Lim, L. S. & Chakravarty, R. (2020). Kerivoula picta. The IUCN Red
List of Threatened Species 2020:
e.T10985A22022952.
http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T10985A22022952.en. Stand 03. Dezember 2021.
133)
Huang, T., Gong, X., Wu, T.,
Peng, L., Zhang, Y., Zhang, L. & Liu, Z. (2018). New record of Murina fanjingshanensis (Chiroptera:
Vespertilionidae) in Hunan Province, China. Acta Theriologica Sinica 38
(3): 315-317.
134)
Huang, Z., Yue, Y., Thapa, S., Hu, Y., Wu., Y & Yu, W. (2019).
Mitochondrial genome of Murina shuipuensis (Chiroptera: Vespertilionidae)
from Shuifu village, Guizhou, China (type locality). Mitochondrial DNA Part B 4 (2): 2588-2590.
135)
Hutson, A. M. (2008). Phoniscus aerosa. The IUCN
Red List of Threatened Species 2008:
e.T10967A3231619.
http://dx.doi.org/10.2305/IUCN.UK.2008.RLTS.T10967A3231619.en. Stand 03. Dezember 2021.
136)
Hutson, A. M. & Kingston, T. (2021). Kerivoula papillosa. The IUCN
Red List of Threatened Species 2021:
e.T10981A22020906.
http://dx.doi.org/10.2305/IUCN.UK.2021-1.RLTS.T10981A22020906.en. Stand 03. Dezember 2021.
137) Hutterer, R., Ivanova, T., Meyer-Cord, C. & Rodrigues, L. (2005). Bat Migrations in Europe. Naturschutz und Biologische Vielfalt 28: 1-162.
138)
Ibañez, C. & Fernández, R. (1985). Systematic status of the long-eared bat Plecotus teneriffae Barret-Hamilton, 1907 (Chiroptera:
Vespertilionidae). Säugetierkundliche Mitteilungen 32 (2): 143-149.
139)
Ibáñez, C & Juste, J. (2017). Myotis escalerai. The IUCN Red List of Threatened Species 2017: e.T85733126A85733299.
http://dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T85733126A85733299.en. Stand 23. Dezember 2021.
140)
Irwin, N. R. & Speakman, J. R. (2003). Azorean bats Nyctalus azoreum, cluster as they emerge from roosts, despite
the lack of avian predators. Acta Chiropterologica 5
(2): 185-192.
141)
Jacobs, D. S. & Barclay, R. M. R. (2009). Niche differentiation in two
sympatric sibling bat species, Scotophilus dinganii and Scotophilus mhlanganii. Journal
of Mammalogy 90 (4): 879-887.
142)
Jacobs, D. S., Eick, G. N.,
Schoeman, M. C. & Matthee, C. A. (2006). Cryptic species in an
insectivorous bat, Scotophilus dinganii. Journal of Mammalogy 87 (1): 161-170.
143)
Jacobs, D. S., Kelly, E. J., Mason, M. & Stoffberg, S. (2007). Thermoregulation in two free-ranging subtropical insectivorous
bat species: Scotophilus
species (Vespertilionidae). Canadian Journal of Zoology 85
(8): 883-890.
144)
Jayaraj, V. K. (2020). Phoniscus atrox. The IUCN
Red List of Threatened Species 2020:
e.T10970A21970973.
http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T10970A21970973.en. Stand 03. Dezember 2021.
145)
Jeanes, K. & Meijaard, E.
(2000). Danau Sentarum’s wildlife. Part 1. Biodiversity value and global importance
of Danau Sentarum’s
wildlife. Borneo Research Bulletin 31: 150-229.
146)
Jiang, T. L. & Feng, J. (2019). Myotis chinensis. The IUCN Red
List of Threatened Species 2019:
e.T14152A22060946.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T14152A22060946.en. Stand 23. Dezember 2021.
147)
Jiang, L., Meng, R., Liu, H., You, Z., Zhao, L., Jia, X. & Shi, H. (2019).
Complete mitochondrial genome of Chinese noctule bat, Nyctalus plancyi (Microchiroptera: Vespertilionidae). Conservation
Genetics Resources 11 (3):
259-262.
148)
Juste, J. & Alcaldé,
J. T. (2016). Plecotus teneriffae. The IUCN Red List of
Threatened Species 2016: e.T17602A1424721.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T17602A1424721.en. Stand 24.
November 2021.
149)
Juste, J., Benda,
P., Garcia-Mudarra, J. L. & Ibáñez, C. (2013). Phylogeny and systematic of Old World serotine bats (genus Eptesicus, Vespertilionidae, Chiroptera): an integrative approach. Zoologica Scripta 42 (5):
441-457.
150)
Juste, J.,
Ibáñez, C., Muñoz, J., Trujillo, D., Benda, P., Karataş,
A. & Ruedi, M. (2004). Mitochondrial phylogeography of the
long-eared bats (Plecotus)
in the Mediterranean Palaearctic and Atlantic
Islands. Molecular Phylogenetics and
Evolution 31 (3): 1114-1126.
151)
Juste, J. & Paunović, M. (2016). Myotis punicus. The IUCN Red
List of Threatened Species 2016:
e.T44864A22073410.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T44864A22073410.en. Stand 30.
November 2021.
152)
Juste, J. & Paunović, M. (2016). Nyctalus leisleri. The IUCN Red
List of Threatened Species 2016:
e.T14919A22016159. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T14919A22016159.en.
Stand 30. November 2021.
153)
Juste, J., Ruedi, M., Puechmaille, S. J., Salicini, I.
& Ibáñez, C. (2019). Two new cryptic bat species within the Myotis nattereri species complex (Vespertilionidae,
Chiroptera) from the Western Palaearctic.
Acta Chiropterologica
20 (2): 285-300.
154)
Kaňuch, P. & Cel’uch,
M. (2004). On the southern border of
the nursing area of the noctule in Central Europe. Myotis 41-42: 125-127.
155)
Kaňuch, P., Janečková, K. & Krištín,
A. (2005). Winter diet of the noctule bat Nyctalus noctula. Folia Zoologica
54 (1-2): 53-60.
156)
Karataş, A., Yiğit,
N., Çolak, E. & Kankiliç,
T. (2003). On the distribution, taxonomy and karyology of the genus Plecotus (Chiroptera:
Vespertilionidae) in Turkey. Turkish Journal of Zoology 27
(4): 293-300.
157)
Kawai,
K., Nikaido, M., Harada, M., Matsumura,
S., Lin, L.-K., Wu, Y., Hasegawa, M. & Okada, N. (2002). Intra- and interfamily relationships of Vespertilionidae
inferred by various molecular markers including SINE insertion data. Journal of Molecular Evolution 55 (3): 284-301.
158)
Khan, F. A. A., Solari, S., Swier, V. J., Larsen, P. A., Abdullah, M. T. & Baker,
R. J. (2010). Systematics of Malaysian
woolly bats (Vespertilionidae: Kerivoula) inferred from
mitochondrial, nuclear, karyotypic, and morphological data. Journal of Mammalogy 91 (5): 1058-1072.
159)
Kiefer, A. (2007). Phylogeny of Western Palaearctic long-eared bats (Mammalia, Chiroptera,
Plecotus) –
a molecular perspective. PhD Thesis,
Johannes Gutenberg-Universität, Mainz.
160)
Kiefer,
A., Mayer, F., Kosuch,
J., von Helversen, O. & Veith, M. (2002). Conflicting molecular phylognies of European
long-eared bats (Plecotus)
can be explained by cryptic diversity. Molecular
Phylogenetics and Evolution 25
(3): 557-566.
161) Kiefer, A. & Mucedda, M. (2004). Plecotus sardus Mucedda, Kiefer, Pidinchedda & Veith, 2002 – Sardisches Langohr. S. 1067-1070 in: Krapp, F. (Hrsg.) (2005). Handbuch der Säugetiere Europas, Band 4/II: Fledertiere II. Aula-Verlag, Wiesbaden.
162)
Kiefer, A. & Veith, M. (2001). A new species of long-eared bat from Europe (Chiroptera:
Vespertilionidae). Myotis 39: 5-16.
163) Kiefer, A. & von Helversen, O. (2004). Plecotus kolombatovici (Ðulić, 1980) – Balkanlangohr. S. 1059-1066 in: Krapp, F. (Hrsg.) (2005). Handbuch der Säugetiere Europas, Band 4/II: Fledertiere II. Aula-Verlag, Wiesbaden.
164) Kiefer, A. & von Helversen, O. (2004). Plecotus macrobullaris (Kuzjakin, 1965) – Alpenlangohr. S. 1051-1058 in: Krapp, F. (Hrsg.) (2005). Handbuch der Säugetiere Europas, Band 4/II: Fledertiere II. Aula-Verlag, Wiesbaden.
165)
Koopman, K. F. & McCracken, G. F. (1998). The taxonomic status of Lasiurus
(Chiroptera: Vespertilionidae)
in the Galapagos Islands. American Musuem Novitates 3243: 1-8.
166)
Koubínová, D., Irwin,
N., Hulva, P., Koubek, P.
& Zima, J. (2013).
Hidden diversity in Senegalese bats and associated findings in the systematic
of the family Vespertilionidae. Frontiers in Zoology 10:
48: 1-16.
167) Krapp, F. (Hrsg.) (2011). Die Fledermäuse Europas. Aula-Verlag, Wiebelsheim.
168)
Kruskop, S. V.,
Artyushin, I. V., Yuzefovich,
A. P., Undrakhbayar, E., Speranskya,
A. S., Lisenkova, A. A., Bannikova,
A. & Lebedev, V. S. (2020). Genetic diversity of Mongolian
long-eared bats (Plecotus;
Vespertilionidae; Chiroptera).
Acta Chiropterologica
22 (2): 243-255.
169)
Kruskop, S. V. & Fukui, D. (2019). Plecotus ognevi. The IUCN Red
List of Threatened Species 2019:
e.T136598A21996784.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T136598A21996784.en. Stand 27.
November 2021.
170)
Kruskop, S. V., Kawai, K.
& Tiunov, M. (2019). Taxonomic status of the barbastelles (Chiroptera: Vespertilionidae: Barbastella) from
the Japanese archipelago and Kunashir Island. Zootaxa 4567 (3): 461-476.
171)
Kruskop, S. V.
& Lavrenchenko, L. A. (2000). A new species of long-eared
bat (Plecotus;
Vespertilionidae, Mammalia) from Ethiopia. Myotis 38: 5-17
172)
Kruskop, S. V.
& Solovyeva, E. N. (2021). Validating the
relationships: which species of Myotis
“nattereri” group (Chiroptera: Vespertilionidae) actually inhabits the Caucasus. Mammalia 85 (1): 90-99.
173)
Kuo, H.-C. (2012). Phylogeography
and diversification of Taiwanese bats. PhD
Thesis, University of London.
174)
Kuo, H.-C.,
Chen, S.-F., Fang, Y.-P., Cotton, J.A., Parker, J. D., Csorba,
G., Lim, B. K., Eger, J. L., Chen, C.-H., Chou, C.-H. & Rossiter, S. J. (2015). Speciation processes in
putative island endemic sister bat species: false impressions from
mitochondrial DNA and microsatellite data. Molecular
Ecology 24 (23): 5910-5926.
175)
Kuo, H.-C.,
Chen, S.-F., Fang, Y.-P., Flanders, J. & Rossiter, S. J. (2014). Comparative rangewide phylogeography of four
endemic Taiwanese bat species. Molecular
Ecology 23 (14): 3566-3586.
176)
Kuo, H.-C.,
Fang, Y.-P., Csorba, G. & Lee, L.-L. (2006). The definition of Harpiola (Vespertilionidae: Murinae) and the description of a new species from Taiwan. Acta Chiropterologica
8 (1): 11-19.
177)
Kuo, H.-C., Fang, Y.-P., Csorba,
G. & Lee, L.-L. (2009). Three new species of Murina (Chiroptera: Vespertilionidae)
from Taiwan. Journal of Mammalogy 90 (4): 980-991.
178)
Kuo, H. & Huang, J. C.-C. (2020).
Harpiola isodon. The IUCN Red
List of Threatened Species 2020:
e.T136445A21983827.
http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T136445A21983827.en. Stand 04. Dezember 2021.
179)
Kuo, H.-C., Soisook, P., Ho, Y.-Y., Csorba,
G., Wang, C.-N. & Rossiter, S. J. (2017). A taxonomic revision of the Kerivoula hardwickii
complex (Chiroptera: Vespertilionidae)
with the description of a new species. Acta
Chiropterologica 19 (1): 19-39.
180)
Kurdyukova, I.
V. & Kruskop, S. V. (2017). Desert long-eared bats (Plecotus, Vespertilionidae) of the
Central Asia: results from craniometry. Plecotus et al. 20: 68-76.
181)
Kutt, A. &
Schulz, M. (2000). Distribution and habitat of
the flute-nosed bat Murina florium (Chiroptera: Vespertilionidae) in
the wet tropics of north-eastern Queensland. Australian Zoologist 31
(3): 458-467.
182)
Lack, J.
B., Roehrs, Z. P., Stanley Jr., C. E., Ruedi, M. & van den Bussche, R. A. (2010).
Molecular phylogenetics of Myotis indicate familial-level
divergence for the genus Cistugo
(Chiroptera). Journal
of Mammalogy 91 (4): 976-992.
183)
Larsen, R. J., Knapp, M. C., Genoways, H. H., Khan, F.
A. A., Larsen, P. A., Wilson, D. E. & Baker, R. J. (2012). Genetic diversity of neotropical Myotis (Chiroptera:
Vespertilionidae) with an emphasis on South American
species. PLoS ONE 7 (10): e46578: 1-9.
184)
Larsen, R. J., Larsen, P. A., Genoways, H. H., Catzeflis, F. M., Geluso, K., Kwiecinski, G. G., Pedersen, S. C., Simal, F. & Baker,
R. J. (2012).
Evolutionary history of Caribbean species of Myotis, with evidence of a third Lesser Antillean endemic. Mammalian Biology 77 (2): 124-134.
185)
Lee, L. & Kuo, H. (2017). Murina bicolor. The IUCN Red
List of Threatened Species 2017:
e.T84488443A84488449. http://dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T84488443A84488449.en.
Stand 04. Dezember 2021.
186)
Lee, L. & Kuo, H. (2017). Murina gracilis. The IUCN Red
List of Threatened Species 2017:
e.T84500832A84500835. http://dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T84500832A84500835.en.
Stand 04. Dezember 2021.
187)
Lee, L. & Kuo, H. (2017). Murina recondita. The IUCN Red
List of Threatened Species 2017:
e.T84500842A84500845.
http://dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T84500842A84500845.en. Stand 04. Dezember 2021.
188)
Lesson, R. P.
(1827). Manuel de mammalogie, ou
histoire naturelle des mammiferes. J. B. Bailliere et Fils, Paris.
189)
Li, F., Wang, X.-Y., Yu, W.-H., Hu, Y.-F., Guo, W.-J., Li, Y.-C. & Wu, Y. (2017). Discovery of
Murina lorelieae
beyond its type localityy – a new Murina record from Yunnan, China.
Chinese Journal of Zoology 52 (5): 727-736.
190)
Li, F., Yu,
W.-H., Wu, Y., Chen, B.-C., Zhang, Q.-P., Harada, M., Motokawa,
M., Wang, Y.-Y. & Li, Y. (2016).
Discovery of
Titania’s bat (Kerivoula titania) in Guangdong Province (China)
and its echolocation calls. Chinese
Journal of Zoology 51 (1):
14-21.
191)
Lin, L.-K., Lee, L.-L. &
Cheng, H.-C. (1997). Bats of Taiwan. National Museum of Natural Science, Taichung.
192)
Lin, L.-K., Motokawa, M. & Harada, M. (2002). Karyology
of ten vespertilionid bats (Chiroptera: Vespertilionidae) from Taiwan. Zoological Studies 41
(4): 347-354.
193)
Linnaeus, C. (1758).
Systema naturae per regna tria naturae, secundum
classes, ordines, genera, species, cum characteribus,
differentiis, synonymis, locis – Editio decima, reformata – Tomus I. Lars Salvi, Stockholm.
194)
Liu, Y. & Wang, P. (2021). A new record of Murina fanjingshanensis
(Chiroptera: Vespertilionidae)
in Sichuan Province, China. Journal of
Sichuan Forestry Science and Technology 42 (1): 1-4.
195)
Loyd, A. M. & Pennay,
M. (2021). Phoniscus papuensis. The IUCN Red List of
Threatened Species 2021: e.T10982A22021190.
http://dx.doi.org/10.2305/IUCN.UK.2021-1.RLTS.T10982A22021190.en. Stand 03. Dezember 2021.
196)
Maeda, K. & Matsumura, S. (1998). Two new species of
vespertilionid bats, Myotis and Murina (Vespertilionidae: Chiroptera)
from Yanbaru, Okinawa Island, Okinawa Prefecture, Japan. Zoological Science 15
(2): 301-307.
197)
Málaga, B. A., Díaz, D. R., Arias, S. & Medina, C.
E. (2020). A new species of Lasiurus (Chiroptera:
Vespertilionidae) from southwestern Peru. Revista Mexicana de Biodiversidad
91: e913096: 1-14.
198)
Mamani-Contreras, R. & Aragón-Alvarado, G. (2021). First record of Lasiurus arequipae in the Department of
Tacna, Perú. Therya Notes 2: 143-146.
199)
Martino, V. & Martino, E. (1940). Preliminary notes on five
new mammals from Jugoslavia. Annals and Magazine of Natural History, 11th Series 5 (30): 493-498.
200)
Mayer, F.,
Dietz, C. & Kiefer, A. (2007). Molecular
species identification boosts bat diversity. Frontiers in Zoology 4
(4): 1-5 doi:10.1186/1742-9994-4-4.
201)
McMurtrie, H. (1831). Appendix of the American
editor. S. 431-439 in: Cuvier, G.
& Mcmurtrie, H. (1831). The Animal Kingdom arranged in
conformity with its organization, Volume I. G
& C & H. Carvill, New York.
202) Meinig, H., Boye, P., Dähne, M., Hutterer, R. & Lang, J. (2020). Rote Liste und Gesamtartenliste der Säugetiere (Mammalia) Deutschlands. Naturschutz und Biologische Vielfalt 170 (2): 1-73.
203) Meschede, A., Schorcht, W., Karst, I., Biedermann, M., Fuchs, D., Bontadina, F. (2017). Wanderrouten der Fledermäuse. BfN-Skripten 453: 1-236.
204)
Miller, G. S. Jr. (1905). A new genus of bats from
Sumatra. Proceedings of the Biological
Society of Washington 18:
229-230.
205)
Miller, G. S. Jr. (1907). The families and genera of bats. Bulletin of the United States National Museum 57: 1-282.
206)
Miller, G.
S. Jr. & Allen, G. M. (1928). The American bats of the genera Myotis and Pizonyx. Bulletin of the United States National Museum 144: 1-218.
207)
Monadjem, A.
& Fahr, J. (2017). Kerivoula phalaena. The IUCN Red List of Threatened Species 2017:
e.T10984A22021608.
http://dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T10984A22021608.en. Stand 30.
November 2021.
208)
Monadjem, A.
& Fahr, J. (2017). Kerivoula smithii. The IUCN Red List of Threatened Species 2017:
e.T10986A22023189.
http://dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T10986A22023189.en. Stand 30.
November 2021.
209)
Monadjem, A.,
Richards, L., Taylor, P. J. & Stoffberg, S. (2013). High diversity of pipistrelloid bats (Vespertilionidae:
Hypsugo, Neoromicia, and Pipistrellus) in a West African
rainforest with the description of a new species. Zoological Journal of the Linnean Society 167 (1): 191-207.
210)
Monadjem, A., Taylor, P. J., Jacobs, D. & Cotterill, F. (2017). Kerivoula argentata. The IUCN Red List of Threatened Species 2017: e.T10969A21970780.
http://dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T10969A21970780.en. Stand 03. Dezember 2021.
211)
Monadjem, A., Taylor, P. J., Jacobs, D. &
Cotterill, F. (2017). Kerivoula lanosa. The IUCN Red
List of Threatened Species 2017:
e.T10977A22021700.
http://dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T10977A22021700.en. Stand 03. Dezember 2021.
212)
Moratelli, R., Burgin, C. J., Cláudio,
V. C., Novaes, R. L. M., López-Baucells,
A. & Haslauer, R. (2019). Family Vespertilionidae
(Vesper Bats). S. 716-981 in: Wilson, D.
E. & Mittermeier, R. A. (Hrsg.) (2019).
Handbook of the Mammals of the World Volume 9 – Bats. Lynx Edicions, Barcelona.
213)
Moratelli, R., Burgin, C. J., Cláudio,
V. C., Novaes, R. L. M., López-Baucells,
A. & Haslauer, R. (2020). Family Vespertilionidae
(Vesper Bats). S. 212-279 in: Burgin, C. J.,
Wilson, D. E., Mittermeier, R. A., Rylands, A. B., Lacher, T. E. & Sechrest,
W. (Hrsg.) (2020). Illustrated Checklist of the
Mammals of the World, Volume 2. Lynx Edicions, Barcelona.
214)
Moratelli, R., Peracchi, A. L., Dias, D. & de Oliveira, J. A. (2011). Geographic variation in
South American populations of Myotis
nigricans (Schinz, 1821) (Chiroptera,
Vespertilionidae), with the description of two new
species. Mammalian Biology 76 (5): 592-607.
215)
Moratelli, R. &
Wilson, D. E. (2011). A
new species of Myotis Kaup, 1829 (Chiroptera, Vespertilionidae) from Ecuador. Mammalian Biology 76
(5): 608-614.
216)
Moussy, C. (2011). Selection of old stone
buildings as summer day roost by the brown long-eared bat Plecotus auritus. Acta Chiropterologica 13 (1): 101-111.
217)
Mucedda, M., Kiefer, A., Pidinchedda,
E. & Veith, M. (2002). A new species of long-eared bat (Chiroptera,
Vespertilionidae) from Sardinia (Italy). Acta Chiropterologica
4 (2): 121-135.
218)
Nor Zalipah, M. (2020). Kerivoula intermedia. The IUCN Red List of Threatened Species 2020:
e.T10975A21974054. http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T10975A21974054.en.
Stand 03. Dezember 2021.
219)
Nor Zalipah, M. (2020). Kerivoula krauensis. The IUCN Red List of Threatened Species 2020:
e.T136572A21992300. http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T136572A21992300.en.
Stand 03. Dezember 2021.
220)
Nor Zalipah, M. (2020). Kerivoula minuta. The IUCN Red List of
Threatened Species 2020: e.T10978A22022086.
http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T10978A22022086.en. Stand 03. Dezember 2021.
221)
Nor Zalipah, M. (2020). Kerivoula pellucida. The IUCN Red List of Threatened Species 2020:
e.T10983A22021330.
http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T10983A22021330.en. Stand 03. Dezember 2021.
222) Ogneff, S. I. & Heptner, W. G. (1928). Einige Mitteilungen über die Säugetiere des mittleren Kopet-Dag und der anliegenden Ebene (Russisch-Turkestan). Zoologischer Anzeiger 75 (11-12): 258-266.
223)
Ognev, S. I. (1928). Mammals of Eastern Europe
and Northern Asia, Volume 1. Moskau.
224)
Oo, S. S. L.,
Kingston, T., Francis, C., Rosell-Ambal, R. G. B.
& Tabaranza, B. (2019). Phoniscus jagorii. The IUCN Red List of Threatened Species 2019: e.T10976A21974660.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T10976A21974660.en. Stand 03. Dezember 2021.
225)
Ossa, G.,
Díaz, M. M. & Barquez, R. M. (2019). Lasiurus varius (Chiroptera: Vespertilionidae).
Mammalian Species 51 (983): 119-127.
226)
Palmeirim, J. M. (1991). A morphometric assessment of the systematic position of the Nyctalus from Azore and Madeira
(Mammalia: Chiroptera). Mammalia 55 (3): 381-388.
227)
Parnaby, H. E. (2009). A taxonomic review of
Australian greater long-eared bats previously known as Nyctophilus timoriensis (Chiroptera:
Vespertilionidae) and some associated taxa. Australian Zoologist 35 (1): 39-81.
228)
Pavlinov, I. Y. & Rossolimo, O. L. (1987). Systematics of Mammals of the USSR. Archives of Zoological Museum Moscow State
University 25: 1-285.
229)
Pestano, J., Brown, R. Suárez, N., Benzal, J. & Fajardo, S. (2003).
Intraspecific evolution of Canary Island plecotine
bats, based on mtDNA sequences. Heredity 90 (4):
302-307.
230)
Peters, W. (1859). Neue Beiträge zur Kenntnis der Chiropteren.
Monatsberichte der Königlich-Preußischen
Akademie der Wissenschaften zu Berlin 4
(2): 222-225.
231)
Peters, W. (1872). Mitteilungen über neue Flederthiere
(Phyllorhina micropus, Harpyiocephalus huttonii, Murina grisea, Vesperugo micropus, Vesperus (Marsipoloemus) albigularis, Vesperus propinquus, tenuipinnis). Monatsberichte der Königlich-Preußischen
Akademie der Wissenschaften zu Berlin 17
(4): 256-264.
232)
Piraccini, R. (2016). Myotis schaubi. The IUCN Red List of
Threatened Species 2016: e.T14198A22061746.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T14198A22061746.en. Stand 23. Dezember 2021.
233)
Piraccini, R. (2016). Nyctalus azoreum. The IUCN Red List of Threatened Species 2016:
e.T14922A546843.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T14922A546843.en. Stand 30.
November 2021.
234)
Piraccini, R. (2016). Plecotus sardus. The IUCN Red List of Threatened Species 2016:
e.T136503A518549. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T136503A518549.en.
Stand 23. November 2021.
235)
Preatoni, D. G., Spada, M., Wauters,
L. A., Tosi, G. & Martinoli, A. (2011). Habitat use in the female Alpine long-eared bat (Plecotus macrobullaris):
does breeding make the difference? Acta Chiropterologica 13
(2): 355-364.
236)
Preble, J. H., Vincenot, C. & Ohte, N. (2020). Ecology and conservation of
rare bats: tracking, distribution and diet of the
Yanbaru whiskered bat Myotis yanbarensis and Ryukyu tube-nosed bat Murina ryukyuana. Annual Report of Pro Natura Foundation Japan
29: 231-237.
237)
Puechmaille, S. J., Allegrini, B., Boston, E. S. M., Dubourg-Savage, M.-J.,
Evin, A., Knochel, Bris, Y. L., A., Lecoq, V.,
Lemaire, M., Rist, D. & Teeling, E. C. (2012). Genetic analyses reveal further cryptic
lineages within the Myotis nattereri
species complex. Mammalian Biology 77 (3): 22-228.
238)
Quian, K., Yu, D., Cheng, H., Storey, K. B. & Zhang, J. (2016). The complete mitochondrial genome of Nyctalus noctula (Chiroptera:
Vespertilionidae). Mitochondrial DNA Part A 27
(4): 2365-2366.
239)
Qumsiyeh, M. B.
& Bickham, J. W. (1993). Chromosomes and relationships of
long-eared bats of the genera Plecotus and Otonycteris. Journal
of Mammalogy 74 (2): 376-382.
240) Roberts, T. J. (1977). Mammals in Pakistan. Ernest Benn Limited, London.
241)
Rodríguez-San
Pedro, A. & Allendes, J. L. (2016). Lasiurus borealis (Müller, 1776): una
especie erróneamente reconocida dentro de la quiropterofauna de Chile. Biodiversity and Natural History 2
(1): 10-12.
242)
Roehrs, Z.
P., Lack, J. B. & van den Bussche, R. A. (2010). Tribal phylogenetic relationships within Vespertilionidae (Chiroptera Vespertilionidae) based on mitochondrial and nuclear
sequence data. Journal of Mammalogy 91 (5): 1073-1092.
243)
Rosina, V. V. (2015). First
Neogene Otonycteris (Chiroptera:
Vespertilionidae) from Ukraine: its biostratigraphic and paleographic significance. Palaeovertebrata 39 (1): e2: 1-13.
244)
Ruczyński, I. & Bogdanowicz W. (2005). Roost cavity selection by Nyctalus noctula and N. leisleri (Vespertilionidae, Chiroptera) in Białowieża Primeval Forest, Eastern Poland. Journal of Mammalogy 86 (5): 921-930.
245)
Rudolph, B. U., Boye, P.,
Hammer, M., Kraft, R., Wölfl, M. & Zahn, A. (2017). Rote
Liste und kommentierte Gesamtartenliste der Säugetiere (Mammalia) Bayern. Bayerisches Landesamt für Umwelt,
Augsburg.
246)
Ruedi, M., Biswas, J. & Csorba, G. (2012). Bats from the wet: two new
species of tube-nosed bats (Chiroptera: Vespertilionidae) from Meghalaya, India. Revue Suisse de Zoologie
119 (1): 111-135.
247)
Ruedi, M. & Csorba, G. (2017). Murina jaintiana. The IUCN Red List of
Threatened Species 2017: e.T84547975A84547978
http://dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T84547975A84547978.en. Stand 04. Dezember 2021.
248)
Ruedi, M. & Csorba, G. (2017). Murina pluvialis. The IUCN Red List of
Threatened Species 2017: e.T84548064A84548082
http://dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T84548064A84548082.en. Stand 04. Dezember 2021.
249)
Ruedi, M., Csorba, G., Lin, L.-K. & Chou, C.-H. (2015). Molecular phylogeny and morphological
revision of Myotis bats (Chiroptera: Vespertilionidae)
from Taiwan and adjacent China. Zootaxa 3920 (1):
301-342.
250)
Ruedi, M. &
Mayer, F. (2001). Molecular systematics of
bats of the genus Myotis (Vespertilionidae) suggests deterministic ecomorphological
convergences. Molecular Phylogenetics and
Evolution 21 (3): 436-448.
251)
Ruedi, M., Stadelmann, B., Gager, Y., Douzery, E. J. P., Francis, C. M., Lin, L.-K., Guillén-Servent, A. & Cibois,
A. (2013). Molecular
phylogenetic reconstructions identify East Asia as the cradle for the evolution
of the cosmopolitan genus Myotis
(Mammalia, Chiroptera). Molecular Phylogenetics and Evolution 69 (3): 437-449.
252)
Ruedi, M.,
Tupinier, Y. & de Paz, O. (1998). First breeding record for the noctule bat (Nyctalus noctula) in
the Iberian Peninsula. Mammalia 62 (2): 301-304.
253)
Rydell, J.,
Michaelsen, T. C., Sanchez-Navarro, S. / Eklöf, J. (2021).
How to leave the church: light avoidance by
brown long-eared bats. Mammalian Biology
101 (6): 979-986.
254)
Sachanowicz, K. & Ciechanowski, M. (2006).
Plecotus macrobullaris
– new bat species for Albanian fauna (Chiroptera: Vespertilionidae). Lynx
37 (1): 241-246.
255)
Salicini, I., Ibáñez, C. & Juste,
J. (2011). Multilocus phylogeny and species delimitation within the
Natterer’s bat species complex in the Western Palearctic. Molecular Phylogenetics and Evolution 61 (3): 888-898.
256)
Salicini, I.,
Ibáñez, C. & Juste, J. (2013). Deep differentiation between
and within Mediterranean glacial refugia in a flying mammal, the Myotis nattereri bat complex. Journal of Biogeography 40 (6): 1182-1193.
257)
Santos, H., Juste, J.,
Ibáñez, C., Palmeirim, J. M., Godinho,
R., Amorim, F., Alves, P., Costa, H., de Paz, O., Pérez-Suarez, G.., Martínez-Alos, S., Jones, G. & Rebelo,
H. (2014). Influences of ecology and biogeography
on shaping the distributions of cryptic species: three bat tales in Iberia. Biological Journal of the Linnean Society
112 (1): 150-162.
258)
Satunin, K. (1909). Beiträge zur Kenntnis der
Säugetierfauna Kaukasiens und Transkaspiens. Mitteilungen des Kaukasischen Museums 4 (1-2): 269-300.
259)
Schmidt, C. (2007). Emergence behaviour of a nursery colony of Myotis brandtii (Eversmann, 1845) in Saxony. Myotis 43: 55-62.
260)
Schulz, M. & Hannah, D. (1998). Relative abundance, diet
and roost selection of the tube-nosed insect bat, Murina florium, on the Atherton Tablelands,
Australia. Wildlife Research 25 (3): 261-271.
261)
Scully, J. (1881). On the mammals of Gilgit. Proceedings of the Zoological Society of
London 49 (1):197-209.
262)
Sedlock, J. L., Heaney, L. R.,
Balete, D. S. & Ruedi, M. (2020). Philippine bats of the genus Kerivoula (Chiroptera: Vespertilionidae):
overview and assessment of variation in K.
pellucida and K whiteheadi.
Zootaxa 4755 (3): 454-490.
263)
Shi, H. Y., Yu, W. & Wu, Y. (2020). Nyctalus plancyi. The IUCN Red
List of Threatened Species 2020:
e.T136828A22044480. http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T136828A22044480.en.
Stand 30. November 2021.
264)
Simmons, N. B. (1998). A
reappraisal of interfamilial relationships of bats. S. 1-26 in: Kunz, T. H. & Racey,
P. A. (Hrsg.) (1998). Bat biology and
conservation. Smithsonian Institution
Press, Washington.
265)
Simmons, N.
B. (2005).
Order Chiroptera. In: Wilson,
D. E. & Reeder, D. M. (Hrsg.) (2005).
Mammal Species of the World. John
Hopkins University Press, Baltimore, S. 312-529.
266)
Simões, B. F., Rebelo, H., Lopes, R. J., Alves, P. C. & Harris, D. J. (2007). Patterns of genetic
diversity within and between Myotis d. daubentonii and M.
d. nathalinae derived from cytochrome b mtDNA sequence data. Acta
Chiropterologica 9 (2): 379-389.
267)
Smirnov,
D. G., Vekhnik, V. P. & Dzhamirzoyev, G. S. (2020). On the
taxonomic status of the Asian barbastelle (Chiroptera:
Vespertilionidae: Barbastella) in the Eastern
Caucasus. Plecotus et al. 23: 3-12.
268)
Smirnov, D. G., Vekhnik, V. P., Dzhamirzoyev, G. S. & Titov,
S. V. (2020). On the taxonomic status of species from the group “Myotis nattereri” (Chiroptera,
Vespertilionidae) in the Eastern Caucasus. Nature Conservation Research 5 (4): 1-13.
269)
Smith, A.
T. & Xie, Y. (Hrsg.) (2008). A Guide to the Mammals of
China. Princeton University Press,
Princeton.
270)
Smith, A.
T. & Xie, Y. (Hrsg.) (2013). Mammals of China. Princeton University Press, Princeton.
271)
Soisook, P., Bumrungsri, S., Dejtaradol, A.,
Francis, C. M., Csorba, G., Guillén-Servent,
A. & Bates, P. J. J. (2007). First records of Kerivoula kachinensis (Chiroptera: Vespertilionidae)
from Cambodia, Lao PDR and Thailand. Acta Chiropterologica
9 (2): 339-345.
272)
Soisook, P., Karapan, S., Satasook, C. & Bates, P. J. J. (2013). A new species of Murina (Mammalia: Chiroptera: Vespertilionidae) from peninsular Thailand. Zootaxa 3746 (4): 567-579.
273)
Soisook, P., Karapan, S., Satasook, C., Thong, V. D., Khan, F. A. A., Maryanto, I., Csorba, G., Furey, N., Aul, B. & Bates, P. J. J. (2013).
A review of the Murina cyclotis
complex (Chiroptera: Vespertilionidae)
with descriptions of a new species and subspecies. Acta Chiropterologica 15 (2): 271-292.
274)
Soisook, P., Thaw,
W. N., Kyaw, M., Oo, S. S. L., Pimsai,
A., Suarez-Rubio, M. & Renner, S. C. (2017). A new species of Murina (Chiroptera: Vespertilionidae)
from sub-Himalayan forests of northern Myanmar. Zootaxa 4320 (1): 159-172.
275)
Solari, S. (2018). Myotis leibii. The IUCN Red List of Threatened Species 2018: e.T14172A22055716.
http://dx.doi.org/10.2305/IUCN.UK.2018-2.RLTS.T14172A22055716.en. Stand 13. Dezember 2021.
276)
Solari, S. (2018). Myotis septentrionalis. The IUCN Red List of Threatened Species 2018: e.T14201A22064312.
http://dx.doi.org/10.2305/IUCN.UK.2018-2.RLTS.T14201A22064312.en. Stand 13. Dezember 2021.
277)
Son, N. T., Csorba, G., Tu, V. T., Thong, V. D.,
Wu, Y., Harada, M., Oshida, T., Endo, H. & Motokawa, M. (2015). A new species of the genus Murina (Chiroptera: Vespertilionidae)
from the Central Highlands of Vietnam with a review of the subfamily Murininae in Vietnam. Acta
Chiropterologica 17 (2): 201-232.
278)
Speakman, J. R. & Webb, P. I. (1993). Taxonomy, status
and distribution of the Azorean bat (Nyctalus azoreum). Journal
of Zoology 231 (1): 27-38.
279)
Spitzenberger, F. (2006). Erstnachweis des Kaukasischen Langohrs Plecotus macrobullaris
für die Stiermark (Chiroptera, Vespertilionidae).
Joannea Zoologie 8: 5-7.
280)
Spitzenberger, F., Haring, E.
& Tvrtković, N. (2002). Plecotus microdontus (Mammalia, Vespertilionidae), a new bat species from Austria. Natura Croatica
11 (1): 1-18.
281)
Spitzenberger, F., Strelkov,
P. & Haring, E. (2003). Morphology and mitochondrial
DNA sequences show that Plecotus alpinus Kiefer & Veith,
2002 and Plecotus microdontus Spitzenberger,
2002 are synonyms of Plecotus macrobullaris
Kuzjakin,
1965. Natura Croatica
12 (2): 39-53.
282)
Spitzenberger, F., Strelkov,
P. P., Winkler, H. & Haring, E. (2006). A preliminary revision of the genus Plecotus (Chiroptera, Vespertilionidae)
based on genetic and morphological results. Zoologica Scripta 35 (3):
187-230.
283)
Srinivasulu, C. & Srinivasulu,
B. (2019). Kerivoula lenis. The IUCN Red List of
Threatened Species 2019: e.T136428A21984385.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T136428A21984385.en. Stand 03. Dezember 2021.
284)
Srinivasulu, C. & Srinivasulu,
B. (2019). Murina tubinaris. The IUCN Red List of
Threatened Species 2019: e.T84560827A22096188. http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T84560827A22096188.en.
Stand 04. Dezember 2021.
285)
Srinivasulu, C. & Srinivasulu,
B. (2019). Nyctalus montanus. The IUCN Red List of
Threatened Species 2019: e.T14923A22016710.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T14923A22016710.en. Stand 30.
November 2021.
286)
Srinivasulu, C. & Srinivasulu,
B. (2019). Plecotus homochrous. The IUCN Red List of
Threatened Species 2019: e.T85537505A85537516.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T85537505A85537516.en. Stand 23. November
2021.
287)
Srinivasulu, C. & Srinivasulu,
B. (2019). Plecotus turkmenicus. The IUCN Red List of
Threatened Species 2019: e.T85535176A85535233.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T85535176A85535233.en. Stand 23.
November 2021.
288)
Srinivasulu, C. & Srinivasulu,
B. (2019). Scotozous dormeri. The IUCN Red List of
Threatened Species 2019: e.T17338A22129897.
http://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T17338A22129897.en. Stand 24.
November 2021.
289)
Srinivasulu, C. & Srinivasulu,
B. (2020). Plecotus strelkovi. The IUCN Red List of
Threatened Species 2020: e.T85535363A85535378.
http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T85535363A85535378.en. Stand 23.
November 2021.
290)
Srinivasulu, C. & Srinivasulu,
B. (2020). Plecotus wardi. The IUCN Red List of Threatened
Species 2020: e.T85535265A85535306.
http://dx.doi.org/10.2305/IUCN.UK.2020-3.RLTS.T85535265A85535306.en. Stand 23.
November 2021.
291)
Stadelmann, B.,
Jacobs, D. S., Schoeman, C. & Ruedi, M. (2004). Phylogeny of African Myotis bats (Chiroptera,
Vespertilionidae) inferred from cytochrome b
sequences. Acta Chiropterologica
6 (2): 177-192.
292)
Stadelmann,
B., Lin, L.-K., Kunz T. H. & Ruedi, M. (2007). Molecular phylogeny of New World Myotis (Chiroptera,
Vespertilionidae) inferred from mitochondrial and
nuclear DNA genes. Molecular Phylogeny
and Evolution 43 (1): 32-48.
293)
Stormark, J. G. (1998). Phenetic analysis of old
world Myotis (Chiroptera:
Vespertilionidae) based on dental characters. Acta Theriologica
43 (1): 1-11.
294) Stratmann, B. (1978). Faunistisch-ökologische Beobachtungen an einer Population von Nyctalus noctula im Revier Ecktannen des StFB Waren (Müritz). Nyctalus 1 (1): 2-22.
295)
Strelkov, P. P. (1988). Brown (Plecotus auritus) and grey (P. austriacus) long-eared bats (Chiroptera, Vespertilionidae) in
the USSR. Communication 1. Zoologicheskiy Zhurnal 67
(1): 90-101.
296)
Struebig, M. J., Galdikas, B.
M. F. & Suatma (2006). Bat diversity in oligotrophic
forests of southern Borneo. Oryx 40 (4): 447-455.
297)
Struebig, M.
J., Huang, J. C.-C., Mohamed, N. Z., Noerfahmy, S.,
Schöner, C. R., Schöner, M. G., Francis, C. M. (2017). Forest surveys extend the range of the Krau
woolly bat (Kerivoula krauensis) in
the Malay-Thai Peninsula, Borneo and Sumatra. Mammalia 81 (2): 211-215.
298)
Struebig, M. J., Rossiter, S. J., Bates, P. J. J.,
Kingston, T., Oo, S. S. L., Nwe,
A. A., Aung, M. M., Win, S. S. & Mya, K. M. (2005). Results of a recent bat survey in Upper Myanmar including new
records from the Kachin forests. Acta Chiropterologica 7
(1): 147-163.
299)
Stubbe, M., Ariunbold, J., Buuveibaater, V., Dorjderem, S., Monkhzul, T., Otgonbaatar, M., Tsogbadrakh, M.,
Francis, C. M., Bates, P. J. J. & Csorba, G. (2016). Murina leucogaster. The IUCN Red List of Threatened Species 2016: e.T13943A22093328.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T13943A22093328.en. Stand 04. Dezember 2021.
300)
Tang, X., Yu, W. & Wu, Y. (2020). Mitochondrial genome of the Harpiocephalus harpia (Chiroptera: Vespertilionidae)
from China. Mitochondrial DNA Part B 5 (1): 996-998.
301)
Tate, G. H. H. (1942). Results of the Archbold
Expedition No. 47. Review of the vespertilionine bats, with special attention
to genera and species of the Archbold Collections. Bulletin of the American Museum of Natural History 80 (7): 221-297.
302)
Thomas, N. M., Duckworth, J. W., Douangboubpha,
B., Williams, M. & Francis, C. M. (2013). A checklist of bats (Mammalia: Chiroptera)
from Lao PDR. Acta Chiropterologica
15 (1): 193-260.
303)
Thomas, O. (1911). New Asiatic Murdiae. Annals and
Magazine of Natural History, 8th Series 7 (38): 205-209.
304)
Thomas, O. (1911). The Duke of Bedford’s zoological
exploration of Eastern Asia. XIII. On mammals from the provinces of Kan-su and Sze-chwan, Western China. Proceedings of the Zoological Society of
London 81 (1): 158-180.
305)
Thomas, O. (1926). A new long-eared bat from Central Asia.
Annals and Magazine of Natural History, 9th
Series 18 (105): 306-308.
306)
Thong, V. D., Bumrungsri, S.,
Harrison, D. L., Pearch, M. J., Helgen,
K. M. & Bates, P. J. J. (2006). New records of
Microchiroptera (Rhinolophidae und Kerivoulinae) from Vietnam and Thailand. Acta Chiropterologica
8 (1). 83-93.
307)
Toffoli, R. & Cucco, M. (2020). Habitat suitability, connection analysis and effectiveness of
protected areas for conservation of the barbastelle bat Barbastella barabastellus in NW Italy. Acta Chiropterologica
22 (2): 271-281.
308)
Tomes, R. F. (1858). A monograph of the genus Kerivoula. Proceedings of the Zoological Society of
London 26 (1): 322-338.
309)
Trizio, I., Preatoni,
D., Chirichella, R., Mattiroli,
S., Nodari, M., Crema, S., Tosi, G. & Martinoli, A. (2005). First record of the alpine
long-eared bat (Plecotus macrobullaris
Kuzjakin,
1965) in Lombardy (Northern Italy) revealed by DNA analysis. Natura Bresciana
34: 171-175.
310)
Trouessart, E. L. (1897). Catalogus mammalium
tam viventium quam fossilium. Nova editio. Tomus I. Primates, Prosimiae, Chiroptera, Insectivora. R. Friedländer
& Sohn, Berlin.
311)
Trujillo, R. G., Patton, J. C., Schlitter, D. A. &
Bickham, J. W. (2009).
Molecular phylogenetics of the bat genus Scotophilus (Chiroptera:
Vespertilionidae): perspectives from paternally and
maternally inherited genomes. Journal of
Mammalogy 90 (3): 548-560.
312)
Tsytsulina, K., Dick,
M. H., Maeda, K. & Masuda, R. (2012). Systematics and phylogeography of the
steppe whiskered bat Myotis aurascens Kuzyakin, 1935 (Chiroptera, Vespertilionidae). Russian Journal of Theriology 11 (1): 1-20.
313)
Tsytsulina, K. &
Masuda, R. (2004).
Molecular phylogeny of whiskered bats (Myotis,
Vespertilionidae, Chiroptera)
in palaearctic region. In: Mawatari, S. F. & Okada, H. (Hrsg.).
Neo-science of natural history: integration of geosciences and biodiversity
studies. Hokkaido University,
Sapporo.
314)
Tu, V. T., Cornette, R., Utge, J. & Hassanin,
A. (2015). First records of Murina lorelieae (Chiroptera:
Vespertilionidae) from Vietnam. Mammalia 79 (2):
201-213.
315)
Tu, V. T., Csorba, G., Ruedi, M., Furey, N. M., Son, N.
T., Thong, V. D., Bonillo, C. & Hassanin, A. (2017). Comparative phylogeography of bamboo bats of the genus Tylonycteris (Chiroptera, Vespertilionidae) in
Southeast Asia. European Journal of
Taxonomy 274: 1-38.
316)
Tu, V., Furey, N. & Csorba, G. (2021). Kerivoula crypta. The IUCN Red List of
Threatened Species 2021:
e.T154196297A154196362. http://dx.doi.org/10.2305/IUCN.UK.2021-2.RLTS.T154196297A154196362.en.
Stand 03. Dezember 2021.
317)
Tu, V., Furey, N. & Csorba, G. (2021). Kerivoula depressa. The IUCN Red
List of Threatened Species 2021:
e.T154195907A154195912.
http://dx.doi.org/10.2305/IUCN.UK.2021-2.RLTS.T154195907A154195912.en. Stand
03. Dezember 2021.
318)
Tu, V., Furey, N. & Csorba, G. (2021). Kerivoula dongduongana. The IUCN Red
List of Threatened Species 2021:
e.T154195951A154195959.
http://dx.doi.org/10.2305/IUCN.UK.2021-2.RLTS.T154195951A154195959.en. Stand
03. Dezember 2021.
319)
Tu, V., Furey, N. & Csorba, G. (2021). Kerivoula furva. The IUCN Red
List of Threatened Species 2021:
e.T154196065A154196068.
http://dx.doi.org/10.2305/IUCN.UK.2021-2.RLTS.T154196065A154196068.en. Stand
03. Dezember 2021.
320)
Tu, V., Furey, N., Görföl, T. & Csorba, G. (2020). Kerivoula hardwickii. The IUCN Red
List of Threatened Species 2020:
e.T154195594A21973742.
http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T154195594A21973742.en. Stand 03.
Dezember 2021.
321)
Tu, V. T., Hassanin, A., Furey, N. M., Son, N. T. & Csorba, G. (2018). Four species in one:
multigene analyses reveal phylogenetic patterns within Hardwicke’s woolly bat, Kerivoula hardwickii-complex
(Chiroptera, Vespertilionidae)
in Asia. Hystrix
29 (1): 111-121.
322)
Tvrtković, N., Pavlinić, I. & Haring, E. (2005). Four species of long-eared bats (Plecotus, Geoffroy, 1818; Mammalia, Vespertilionidae) in Croatia: field identification and
distribution. Folia Zoologica
54 (1-2): 75-88.
323)
Uvizl, M. &
Benda, P. (2021). Diversity and distribution
of the Myotis nattereri complex (Chiroptera: Vespertilionidae) in
the Middle East: filling the gaps. Mammalian
Biology 101 (6): 963-977.
324)
Vallo, P., Benda,
P., Cervený, J. & Koubek,
P. (2013). Conflicting
mitochondrial and nuclear paraphyly in small-sized West African house bats (Vespertilionidae). Zoologica Scripta 42 (1): 1-12.
325)
Vallo, P., Benda,
P. & Reiter, A. (2011).
Yellow-bellied or white-bellied? Identity of Arabian house bats (Vespertilionidae: Scotophilus) revealed from mitochondrial DNA and morphology.
African Zoology 46 (2): 350-361.
326)
Vanitharani, J., Rajendran, A., Bates, P. J. J.,
Harrison, D. L. & Pearch, M. J. (2003). A taxonomic reassessment of Kerivoula lenis Thomas, 1916 (Chiroptera: Vespertilionidae)
including a first record from peninsular India. Acta Chiropterologica 5 (1): 49-60.
327)
Van Zyll de Jong, C. G. (1979).
Distribution and systematic relationships of long-eared Myotis in western Canada. Canadian
Journal of Zoology 57 (5):
987-994.
328)
Van Zyll de Jong, C. G. (1984). Taxonomic relationships of Nearctic
small-footed bats of the Myotis leibii group (Chiroptera: Vespertilionidae). Candian Journal of
Zoology 62 (12): 2519-2526.
329)
Volleth, M. (2006). Karyotype analysis of Murina suilla and Phoniscus atrox from Malaysia (Chiroptera:
Murininae, Kerivoulinae). Lynx 37: 275-284.
330)
Volleth, M. & Heller, K.-G. (1994). Phylogenetic relationships of
vespertilionid genera (Mammalia: Chiroptera) as
revealed by karyological analysis. Journal
of Zoological Systematics and Evolutionary Research 32 (1): 11-34.
331)
Waldien, D. L. & Wiantoro, S. (2021). Kerivoula flora. The IUCN Red
List of Threatened Species 2021: e.T10973A21972598.
http://dx.doi.org/10.2305/IUCN.UK.2021-2.RLTS.T10973A21972598.en. Stand 03. Dezember 2021.
332)
Wang, X.
Y., Zhang, Q. P., Guo, W. J., Li, F., Chen, B. C., Xu, Z. X., Wang, Y. Y., Wu, Y., Yu, W. H. & Li, Y. C. (2016). Discovery of Murina shuipuensis
outside of ist type locality – new record from
Guangdong and Jiangxi Provinces, China. Acta
Theriologica Sinica 36: 118-122.
333)
Watari, Y. & Funakoshi, K. (2013). Use of dead-leaf foliage as day-roosts by the Ryukyu tube-nosed
bat, Murina ryukyuana. Mammalian Science 53 (2): 331-334.
334)
Weller, T. J., Scott, S. A., Rodhouse,
T. J., Ormsbee, P. C. & Zinck, J. M. (2007). Field identification of the
cryptic vespertilionid bats, Myotis lucifugus and M. yumanensis. Acta Chiropterologica 9
(1): 133-147.
335) Wilhelm, M. (1978). Wochenstube von Myotis bechsteini (Kuhl). Nyctalus 1 (1): 29-32.
336) Wimmer, B. (2021). Akustische Suche nach der Nymphenfledermaus (Myotis alcathoe) in Wäldern Frankens 2019 und 2020. Bayerisches Landesamt für Umwelt, Augsburg.
337)
Wu, Y.,
Li, Y., Lin, L.-K., Harada, M., Chen, Z. & Motokawa,
M. (2012). New records of Kerivoula titania (Chiroptera: Vespertilionidae)
from Hainan Island and Taiwan. Mammal
Study 37 (1): 69-72.
338)
Wu, Y. & Yu, W. (2020). Murina fusca. The IUCN Red
List of Threatened Species 2020:
e.T13940A22094085.
http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T13940A22094085.en. Stand 03. Dezember 2021.
339)
Xu, Z., Yu, W., Wu, Y., Li, F., Chen, B., Harada, M., Motokawa, M., Gong, Y. & Li, Y. (2014). Preliminary study on population genetic structure and taxonomy
of Elery’s tube-nosed bat (Murina eleryi). Acta Theriologica Sinica
34 (3): 270-277.
340)
Yoshikura, S., Murata, K., Miyake, T., Ishihara, M.,
Nakagawa, Y. & Kamijo, T. (2009). Structure of nursery colonies and reproductive traits of the
Japanese long-eared bat, Plecotus auratus sacrimontis.
Mammalian Science 49 (2): 225-235.
341)
Yoshiyuki, M. (1979). Insect remains of a Japanese
long-eared bat, Plecotus auritus sacrimontis. Journal
of the Mammalogical Society of Japan 7
(5-6): 321-323.
342)
Yoshiyuki, M. (1991). A new
species of Plecotus
(Chiroptera, Vespertilionidae)
from Taiwan. Bulletin of the National
Science Museum, Series A 17 (4):
189-195.
343)
Yu, W.-H., Csorba, G. &
Wu, Y. (2020). Tube-nosed variations – a new species of the genus Murina (Chiroptera: Vespertilionidae)
from China. Zoological Research 41 (1): 70-77.
344)
Yu, W.-H., Li,
F., Csorba, G., Xu, Z.-X.,
Wang, X.-Y., Guo, W.-J., Li, Y.-C. & Wu, Y. (2018). A revision of Kerivoula hardwickii
and occurrence of K. furva
(Chiroptera: Vespertilionidae)
in China. Zootaxa
4461 (1): 45-56.
345)
Yu, W., Lin, C., Huang, Z., Liu, S., Wang, Q., Quan, R., Li, S. & Wu,
Y. (2022). Discovery of Kerivoula kachinensis and a validity of K. titania (Chiroptera:
Vespertilionidae) in China. Mammalia (in press).
346)
Yu, W. & Wu, Y. (2020). Murina aurata. The IUCN Red List of
Threatened Species 2020: e.T13937A22095123.
http://dx.doi.org/10.2305/IUCN.UK.2020-3.RLTS.T13937A22095123.en. Stand 03. Dezember 2021.
347)
Yu, W. & Wu, Y. (2020). Murina lorelieae. The IUCN Red List of
Threatened Species 2020: e.T84500876A84500879.
http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T84500876A84500879.en. Stand 03. Dezember 2021.
348)
Yu, W. & Wu, Y. (2020). Murina shuipuensis. The IUCN Red List of
Threatened Species 2020: e.T84501698A84501702.
http://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T84501698A84501702.en. Stand 03. Dezember 2021.
349)
Yue, Y., Huang, Z., Li, F., Thapa, S., Hu, Y., Wu, Y.
& Yu, W. (2019). The complete mitochondrial
genome of the tube-nosed bat Murina cyclotis (Chiroptera: Vespertilionidae) in China. Mitochondrial DNA Part B 4
(2): 2248-2250.
350)
Zachary,
P. R., Lack, J. B. & van den Bussche, R. A. (2010). Tribal phylogenetic relationships
within Vespertilioninae (Chiroptera:
Vespertilionidae) based on mitochondrial and nuclear
sequence data. Journal of Mammalogy 91 (5): 1073-1092.
351)
Zeng, X.,
Chen, J., Deng, H., Xiao, N. & Zhou, J. (2018). A new species of Murina
from China (Chiroptera: Vespertilionidae).
Ekoloji 27 (103): 9-16.
352)
Zhang, Q.,
Cong, H., Yu, W., Kong, L., Wang,
Y., Li, Y. & Wu, Y. (2016). The mitochondrial genome of Murina huttoni rubella
(Chiroptera: Vespertilionidae)
from China. Mitochondrial DNA Part B 1 (1): 438-440.
353)
Zhang,
J.-S., Han, N.-J., Jones, G., Lin, L.-K., Zhang, J.-P., Zhu, G.-J., Huang,
D.-W. & Zhang, S.-Y. (2007). A new species of Barbastella
(Chiroptera: Vespertilionidae)
from north China. Journal of Mammalogy
88 (6): 1393-1403.