System der
Lebewesen (Stefan Hintsche
2022)
Übersichtsbaum
Cetartiodactyla > Artiofabula > Cetruminantia
> Whippomorpha >
Cetacea > Odontoceti > Delphinida > Delphinoidea > Delphinidae
|
|
|
|
|
|
|
|
|
Delphinidae |
|
|
||||
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|||||
|
|
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|||
|
|
|
|
|
|
|
Familia
Delphinidae Gray, 1821 (Familie Meeresdelfine):
- 63 Arten.
Subfamilia
Leucopleurinae
(Unterfamilie Weißseitendelfine):
- 1 Art
Subfamilia Orcininae
Wagner, 1846 (Unterfamilie Schwertwale):
- 9 Arten
Subfamilia Lissodelphinae
Fraser & Purves,
1960 (Unterfamilie Kurzschnauzendelfine):
- 12 Arten
Subfamilia
Globicephalinae Gray,
1866 (Unterfamilie Grindwale):
- 10 Arten
Subfamilia Delphininae Gray, 1821 (Unterfamilie Echte
Delfine):
- 31 Arten
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Leucopleurinae > Leucopleurus
|
Leucopleurinae |
|
Leucopleurus |
|
|
|
|
|
Subfamilia
Leucopleurinae
(Unterfamilie Weißseitendelfine):
- 1 Art
Genus Leucopleurus Gray, 1866 (Gattung Atlantische Weißseitendelfine):
- 1 Art
Leucopleurus
acutus (J. E. Gray, 1828) (Atlantischer Weißseitendelfin/Atlantic
White-sided Dolphin):
- Fundort des Holotypus zunächst unbekannt, 1846 gibt Gray nachträglich die dänischen Färöer-Inseln an
- Beschreibung/Identifizierung: Gesamtlänge ca. 280 cm Männchen, ca. 250 cm bei Weibchen; Gewicht 235 kg Männchen, 182 kg Weibchen; Geburtslänge 110-120 cm; Geburtsgewicht ca. 25 kg; stämmiger Körper mit einer kurzen Schnauze; Rücken- und Brustflossen relativ lang und spitz zulaufend; Körperoberseite dunkelgrau bis schwarz, Flanken mit grauen Zeichnungen und im hinteren Abschnitt gelborangem Streifen, Unterseite weißlich bis hellgrau; 30-40 kleine kegelförmiger Zähne pro Kiefer
- Bestand: nicht gefährdet; ca. 100.000-150.000 Tiere
- Verbreitung: Nordatlantik (USA; Kanada; Grönland; Island; Russland; Norwegen; Schweden; Dänemark; Irland; Vereinigtes Königreich; Niederlande; Belgien; Frankreich; selten bis Spanien und Portugal)
- Biologie: häufig nahe der Kontinentalschelfkante und in Fjorden; bevorzugte Wassertemperatur liegt bei 5-16°C an der Oberfläche; häufig Großwale begleitend und auf deren Bugwellen gleitend (Finnwale, Buckelwale) oder in gemischten Gruppen mit anderen Delfinen (Grindwale; Weißschnauzendelfine); Tauchgänge meist unter einer Minute, maximal bis vier Minuten; Nahrung besteht hauptsächlich aus kleinen Schwarmfischen, Kopffüßern und Krebstieren; Schulen bestehen im Durchschnitt aus 40-60 Tieren (in isländischen und britischen Gewässern meist weniger als zehn Individuen), Gruppen mit mehr als hundert oder tausend Tieren sind selten, konnten aber schon beobachtet werden; nach einigen Studien Unterteilung in Subgruppen aus Männchen und Weibchen mit ihrem Nachwuchs einerseits und älteren Jugendlichen andererseits; Paarung findet im Westatlantik vor allem Juni/Juli statt und im Ostatlantik bis in den Herbst hinein; Geburten alle zwei Jahre nach einer Tragzeit von 11 Monaten; Entwöhnung mit 18 Monaten; Weibchen erreichen die Geschlechtsreife mit 6-12 Jahren, Männchen mit 7-11 Jahren; Höchstalter 27 Jahre bei Weibchen und 22 Jahre bei Männchen
- Literatur: Wilson & Mittermeier (2014)
Artiofabula > Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Orcininae
|
Orcininae |
|
|
|
|
Subfamilia Orcininae
Wagner, 1846 (Unterfamilie Schwertwale):
- 9 Arten
Genus Orcinus Gray, 1846 (Gattung Große Schwertwale):
- 9 Arten, viele hoch spezialisierte Ökotypen, daher tatsächliche Arten- und Unterartenzahl noch unklar.
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Orcininae > Orcinus
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
||
|
|
|
|
|||||
|
Orcinus |
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Genus Orcinus Gray, 1846 (Gattung Große Schwertwale):
- 9 Arten, viele hoch spezialisierte Ökotypen, daher tatsächliche Arten- und Unterartenzahl noch unklar; Stammbaum basierend auf den Ergebnissen von Morin et al. (2010).
- Biologie: Bei Schwertwalen ist epimeletisches Verhalten weit verbreitet. Es wurde auch alloparentale Fürsorge beobachtet. In mehreren Fällen wurden Weibchen als auch Männchen gesichtet, die über lange Zeit tote Jungtiere trugen (Bisther & Vongraven, 2022; Reggente et al., 2016).
- Literatur: Bisther & Vongraven (2022); Reggente et al. (2016).
Orcinus
sp. transient „rectipinna“ [Morin
et al., 2010] (Bigg-Schwertwal/Bigg’s Killer Whale):
- Taxonomie: Cope unterschied im Nordost-Pazifik zwei Formen von Schwertwalen. Orcinus rectipinna (Cope in Scammon, 1869) könnte sich auf die durchziehenden Bigg-Schwertwale beziehen. Zur Klärung sind noch genauere Studien notwendig.
- Beschreibung/Identifizierung: große Art, Männchen erreichen eventuell bis zu 8 m; Körper oberseits schwarz, unterseits weiß; weißer Augenfleck oft nach hinten mit leichter Abwärtsneigung; spitze Rückenflosse; geschlossener Sattelfleck, oft mit Ausdehnung nach der Mittellinie der Rückenflosse; benannt nach dem Walforscher Michael Bigg.
- Biologie: Nahrung besteht hauptsächlich aus Zwergwalen und Seehunden, daneben auch Seelöwen, Seeotter, Kälber von Großwalen, Haie, Schildkröten und Seevögel; in Schulen von 5-10, maximal 20 Tieren lebend.
- Bestand: Daten defizitär; > 250 Tiere.
-
Verbreitung: Nordpazifik.
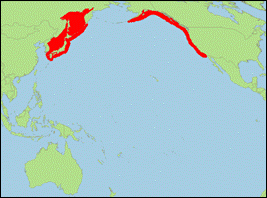
- Literatur: Morin et al. (2010); Scammon (1869, 1874).
Orcinus sp. D [Morin
et al., 2010] (Subantarktischer
Schwertwal/Subantarctic Killer Whale):
- Beschreibung/Identifizierung: mittelgroße Art, Männchen erreichen vermutlich bis zu 7,2 m; Körper oberseits schwarz, unterseits weiß; weißer Augenfleck sehr klein; stark abgerundeter Kopf; spitze, nach hinten gekrümmte Rückenflosse; schwach ausgeprägter Sattelfleck.
- Biologie: Nahrung besteht vermutlich aus verschiedenen Fischarten; schnappt zumindest gelegentlich Fische an Langleinen; Schulen bestehen im Durchschnitt aus 17 Tieren; bewohnt die subantarktische Hochsee zwischen dem 40. und 60. Breitengrad.
- Bestand: Daten defizitär.
- Verbreitung: subantarktische Meere (zirkumpolar).
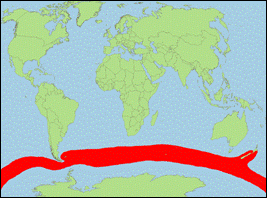
- Literatur: Morin et al. (2010).
Orcinus sp. A [Morin
et al., 2010] (Großer
Antarktischer Schwertwal/Antarctic Killer Whale):
- Beschreibung/Identifizierung: große Art, Männchen erreichen vermutlich bis zu 9,5 m; Körper oberseits schwarz, unterseits weiß; weißer Augenfleck mittelgroß; Rückenflossenspitze leicht abgerundet; gelegentlich offener, meist geschlossener Sattelfleck.
- Biologie: Nahrung besteht hauptsächlich aus Zwergwalen und Robben (v. a. See-Elefanten); im Sommer in antarktischen, eisfreien Gewässern, im Winter nach Norden wandernd, eventuell sogar bis in tropische Gewässer.
- Bestand: Daten defizitär.
-
Verbreitung: antarktische Meere (zirkumpolar;
Sommer), gemäßigte bis evtl. tropische Meere (Pazifik; Atlantik; Indischer
Ozean; Winter).
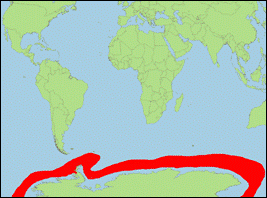
- Literatur: Morin et al. (2010).
Orcinus sp. B „glacialis” [Morin et al., 2010] (Packeis-Schwertwal/Pack
Ice Killer Whale):
-
Unterarten:
1. Großer Packeis-Schwertwal/Comman Pack Ice Killer Whale.
2. Gerlache-Schwertwal/Gerlache’s
Killer Whale.
- Taxonomie: Aktuell ist es noch unklar, ob es sich bei der Beschreibung von Orcinus glacialis Berzin & Vladimirov, 1982 um Schwertwale von Typ B oder Typ C handelt. Das gleiche gilt für Orcinus nanus Mikhalev, Ivashin, Savusin & Zelenaya, 1981.
- Identifizierung/Beschreibung: mittelgroße bis große Art, Männchen vom Großen Packeis-Schwertwal erreichen vermutlich bis zu 8 m, Männchen vom Gerlache-Schwertwal vermutlich bis zu 7 m; Körper oberseits dunkelgrau, unterseits weiß, oft mit gelblichem Belag aus Kieselalgen; weißer Augenfleck sehr groß und oval; Rückenflossenspitze leicht abgerundet; geschlossener Sattelfleck, der sich manchmal als dünne weiße Linie bis zum Augenfleck zieht.
- Biologie: Nahrung besteht beim Großen Packeis-Schwertwal hauptsächlich aus Robben (v.a. Weddell-Robbe), selten Zwergwalen; bei der Jagd werden Robben auch mit Wellen, welche von den Schwertwalen durch koordinierte Zusammenarbeit selbst erzeugt werden, von den Eisschollen geschwemmt; der Gerlache-Schwertwal ernährt sich von Pinguinen; bewohnt antarktische Küstengewässer, nahe dem Packeis.
- Bestand: Daten defizitär.
-
Verbreitung: Antarktische Meere (zirkumpolar).
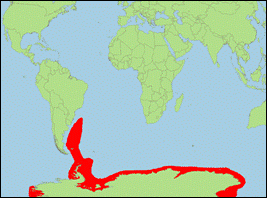
- Literatur: Berzin & Vladimirov (1982, 1983), Mikhalev et al. (1981); Morin et al. (2010).
Orcinus sp. C „nanus” [Morin et al., 2010] (Ross-Schwertwal/Ross
Sea Killer Whale):
- Taxonomie: Aktuell ist es noch unklar, ob es sich bei der Beschreibung von Orcinus glacialis Berzin & Vladimirov, 1982 um Schwertwale von Typ B oder Typ C handelt. Das gleiche gilt für Orcinus nanus Mikhalev, Ivashin, Savusin & Zelenaya, 1981.
- Beschreibung/Identifizierung: kleine Art, Männchen erreichen nur bis zu 6 m; Körper oberseits dunkelgrau, unterseits weiß, oft mit gelblichem Belag aus Kieselalgen; weißer Augenfleck nach vorne abfallend und nach hinten sich verjüngend; kleine Rückenflosse mit leicht abgerundeter Spitze; geschlossener Sattelfleck, der sich manchmal als dünne weiße Linie bis zum Augenfleck zieht.
- Biologie: Nahrung besteht vermutlich aus verschiedenen Fischarten; bewohnt antarktische Küstengewässer, nahe dem Packeis.
- Bestand: Daten defizitär.
- Verbreitung: Antarktische Meere (v.a. Ross-See).
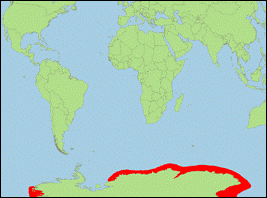
- Literatur: Berzin & Vladimirov (1982, 1983), Mikhalev et al. (1981); Morin et al. (2010).
Orcinus sp. atlantic
1 „orca” [Morin
et al., 2010] (Nordatlantischer Schwertwal/Common
North Atlantic Killer Whale):
- Taxonomie: Borowski (1780) verwendete den von Linnaeus (1758) eingeführten Artnamen Delphinus orca für die Populationen, die sich von Hering ernähren und führte für die Schwertwale, die sich von Walen ernähren, die wissenschaftliche Bezeichnung Delphinus serra ein. Demnach könnte sich der bisher allgemein für Schwertwale verwendete Name Orcinus orca auf die genetisch als Atlantik-Typ 1 bezeichnete Form beziehen. Zur Klärung sind noch genauere Studien notwendig. Vor allem ist auch die Zuordnung der Populationen von Gibraltar und den Kanarischen Inseln (Atlantik-Typ 3?) noch nicht geklärt.
- Beschreibung/Identifizierung: kleine Art, Männchen erreichen bis zu 6,6 m; Körper oberseits schwarz, unterseits weiß; weißer Augenfleck groß; Rückenflossenspitze leicht abgerundet; stark ausgeprägter, geschlossener Sattelfleck.
- Biologie: Nahrung besteht hauptsächlich aus diversen Fischarten (Makrele, Hering), die stark abgenutzten Zähne bei einigen Exemplaren deuten auch auf Haie als Beutetiere hin, deren harte Placoidschuppen zu einer starken Abnutzung der Zähne führen; gelegentlich werden eventuell auch Robben erbeutet.
- Bestand: Daten defizitär; > 3.000 Tiere.
-
Verbreitung: Nordatlantik.
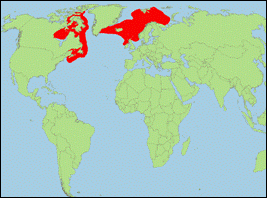
- Literatur: Borowski (1780); Linnaeus (1758); Morin et al. (2010).
Orcinus sp. atlantic 2 „serra“ [Morin
et al., 2010] (Großer
Atlantischer Schwertwal/Greater North Atlantic Killer Whale):
- Taxonomie: Borowski (1780) verwendete den von Linnaeus (1758) eingeführten Artnamen Delphinus orca für die Populationen, die sich von Hering ernähren und führte für die Schwertwale, die sich von Walen ernähren, die wissenschaftliche Bezeichnung Delphinus serra ein. Demnach könnte für die genetisch als Atlantik-Typ 2 bezeichnete Form der Name Orcinus serra angewendet werden. Zur Klärung sind noch genauere Studien notwendig. Vor allem ist auch die Zuordnung der Populationen von Gibraltar und den Kanarischen Inseln (Atlantik-Typ 3?) noch nicht geklärt.
- Beschreibung/Identifizierung: große Art, Männchen erreichen vermutlich bis zu 8,5 m; Körper oberseits schwarz, unterseits weiß; weißer Augenfleck mittelgroß, oft nach hinten abfallend; spitze Rückenflosse; Sattelfleck schwach ausgeprägt.
- Biologie: Nahrung besteht vermutlich aus anderen Walarten (v.a. Zwergwal).
- Bestand: Daten defizitär.
-
Verbreitung: Nordatlantik.
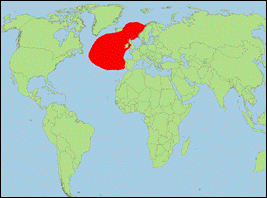
- Literatur: Borowski (1780); Linnaeus (1758); Morin et al. (2010).
Orcinus sp. offshore [Morin et al., 2010] (Pazifischer
Hochsee-Schwertwal/Offshore Killer Whale):
- Beschreibung/Identifizierung: kleine Art, Männchen erreichen vermutlich bis zu 6,7 m; Körper oberseits schwarz, unterseits weiß; weißer Augenfleck mittelgroß; deutlich abgerundete Rückenflosse, oft mit Kerben; offener oder geschlossener Sattelfleck schwach ausgeprägt; ältere Tiere mit stark abgenutzten Zähnen.
- Biologie: Nahrung besteht vermutlich hauptsächlich aus Haien, deren harte Placoidschuppen zu einer starken Abnutzung der Zähne führen; große Schulen aus 25-100 Tieren, gelegentlich bis 200; einige Gruppen wandern zwischen Alaska und Südkalifornien.
- Bestand: Daten defizitär.
-
Verbreitung: Nordpazifik.
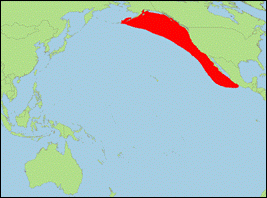
- Literatur: Morin et al. (2010).
Orcinus
sp. resident „ater“ [Morin
et al., 2010] (Pazifischer
Küsten-Schwertwal/Resident Killer Whale):
- Taxonomie: Cope unterschied im Nordost-Pazifik zwei Formen von Schwertwalen. Orcinus ater (Cope in Scammon, 1869) könnte sich auf die ortstreuen Küsten-Schwertwale beziehen. Zur Klärung sind noch genauere Studien notwendig.
- Beschreibung/Identifizierung: mittelgroße Art, Männchen erreichen bis zu 7,2 m; Körper oberseits schwarz, unterseits weiß; weißer Augenfleck mittelgroß; Rückenflossen leicht nach vorn geneigt, Spitze abgerundet, Hinterkante wellig; oft offener, ausgeprägter Sattelfleck, selten geschlossen.
- Biologie: Nahrung besteht aus verschiedenen Fischarten, einige Schulen ernähren sich allerdings nur von Lachs; in Schulen von 5-50, selten bis über 100 Tieren lebend.
- Bestand: Daten defizitär; > 1.300 Tiere.
-
Verbreitung: Nordpazifik.
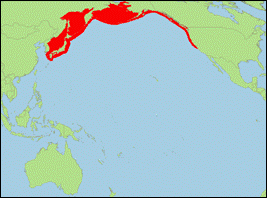
-
Literatur: Morin et al. (2010); Scammon
(1869, 1874).
Artiofabula > Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Lissodelphinae
|
|
|
|
|
|
|
Lissodelphinae |
|
|||
|
|
|
|
||
|
|
|
|||
|
|
|
|
||
|
|
|
|
|
Subfamilia Lissodelphinae
Fraser & Purves,
1960 (Unterfamilie Kurzschnauzendelfine):
- 12 Arten
Genus Lagenorhynchus Gray, 1846 (Gattung Weißschnauzendelfine):
- 1 Art
Genus
Lissodelphis
Gloger, 1841 (Gattung Glattdelfine):
- 2 Arten
Genus Cephalorhynchus Gray, 1846 (Gattung Schwarz-Weiß-Delfine):
- 9 Arten
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Lissodelphinae > Lagenorhynchus
|
Lagenorhynchus |
|
|
|
|
Genus Lagenorhynchus Gray, 1846 (Gattung Weißschnauzendelfine):
- 1 Art
Lagenorhynchus albirostris Gray, 1846 (Weißschnauzendelfin/White-beaked
Dolphin):
- Fundort des Holotypus zunächst unbekannt, 1846 gibt Gray nachträglich die Küste von Norfolk an
- Beschreibung/Identifizierung: Gesamtlänge 240-310 cm, Männchen etwas größer als Weibchen; Gewicht 180-350 kg; Geburtslänge 110-120 cm; Geburtsgewicht ca. 40 kg; stämmiger Körper mit einer kurzen Schnauze von 5-8 cm; Rücken- und Brustflossen relativ lang und spitz zulaufend; Rücken und Körperseiten dunkelgrau bis schwarz mit grauen Zeichnungen, Bauchseite und Schnauze weißlich bis hellgrau; 22-28 Paare kegelförmiger Zähne pro Kiefer; nach Schädelmerkmalen und Unterschieden in der mitochondrialen DNA lassen sich vier verschiedene Populationslinien der Art identifizieren (Nordwestatlantik, Island, nördliches Norwegen, Britische Inseln inklusive Nordsee)
- Bestand: nicht gefährdet; > 100.000 Tiere
- Verbreitung: Nordatlantik, Nordsee
- Biologie: häufig im Offenwasser nahe der Kontinentalschelfkante und darüber hinaus; bevorzugte Wassertemperatur liegt bei 5-15°C an der Oberfläche, gelegentlich nach Norden bis zur Packeisgrenze; häufig Großwale begleitend (Finnwale, Buckelwale, Seiwale) oder in gemischten Gruppen mit anderen Delfinen (Grindwale; Große Tümmler; Weißseitendelfine); Reisegeschwindigkeit bei 6-12 km/h, Maximalgeschwindigkeit 30 km/h; bei einem Individuum Tauchgänge bis 78 Sekunden nachgewiesen; Nahrung besteht hauptsächlich aus kleinen Schwarmfischen, Kopffüßern und Krebstieren; Schulen bestehen in der Regel aus weniger als 50 Tieren (in isländischen Gewässern durchschnittlich 9 Individuen, bei Dänemark 4-6), vor allem in der Hochsee gelegentlich Gruppen mit mehreren Hundert Tieren; Sozialstrukturen weitestgehend unbekannt, einige Studien lassen Gruppenunterteilungen nach Geschlecht und Altersklasse vermuten; Paarung findet vor allem zwischen Mai und September statt; Geburten hauptsächlich im Juli und August nach einer Tragzeit von 11 Monaten; Weibchen erreichen die Geschlechtsreife im Durchschnitt mit 8,7 Jahren, Männchen mit 11,6 Jahren; Höchstalter 37 Jahre
- Literatur: Wilson & Mittermeier (2014)
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Lissodelphinae > Lissodelphis
|
|
|
|
|
|
Lissodelphis |
|
|
|
|
|
|
||
|
|
|
|
Genus
Lissodelphis
Gloger, 1841 (Gattung Glattdelfine):
- 2 Arten
Lissodelphis
borealis Peale,
1848 (Nördlicher
Glattdelfin/Northern Right Whale Dolphin):
- Identifizierung/Beschreibung: Gesamtlänge Männchen bis 310 cm, Weibchen bis 230 cm; Gewicht bis 115 kg
- Bestand: nicht gefährdet
Lissodelphis
peronii (Lacépède, 1804)
(Südlicher Glattdelfin/Southern Right Whale Dolphin):
- Identifizierung/Beschreibung: Gesamtlänge bis 300 cm; Gewicht bis 116 kg
- Bestand: Daten defizitär
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Lissodelphinae > Cephalorhynchus
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
||
|
Cephalorhynchus |
|
|
||||
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|||
|
|
|
|
|
|
|
Genus Cephalorhynchus Gray, 1846 (Gattung Schwarz-Weiß-Delfine):
- 9 Arten
Cephalorhynchus obliquidens (Gill,
1865) (Weißstreifendelfin/Pacific
White-sided Dolphin):
- Vorübergehende Einordnung in Cephalorhynchus; bisher wurde die Art in der nach genetischen Untersuchungen paraphyletischen Gattung Lagenorhynchus geführt; eine Küsten- und eine Hochseeform im Westpazifik sowie eine Küsten- und eine Hochseeform im Ostpazifik, die sich genetisch und morphologisch unterscheiden
- Bestand: nicht gefährdet; ca. 900.000-1.000.000 Tiere
Cephalorhynchus obscurus (Linnaeus,
1758) (Schwarzdelfin/Dusky Dolphin):
- Vorübergehende Einordnung in Cephalorhynchus; bisher wurde die Art in der nach genetischen Untersuchungen paraphyletischen Gattung Lagenorhynchus geführt
- Unterarten: Südafrikanischer Schwarzdelfin (C. obscurus obscurus), Fitzroy-Schwarzdelfin (C. obscurus fitzroyi), Patagonischer Schwarzdelfin (C. obscurus posidonia), Neuseeland-Schwarzdelfin (C. obscurus ssp.), Australischer Schwarzdelfin (C. obscurus ssp.)
- Bestand: Daten defizitär
Cephalorhynchus heavisidii (Gray,
1828) (Heaviside-Delfin/Heaviside’s
Dolphin):
- Bestand: Daten defizitär; > 11.000 Tiere
Cephalorhynchus australis (Peale,
1848) (Peale-Delfin/Peale’s
Dolphin):
- Vorübergehende Einordnung in Cephalorhynchus; bisher wurde die Art in der nach genetischen Untersuchungen paraphyletischen Gattung Lagenorhynchus geführt
- Bestand: Daten defizitär
Cephalorhynchus cruciger (Quoy & Gaimard, 1824) (Stundenglasdelfin/Houglass Dolphin):
- Vorübergehende Einordnung in Cephalorhynchus; bisher wurde die Art in der nach genetischen Untersuchungen paraphyletischen Gattung Lagenorhynchus geführt
- Bestand: nicht gefährdet; ca. 144.300 Tiere
Cephalorhynchus commersonii (Lacépède,
1804) (Commerson-Delfin/Commerson’s Dolphin):
- Unterarten: Südamerikanischer Commerson-Delfin (C. commersonii commersonii), Kerguelen-Commerson-Delfin (C. commersonii kerguelensis)
- Bestand: Daten defizitär; > 45.000 Tiere
Cephalorhynchus eutropia Gray,
1846 (Weißbauchdelfin/Chilean
Dolphin):
- Alternative Bezeichnung: Chile-Delfin
- Bestand: gering gefährdet (Vorwarnliste)
Cephalorhynchus hectori van Beneden,
1881 (Hector-Delfin/Hector’s
Dolphin):
- Bestand: stark gefährdet; ca. 8.000 Tiere
Cephalorhynchus maui Baker, Smith & Pichler, 2002
(Maui-Delfin/Maui’s Dolphin):
- Bestand: vom Aussterben bedroht; ca. 80 Tiere
Artiofabula > Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Globicephalinae
|
|
|
|
|
|
|
|
|
|
|
Globicephalinae |
|
|
|
|
||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
Subfamilia
Globicephalinae Gray,
1866 (Unterfamilie Grindwale):
- 10 Arten
Genus Orcaella Gray, 1866 (Gattung Stupsfinnendelfine):
- 2 Arten
Genus Steno Gray, 1846 (Gattung Rauzahndelfine):
- 1 Art
Genus Grampus Gray, 1828 (Gattung Rundkopfdelfine):
- 1 Art
Genus Pseudorca Reinhardt, 1862 (Gattung Unechte Schwertwale):
- 1 Art
Genus Globicephala Gray, 1846 (Gattung Eigentliche Grindwale):
- 3 Arten
Genus Feresa Gray, 1870 (Gattung Zwerggrindwale):
- 1 Art
Genus Peponocephala Nishiwaki & Norris, 1966 (Gattung Breitschnabeldelfine):
- 1 Art
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Globicephalinae > Orcaella
|
|
|
|
|
|
Orcaella |
|
|
|
|
|
|
||
|
|
|
|
Genus Orcaella Gray, 1866 (Gattung Stupsfinnendelfine):
- 2 Arten
Orcaella
brevirostris (Owen, 1866) (Irawadi-Delfin/Irrawaddy
Dolphin):
- Bestand: gefährdet; ca. 6.000-6.500 Tiere
Orcaella heinsohni Beasley,
Robertson & Arnold, 2005 (Australischer Stupsfinnendelfin/Australian
Snubfin Dolphin):
- Alternative Bezeichnung: Australischer Stupsflossendelfin
- Bestand: gering gefährdet (Vorwarnliste); < 10.000 Tiere
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Globicephalinae > Steno
|
Steno |
|
|
|
|
Genus Steno Gray, 1846 (Gattung Rauzahndelfine):
- 1 Art
Steno bredanensis (G.
Cuvier, 1828) (Rauzahndelfin/Irrawaddy
Dolphin):
- Bestand: nicht gefährdet; > 170.000 Tiere
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Globicephalinae > Grampus
|
Grampus |
|
|
|
|
Genus Grampus Gray, 1828 (Gattung Rundkopfdelfine):
- 1 Art
Grampus griseus (G.
Cuvier, 1812) (Rundkopfdelfin/Risso’s Dolphin):
- Bestand: nicht gefährdet; ca. 320.000 Tiere
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Globicephalinae > Pseudorca
|
Pseudorca |
|
|
|
|
Genus Pseudorca Reinhardt, 1862 (Gattung Unechte Schwertwale):
- 1 Art
Pseudorca
crassidens (Owen, 1846)
(Kleiner Schwertwal/False
Killer Whale):
- Bestand: Daten defizitär; > 320.000 Tiere
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Globicephalinae > Globicephala
Genus Globicephala Gray, 1846 (Gattung Eigentliche Grindwale):
- 3 Arten
Globicephala
macrorhynchus Gray,
1846 (Kurzflossen-Grindwal/Short-finned
Pilot Whale):
- Vermutlich Artenkomplex
- Bestand: Daten defizitär; > 600.000 Tiere
Globicephala
edwardii (Smith, 1834) (Südlicher Langflossen-Grindwal/Southern Long-finned Pilot Whale):
- Bestand: Daten defizitär; > 200.000 Tiere
Globicephala
melas (Trail,
1809) (Nordatlantischer
Langflossen-Grindwal/North Atlantic Long-finned Pilot
Whale):
- Unterarten: Östlicher Langflossen-Grindwal (G. melas melas), Westlicher Langflossen-Grindwal (G. melas ssp.)
- Bestand: Daten defizitär; ca. 800.000 Tiere
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Globicephalinae > Feresa
|
Feresa |
|
|
|
|
Genus Feresa Gray, 1870 (Gattung Zwerggrindwale):
- 1 Art
Feresa attenuata Gray,
1874 (Zwerggrindwal/Pygmy Killer Whale):
- Alternative Bezeichnung: Zwergschwertwal
- Bestand: Daten defizitär; > 40.000 Tiere
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Globicephalinae > Peponocephala
|
Peponocephala |
|
|
|
|
Genus Peponocephala Nishiwaki & Norris, 1966 (Gattung Breitschnabeldelfine):
- 1 Art
Peponocephala
electra (Gray, 1846) (Breitschnabeldelfin/Melon-headed Whale):
- Bestand: nicht gefährdet; > 50.000 Tiere
Artiofabula > Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Delphininae
Subfamilia Delphininae
Gray, 1821 (Unterfamilie
Echte Delfine):
- 31 Arten
Genus
Sotalia Gray, 1866 (Gattung Sotalias):
- 2 Arten
Genus Sousa Gray, 1866 (Gattung Buckeldelfine):
- 5 Arten
Genus Stenella Gray, 1866 (Gattung Fleckendelfine):
- 2 Arten
Genus Tursiops Gervais, 1855 (Gattung Große Tümmler):
- 14 Arten
Genus Delphinus Linnaeus, 1758 (Gattung Eigentliche Delfine):
- 8 Arten
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Delphininae > Sotalia
Genus
Sotalia Gray, 1866 (Gattung Sotalias):
- 2 Arten; Generotypus Sotalia guianensis (van Bénéden, 1864).
- Taxonomie: Die Fluss- und Küstenformen der Gattung Sotalia wurden immer wieder als Unterarten Art (Nowak & Paradiso, 1983) oder lediglich als Ökotypen einer Art (Mitchell, 1975) betrachtet. Genetische (Cunha et al., 2005; Caballero et al., 2007, 2008) und morphologische Analysen (Monteiro-Filho et al., 2002; Fettuccia et al. 2009) rechtfertigen jedoch eine Unterteilung in zwei Arten, die evtl. vor ca. 3,7 Millionen Jahren voneinander getrennt wurden. Möglicherweise handelt es sich bei den Sotalia-Populationen im Orinoko ca. 300 km entfernt vom Mündungsbereich und bei der Population im südlichen Maracaibosee um weitere separate Arten (Caballero et al., 2006, 2017). Nach ersten genetischen Untersuchungen stehen die Sotalias im Orinoko S. guianensis nahe und wurden vor ca. 640.000 Jahren von dessen Küstenbeständen getrennt. Die Population im südlichen Maracaibosee geht möglicherweise auf ein Isolierungsereignis vor ca. 12.000 Jahren zurück.
-
Literatur: Caballero
et al. (2006, 2007, 2008,
2010, 2017);
Casinos,
Bisbal & Boher (1981); Cunha et al. (2005, 2010); da Silva et al. (2010); da Silva & Best (1994, 1996); Fettuccia et al. (2009); Flores & da Silva (2009); Gray
(1866); Hoorn et al. (1995);
León (2005); Meade & Koehnken
(1991); Mitchell (1975); Monteiro-Filho et al. (2002); Nowak &
Paradiso (1983);
van Bénéden (1864).
Sotalia
fluviatilis (Gervais &
Deville in
Gervais, 1853) (Amazonas-Sotalia/Tucuxi):
- Alternative Bezeichung: Tucuxi.
- Holotypus/Terra typica: Im Fluss Marañon, Loreto-Region in Peru.
- Taxonomie/Etymologie: Ursprünglich als Delphinus fluviatilis beschrieben, wobei das lateinische Epitheton fluviatilis „im Fluss lebend“ bedeutet und sich auf den Lebensraum bezieht, wurde die Art von van Bénéden & Gervais (1880) in die Gattung Sotalia gestellt.
- Synonyme: Delphinus pallidus Gervais, 1855 (bei Loreto in Peru; das lateinische Wort pallidus für „blass, hell“ bezieht sich auf die helle Färbung); Steno tucuxi Gray, 1856 (H. W. Bates sendete zwei Schädel an das Britische Museum, die aus dem Amazonas stammten, nahe Santarém, Pará in Brasilien; das Epitheton leitet sich von der brasilianischen Bezeichnung für den Amazonas-Sotalia ab).
- Bestand: Daten defizitär; ca. 5.000 Tiere.
- Verbreitung: Südamerika (Kolumbien; Ekuador; Peru; Brasilien).
- Literatur: da Silva & Best (1994, 1996); Gervais (1853, 1855); Gray (1856, 1866); Secchi (2012); van Bénéden & Gervais (1880).
Sotalia guianensis (van Bénéden, 1864) (Küsten-Sotalia/Guiana Dolphin):
- Alternative Bezeichnung: Guyana-Delfin.
- Holotypus/Terra typica: Museum Stuttgart, aus Mündungsbereich des Surinam-Flusses in Surinam.
- Taxonomie/Etymologie: Ursprünglich als Delphinus guianensis beschrieben, wobei sich der Artname auf den Fundort Surinam, das früher Niederländisch-Guyana hieß, bezieht, wurde die Art später von Gray (1866) in die neue Gattung Sotalia überstellt.
- Synonyme: Sotalia brasiliensis van Bénéden, 1875 (benannt nach dem Fundort bei Rio de Janeiro in Brasilien).
- Bestand: Potenziell gefährdet (Vorwarnliste).
- Verbreitung: Südwest-Atlantik (Honduras; Nicaragua; Costa Rica; Panama; Kolumbien; Venezuela; Guyana; Surinam; Französisch-Guayana; Trinidad und Tobago; Brasilien)
-
Literatur: da
Silva & Best (1994, 1996); de Mello et al. (2019); Gray (1866);
Maciel et al. (2020); Rodrigues et
al. (2020); Pavanato et al. (2019); Secchi, Santos & Reeves (2018); Tannure et
al. (2020); Tardin
et al. (2020); van Bénéden (1864, 1875); van Bénéden
& Gervais (1880).
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Delphininae > Sousa
Genus Sousa Gray, 1866 (Gattung Buckeldelfine):
- 5 Arten
Sousa teuszii (Kükenthal, 1892) (Kamerunflussdelfin/Atlantic Humpbacked Dolphin):
- Bestand: gefährdet; < 10.000 Tiere
Sousa sahulensis Jefferson
& Rosenbaum, 2014 (Australischer Buckeldelfin/Australian
Humpbacked Dolphin):
- Bestand: unbekannt (nicht bewertet); > 500 Tiere
Sousa plumbea (G. Cuvier, 1829) (Bleifarbener Buckeldelfin/Indian Humpbacked Dolphin):
- Alternative Bezeichnung: Indischer Buckeldelfin
- Bestand: unbekannt (nicht bewertet)
Sousa borneensis (Lydekker, 1903) (Borneo-Buckeldelfin/Bornean Humpbacked Dolphin):
- Eventuell Unterart oder Synonym von Sousa chinensis
- Bestand: unbekannt (nicht bewertet)
Sousa chinensis (Osbeck,
1765) (Chinesischer
Buckeldelfin/Chinese Hump-backed Dolphin):
- Alternative Bezeichnung: Chinesischer Weißer Delfin
- Bestand: gering gefährdet (Vorwarnliste)
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Delphininae > Stenella
|
|
|
|
|
|
Stenella |
|
|
|
|
|
|
||
|
|
|
|
Genus Stenella Gray, 1866 (Gattung Fleckendelfine):
- 2 Arten
Stenella attenuata (Gray, 1846) (Schlankdelfin/Pantropical
Spotted Dolphin):
- Unterarten: Hochsee-Schlankdelfin (S. attenuata attenuata), Küsten-Schlankdelfin (S. attenuata graffmani)
- Bestand: nicht gefährdet; > 2.500.000 Tiere
Stenella
frontalis (Cuvier,
1829) (Zügeldelfin/Atlantic
Spotted Dolphin):
- Bestand: Daten defizitär
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Delphininae > Tursiops
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||
|
Tursiops |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Genus Tursiops Gervais, 1855 (Gattung Große Tümmler):
- 14 Arten; da mehrere Ökotypen (Küsten- bis Hochseeformen) existieren, waren in den 60er Jahren schon mehr als 20 verschiedene Tümmlerarten beschrieben (Hershkovitz, 1966) worden, wobei aufgrund von Überschneidungen bei den Verbreitungsgebieten und Unsicherheiten bei der Abgrenzung anhand morphologischer Merkmale reichlich Chaos entstand, so dass sich führende Meeresbiologen 1974 darauf einigten alle Formen unter der Bezeichnung Tursiops truncatus zusammenzufassen bis bessere Methoden zur Artabgrenzung verfügbar sind (Mitchell, 1975); durch die Entwicklung von genetischen Untersuchungsmethoden gelang es in den letzten Jahren Licht in die Entstehungsgeschichte der Tümmler zu bringen und bereits einige Arten zunächst anhand genetischer Unterschiede und darauf folgend auch anhand weiterer biologischer Merkmale voneinander abzugrenzen; einige Untersuchungen deuteten sogar daraufhin, dass die Gattung Tursiops paraphyletisch ist und einige Tümmlerarten enger mit Delfinarten aus anderen Gattungen verwandt sind als mit den anderen Tümmlerarten. Darauf wurde schon diskutiert die Gattungen Tursiops, Sousa und Sotalia in die Gattung Delphinus zu integrieren. Neuere Analysen bestätigen die Gattung Tursiops hingegen als monophyletische Einheit. Der dargestellte Stammbaum orientiert sich an den Ergebnissen von Moura et al. (2020; 2013), Kita et al. (2013) und Tezanos-Pinto (2009); Nach diesen Studien entwickelten sich die Großen Tümmler im indopazifischen Raum, möglicherweise in den australasiatischen Küstengewässern. Vor 2,6-1 Mio. Jahren spaltete sich die Gattung in zwei Hauptlinien. Die Linie des Tursiops aduncus-Typs breitete sich weiter entlang der australischen und asiatischen, sowie entlang der afrikanischen Ost- und Südküste aus. Bei der zweiten Hauptlinie, dem Tursiops trunactus-Typ, handelt es sich um eine atlantische Linie, die eine mobilere Hochseeform entwickelte, von der sich dann aber weitere ; die indopazifische Linie trennte sich vor ca. 327.000 Jahren in den Indopazifischen Küstentümmler und den Südafrikanischen Tümmler, während der atlantischen Linie der Sprung an die amerikanischen Küsten gelang; dort kam es dann zu einer Aufspaltung in die Küstenart Tursiops erebennus und eine mobilere Offenwasserform, die sich in der fortlaufenden Entwicklung in weitere Arten teilte; neben einer pazifischen Linie, aus der unter anderem Tursiops nuuanu und wahrscheinlich weitere Küstenarten im pazifischen Raum hervorgingen, entstand daraus ein weiterer Zweig, der sich vor ca. 171.000 Jahren in den eigentlichen Tursiops truncatus, der auch die atlantische Hochsee bewohnt, und den im Schwarzen Meer vorkommenden Tursiops ponticus aufspaltete; aus einem anderen Ast ging vor ca. 359.000 Jahren eine europäische Linie hervor, die sich vor ca. 195.000 Jahren in den Europäischen Küstentümmler und den Mittelmeer-Tümmler teilte, wobei es aber wohl immer wieder zu Einkreuzungen von T. truncatus kam; noch unklar ist die Zuordnung der weiteren Küstenformen um die Inselgruppen im Pazifik sowie im asiatisch-pazifischen und südamerikanischen Raum, auch in der Karibik und an der westafrikanischen Küste könnte noch eine weitere Art existieren. Die wissenschaftlichen Namen können sich künftig auch noch ändern, da die Zuordnung zu den jeweiligen Holotypen oft noch nicht abgesichert ist.
- Biologie: Durch das ausgeprägte Sozialverhalten können selbst Tiere mit schweren Verletzungen und Verstümmelungen zumindest eine längere Zeit überleben. So wurde im Bereich der Insel Jejudo über 34 Monate lang ein Tier beobachtet, das seine Schwanzflosse verloren hatte und trotzdem noch am sozial-sexuellen Verhalten innerhalb der Schule teilnahm. Die Gruppen passte auch die Schwimmgeschwindigkeit an das verstümmelte Tier an (Kim et al., 2022).
- Literatur: Hershkovitz (1966); Kim et al. (2022); Louis et al. (2021).
Tursiops australis Charlton-Robb, Gershwin,
Thompson, Austin, Owen & McKechnie, 2011 (Burrunan-Delfin/Burrunan
Dolphin):
- Bestand: Potenziell gefährdet (Vorwarnliste).
Tursiops aduncus (Ehrenberg,
1832) (Südafrikanischer
Küstentümmler/South African Bottlenose Dolphin):
- Bestand: Potenziell gefährdet (Vorwarnliste).
Tursiops
catalania (Gray, 1862)
(Australasiatischer
Küstentümmler/Austral-Asian Bottlenose Dolphin):
-
Bestand: Potenziell gefährdet (Vorwarnliste).
Tursiops
perniger (Blyth, 1848)
(Indischer
Küstentümmler/Indian Bottlenose Dolphin):
- Bestand: Potenziell gefährdet (Vorwarnliste).
Tursiops erebennus Cope, 1865 (Tamanend-Küstentümmler/Tamanend’s Bottlenose Dolphin):
- Nach bisherigen genetischen Erkenntnissen könnten zukünftig eventuell drei Unterarten Ostküstentümmler, Golf-von-Mexiko-Tümmler und Bahamas-Tümmler (Rosel, Hansen & Hohn, 2009) unterschieden werden
- Bestand: Nicht bewertet; ca. 40.000 Tiere; nach Zählungen an den Küsten von Lousiana bis zum nördlichen Florida erfolgte von 1993 bis 2012 ein Bestandsrückgang um ca. 41 Prozent (Waring et al., 2013); Gefährdung durch Krankheiten (z.B. Morbilliviren; durch die im Sommer 2013 ausgebrochene Morbillivirus-Epidemie sind bislang ca. 2,5 Prozent des Artbestandes gestorben), Fischerei (bei einem Forschungsprojekt in der Sarasota-Bucht waren 2 Prozent der untersuchten Tiere in Fischernetzen ums Leben gekommen), Überfischung, Giftstoffe (besonders die Population im Indian-River-System ist akut durch Quecksilber, Algengifte, Antibiotika-resistente Bakterien und Tumorerkrankungen gefährdet), Bootsunfälle (zahlreiche Tiere weisen Verletzungen durch Bootsschrauben auf, v.a. für Jungtiere können solcher Verletzungen tödlich enden)
- Verbreitung: Nordwest-Atlantik (Atlantikküste Nordamerikas, Golf von Mexiko).
- Biologie: Lebensweise ortstreu oder saisonal ortstreu mit Wechsel zwischen Winter- und Sommerrevier (jahreszeitliche Abwanderung der Beutefische; Leatherwood & Reeves, 1990); maximale Entfernung vom Ufer meist 7,5 km; kleine Schulen von 2-10, selten 15 Tieren (meist Weibchengruppen mit Nachwuchs, gemischtgeschlechtliche Jugendgruppen und Männchen in Junggesellengruppen), die einen Tagesaktionsradius von 0,5-5 km besitzen; übers Jahr verteilt wird ein Gebiet von 17-60, selten bis 100 km2 genutzt; in einer Studie von Gubbins (2002) verbrachten manche Delfine in South Carolina über vier Jahre hinweg die Hälfte ihrer Zeit in einem Gebiet von nur einem halben Quadratkilometer; hauptsächlich in Flachwasserzonen bis 20 m Tiefe (Buchten, Flussmündungszonen, Flüsse bis 50 km von der Mündung entfernt), selten bis 34 m; genutzt wird hauptsächlich der Wasserbereich bis 3 m Tiefe (Ridgway & Harrison, 1999; Leatherwood & Reeves, 1990; Mann et al., 1999); Duffield, Ridgway & Cornell (1983) stellten fest, dass aufgrund genetischer Veranlagungen Atlantische Küstentümmler gegenüber Offenwasserarten eine deutlich geringere Speicherkapazität für Sauerstoff und somit verminderte Tauchfähigkeiten besitzen; Tauchdauer gewöhnlich 20-40 Sekunden, Rekordwert 7 Minuten; Nahrung besteht aus Fischen der Küsten- und Brackwasserzone, Isotop-Untersuchen zeigten, dass keine Jagd im Offenwasser stattfindet; wenig Kooperation bei der Jagd, individuelle Jagd dominiert (Rossman et al., 2013); beim Beutefang werden Uferelemente einbezogen und die großen Flipper sorgen für eine deutlich bessere Manövrierfähigkeit im Vergleich zu den Hochseearten; vermutlich dienen die großen Brustflossen auch der Abstrahlung von Körperwärme; durchschnittliche Lebenserwartung in der Natur 8,6-17,4 Jahre (Neuenhoff, 2009; Mattson et al., 2006; Stolen et al., 2003; Hohn, 1980), in menschlicher Obhut mehr als 22-34,3 Jahre (van Elk & Hartmann, 2012; Willis, 2011; 2007), Höchstalter in der Wildnis je nach Population ca. 30-60 Jahre, in menschlicher Obhut ca. 60 Jahre; Tragzeit ca. 12 Monate; in europäischen und amerikanischen Delfinarien werden hauptsächlich die Küstentümmler aus der Karibik (Golf-von-Mexiko-Tümmler) gehalten; Delfinarien in Europa und Nordamerika sind inzwischen auf keine Wildfänge mehr angewiesen (mehr als doppelt so viele erfolgreiche Aufzuchten wie Todesfälle) und können die Bestände durch Erhaltungszuchtprogramme halten; zwischen Delfinen in Haltung und in der Wildnis sind keine Unterschiede bezüglich Sozialstruktur und Sozialverhalten (z.B. Streicheleinheiten) feststellbar (Dudzinski, Danaher-García & Gregg, 2013)
-
Literatur: Costa et al. (2022);
Dudzinski, Danaher-García
& Gregg (2013); Kita et al.
(2013); Waring et al. (2013); van Elk & Hartmann (2012); Willis (2011); Neuenhoff (2009); Rosel
et al. (2009), Tezanos-Pinto et al. (2009); Willis (2007); Mattson et al. (2006); Stolen
et al. (2003); Gubbins
(2002); Mann et al. (1999); Ridgway & Harrison (1999); Leatherwood & Reeves (1990); Duffield, Ridgway & Cornell (1983); Hohn (1980)
Tursiops gephyreus Lahille, 1908 (Südamerikanischer Küstentümmler/South
American Coastal Bottlenose Dolphin):
- Bestand: Nicht bewertet.
- Verbreitung: Südwestatlantik (Südamerika)
Tursiops „obtusus“ (Schlegel,
1870) (Europäischer
Küstentümmler/European Coastal Bottlenose
Dolphin):
-
Taxonomie: Nach bisherigen genetischen Analysen
(Louis et al., 2014)
wahrscheinlich zwei Unterarten Iberischer Küstentümmler und Schottischer
Küstentümmler. Aktuell wohl kein Austausch mehr mit dem Atlantischen
Hochseetümmler.
-
Bestand: Nicht bewertet; aber nur ca. 600 Tiere;
starke Populationsabnahme, wenngleich geringer als die ursprünglich vermuteten
fünf Prozent pro Jahr; vor der deutschen Küste ca. 1970 ausgestorben; Rote
Liste Deutschland Ausgestorben
als Tursiops truncatus.
-
Verbreitung: Nordost-Atlantik; Nordsee.
-
Biologie: Bewohnt hauptsächlich küstennahe
Gewässer bis 30 m Tiefe, selten bis 50 m; Hauptaktivität in der oberen
Wasserschicht bis 10 m (Hastie, Wilson
& Thompson, 2006).
-
Literatur: Hastie,
Wilson & Thompson (2006); Louis
et al. (2014).
Tursiops gillii Dall, 1873 (Kalifornischer Küstentümmler/California Coastal Bottlenose Dolphin):
- Holotypus gefangen von Kapitän C. M. Scammon Monterey, Kalifornien; lediglich Unterkiefer erhalten; benannt nach dem Meeressäugerspezialisten Theodore Gill vom Smithsonian Institut; der Artname bezieht sich in eigentlich auf die Kalifornischen Küstentümmler, wird aber häufig für alle Tiere im Pazifik verwendet; die Offshore-Tümmler im Pazifik sind aber definitiv eine andere Tümmlerform und auch die Tiere in den Küstenregionen des Westpazifiks stellen vermutlich eine andere Art dar; eine neuere genetische Untersuchung von Lowther-Thieleking (2015) zeigte außerdem, dass die Küstentümmler im Golf von Kalifornien nicht wie bisher gedacht mit T. gillii an der kalifornischen Küste identisch sind, sondern eher als eine Unterart von T. nuuanu zu werten sind
- Bestand: Nicht bewertet; ca. 450 Tiere.
- Biologie: in Kalifornien entfernen sich die Tümmler selten mehr als einen Kilometer von der Küste und bevorzugen Bereiche mit einer Tiefe von weniger als 10 m, gelegentlich entfernen sich Tiere aber auch mal bis zu 15 km von der Küste; gelegentlich töten Kalifornische Küstentümmler Schweinswale, nach bisherigen Erkenntnissen dient dieses Verhalten vermutlich dazu, das Überfallen und Töten von arteigenen Jungtieren zu trainieren; Infantizid ist bei Tümmlern weit verbreitet; vor allem in Asien werden Große Tümmler unter dem Namen Tursiops gillii gehalten, gehören aber vermutlich einer eigenen Art an
- Literatur: Dall (1873), Lowther-Thieleking (2015)
Tursiops cf. gillii Dall, 1873 (Peruanischer Küstentümmler/Peruvian Coastal Bottlenose Dolphin):
-
Nach genetischen Untersuchungen von Sanino et al. (2005) und morphologischen
Schädel- und Zahnanalysen von van Waerebeek et al. (1990) unterscheiden sich die
Küstentümmler vor Peru eindeutig von den anderen Pazifikarten
-
Bestand: Nicht bewertet.
Tursiops nuuanu Andrews, 1911
(Tropischer Ostpazifik-Tümmler/Eastern
Tropical Pacific Bottlenose Dolphin):
- Holotypus/Terra typica: AMNH 35045 (Amerikanisches Museum für Naturgeschichte New York), am 6. Dezember 1906 von J. T. Nichols bei einer Expeditionsfahrt der U.S.S. Albatross im östlichen Pazifik gefangen, 12° N, 120° W.
- Taxonomie/Etymologie: Zunächst als separate Art beschrieben, wurde nuuanu später als Synonym von truncatus (Hershkovitz, 1963) oder aduncus (Hershkovitz, 1966) behandelt. Costa et al. (2023) zeigten anhand von morphologischen Analysen, dass es sich um eine eigenständige Linie handelt, wobei sie nuuanu vorerst als Unterart von truncatus einstuften. Das Artepitheton leitet sich von dem hawaiianischen Wort nu’uanu ab, was „Klippe“ bedeutet.
- Beschreibung/Identifizierung:
- Bestand: Nicht bewertet.
- Verbreitung: Ostpazifik (tropische Gewässer von Mexiko bis Ekuador).
- Literatur: Andrews (1911); Costa et al. (2023); Hershkovitz (1963, 1966).
Tursiops truncatus (Montagu, 1821) (Gemeiner Großer Tümmler/Common Bottlenose Dolphin):
- Wahrscheinlich mehrere Unterarten, darunter Atlantischer Hochseetümmler, möglicherweise auch Ostkaribischer Küstentümmler und Westafrikanischer Küstentümmler
-
Bestand: Nicht
gefährdet; mind. 400.000 Individuen; Fjordland-Population Vom Aussterben bedroht; ca. 200 Tiere.
-
Biologie: deutlich größer und robuster als
Küstenarten; große Schulen bis zu mehreren Hundert Individuen, die große
Entfernungen zurücklegen können und bei der Jagd meist zusammenarbeiten
Tursiops „parvimanus 1“
van Beneden,
1886 (Mittelmeer-Tümmler/Western Mediterranean Bottlenose
Dolphin):
- Nach mehreren Studien, z.B. Moura et al. (2020) existieren im Mittelmeer zwei separate Formen aus der Gattung Tursiops, die hier aber noch nicht genauer differenziert werden. Einige genetische Signale sprechen dafür, dass es entweder aktuell noch zu einem gelegentlichen genetischen Austausch mit Tursiops truncatus aus dem Atlantik kommt oder der letzte genetische Austausch zwischen Populationen des Atlantiks und des Mittelmeers noch nicht lange zurückliegt. Dies würde auch eine Einstufung der beiden Mittelmeerformen als Unterarten von truncatus rechtfertigen. Da dann truncatus paraphyletisch in Bezug auf ponticus wäre, müsste ponticus in diesem Fall auch als Unterart betrachtet werden.
- Bestand: Gefährdet; Östlicher und Westlicher Mittelmeer-Tümmler zusammen gezählt ergeben ca. 10.000 Tiere.
- Verbreitung: Mittelmeer.
- Biologie: bei La Maddalena (Italien) wurden einzelne Schulen beobachtet, wie sie Fische aus von Fischern aufgestellten Spiegelnetzen fraßen (Pennino et al., 2013)
-
Literatur: Moura
et al. (2020); Pennino et al. (2013).
Tursiops „parvimanus 2“ van Beneden, 1886
(Östlicher Mittelmeer-Tümmler/Eastern Mediterranean Bottlenose
Dolphin):
- Nach mehreren Studien, z.B. Moura et al. (2020) existieren im Mittelmeer zwei separate Formen aus der Gattung Tursiops, die hier aber noch nicht genauer differenziert werden. Einige genetische Signale sprechen dafür, dass es entweder aktuell noch zu einem gelegentlichen genetischen Austausch mit Tursiops truncatus aus dem Atlantik kommt oder der letzte genetische Austausch zwischen Populationen des Atlantiks und des Mittelmeers noch nicht lange zurückliegt. Dies würde auch eine Einstufung der beiden Mittelmeerformen als Unterarten von truncatus rechtfertigen. Da dann truncatus paraphyletisch in Bezug auf ponticus wäre, müsste ponticus in diesem Fall auch als Unterart betrachtet werden.
- Bestand: Gefährdet; Östlicher und Westlicher Mittelmeer-Tümmler zusammen gezählt ergeben ca. 10.000 Tiere.
- Verbreitung: Mittelmeer.
- Biologie: bei La Maddalena (Italien) wurden einzelne Schulen beobachtet, wie sie Fische aus von Fischern aufgestellten Spiegelnetzen fraßen (Pennino et al., 2013)
-
Literatur: Moura
et al. (2020); Pennino et al. (2013).
Tursiops
ponticus Barabash-Nikiforov, 1935 (Schwarzmeer-Tümmler/Black Sea Bottlenose
Dolphin):
- Die Population im Schwarzen Meer bildet eine monophyletische Einheit, was für einen eigenen Artstatus spricht. Häufig wird die Form aber auch als Unterart von Tursiops truncatus geführt.
- Bestand: Stark gefährdet; ca. 4.000 Tiere.
- Verbreitung: Schwarzes Meer.
- Biologie: Die Art wird häufig in osteuropäischen Delfinarien z.B. in Griechenland und Litauen gehalten.
-
Literatur: Moura
et al. (2020).
Cetruminantia > Whippomorpha > Cetacea
> Odontoceti > Delphinida > Delphinoidea > Delphinidae > Delphininae > Delphinus
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Delphinus |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
||
|
|
|
|
|||||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
Genus Delphinus Linnaeus, 1758 (Gattung Eigentliche Delfine):
- 8 Arten
Delphinus hosei (Fraser,
1956) (Borneo-Delfin/Fraser’s Dolphin):
- Vorübergehende Einordnung in Delphinus; bisher wurde die Art in der Gattung Lagenodelphis geführt
- Bestand: nicht gefährdet; ca. 300.000 Tiere
Delphinus longirostris Gray, 1828 (Spinnerdelfin/Spinner
Dolphin):
- Vorübergehende Einordnung in Delphinus; bisher wurde die Art in der nach genetischen Untersuchungen paraphyletischen Gattung Stenella geführt
- Unterarten: Insel-Spinnerdelfin (D. longirostris longirostris), Mittelamerikanischer Spinnerdelfin (D. longirostris centoamericanus), Ostpazifischer Spinnerdelfin (D. longirostris orientalis), Indopazifischer Spinnerdelfin (D. longirostris roseiventris)
- Bestand: Daten defizitär
Delphinus clymene (Gray,
1846) (Clymene-Delfin/Clymene
Dolphin):
- Vorübergehende Einordnung in Delphinus; bisher wurde die Art in der nach genetischen Untersuchungen paraphyletischen Gattung Stenella geführt
- Bestand: Daten defizitär
Delphinus coeruleoalbus Meyen, 1833 (Blau-Weißer
Delfin/Striped Dolphin):
- Vorübergehende Einordnung in Delphinus; bisher wurde die Art in der nach genetischen Untersuchungen paraphyletischen Gattung Stenella geführt
- Alternative Bezeichnung: Streifendelfin
- Bestand: Daten defizitär; > 2.000.000 Tiere; Population im Mittelmeer gefährdet; ca. 70.000 Tiere
Delphinus sp. [Amaral et al., 2007] (Ostatlantischer Gemeiner Delfin/Eastern Atlantic Common Dolphin):
- Bestand: unbekannt (nicht bewertet)
- Verbreitung: Ostatlantik
Delphinus delphis Linnaeus,
1758 (Kurzschnäuziger
Gemeiner Delfin/Short-beaked Common Dolphin):
- Unterarten: Kurzschnäuziger Hochseedelfin (D. delphis delphis), Schwarzmeerdelfin (D. delphis ponticus), Mittelmeerdelfin (D. delphis ssp.)
- Bestand: nicht gefährdet; ca. 3.500.000 Tiere
- Verbreitung: Atlantik; Mittelmeer; Schwarzes Meer; Pazifik
Delphinus capensis Gray,
1828 (Langschnäuziger
Gemeiner Delfin/Long-beaked Common Dolphin):
- Bestand: Daten defizitär; > 200.000 Tiere
- Verbreitung: Pazifik; Südatlantik
Delphinus
tropicalis van
Bree, 1971 (Indopazifischer
Gemeiner Delfin/Indo-pacific Common Dolphin):
- Bestand: unbekannt (nicht bewertet); > 20.000 Tiere
- Verbreitung: Indopazifik; Rotes Meer.
Referenzen:
1)
Agnarsson, I. &
May-Collado, L. J. (2008). The phylogeny of Cetartiodactyla:
the importance of dense taxon sampling, missing data, and the remarkable
promise of cytochrombe b to provide reliable
species-level phylogenies. Molecular
Phylogenetics and Evolution 48
(3): 964-985.
2)
Amaral, A. R., Sequeira, M., Martínez-Cedeira, J. & Coelho, M. M. (2007). New insights on population genetic structure of
Delphinus delphis
from the northeast Atlantic and phylogenetic relationships within the genus
inferred from two mitochondrial markers. Marine
Biology 151: 1967-1976.
3)
Andrews, R. C. (1911).
Description of an apparently new porpoise of the genus Tursiops, with remarks upon a skull of Tursiops gillii Dall. Bulletin of the American Museum of Natural
History 30: 233-237.
4)
Barbosa, M. & Bittencourt, L. (2019). High-frequency social
communication in Sotalia guianensis. The Journal of the Acoustical Society of
America 146 (2): EL124-128.
5)
Berzin, A.
A. & Vladimirov, V. L. (1982). Novyi vid kosatok
iz Antarktiki/A new species
from killer whale from the Antarctic. Priroda 6: 31-32.
6)
Berzin, A.
A. & Vladimirov, V. L. (1983). Novyi vid kosatok (Cetacea, Delphinidae) iz Antarktiki/A new species from
killer whale (Cetacea, Delphinidae) from Antarctic waters. Zoologicheskiy Zhurnal 62:
287-295.
7) Bisther, A. & Vongraven, D. (2022). Killer whale (Orcinus orca) male carrying a dead calf. Aquatic Mammals 48 (6): 578-579.
8) Borowski, G. H. (1780). Gemeinnüzzige Naturgeschichte des Thierreichs Band 2. G. A. Lange, Berlin und Stralsund.
9)
Caballero, S., Jackson, J., Mignucci-Giannoni, A. A., Barrios-Garrido, H., Beltrán-Pedreros, S., Montiel-Villalobos, M. G., Robertson,
K. M. & Baker, C. S. (2008). Molecular systematics of
South American dolphins Sotalia: sister taxa
determination and phylogenetic relationships, with insights into a multi-locus
phylogeny of the Delphinidae. Molecular
Phylogenetics and Evolution 46
(1): 252-268.
10) Caballero,
S., Trujillo, F., del Risco, A., Herrera, O. & Ferrer, A. (2017). Genetic identity of Sotalia dolphins from the Orinoco River. Marine Mammal Science 33 (4): 1214-1223.
11)
Caballero, S., Trujillo, F., Vianna, J. A.,
Barrios-Garrido, H., Montiel, M. G., Beltrán-Pedreros, S., Marmontel, M., Santos, M. C. O., Rossi-Santos, M. R.,
Santos, F. R. & Baker, C. S. (2006). Phylogeography
of the South American riverine and coastal dolphins Sotalis
fluviatilis and Sotalia guianensis. In: SOLAMAC (Hrsg.)
(2006). Sociedad Latinoamericana de Especialistas en Mamífereo Acuáticos. Workshop Internacional
sobre Pesquisa e Conservação dos Golfinhos do Gênero Sotalia, Búzios.
12)
Caballero, S., Trujillo, F., Vianna, J. A.,
Barrios-Garrido, H., Montiel, M. G., Beltrán-Pedreros, S., Marmontel, M., Santos, M. C. O., Rossi-Santos, M. R.,
Santos, F. R. & Baker, C. S. (2007). Taxonomic status of the
genus Sotalia:
species level ranking for “tucuxi” (Sotalia fluviatilis) and “costero” (Sotalia guianensis)
dolphins. Marine Mammal Science 23 (2): 358-386.
13)
Caballero, S., Trujillo, F., Vianna, J. A.,
Barrios-Garrido, H., Montiel, M. G., Beltrán-Pedreros,
S., Marmontel, M., Santos, M. C. O., Rossi-Santos, M.
R., Santos, F. R. & Baker, C. S. (2010).
Mitochondrial DNA diversity, differentiation and phylogeography
of the South American riverine and coastal dolphins Sotalia fluviatilis and Sotalia guianensis. Latin American Journal of Aquatic Mammals 8 (1-2): 69-79.
14) Carr, T. & Bonde, R. K. (2000). Tucuxi (Sotalia fluviatilis)
occurs in Nicaragua, 800 km north of its previously known range. Marine Mammal Science 16 (2): 447-452.
15) Casinos, A.,
Bisbal, F. & Boher, S. (1981). Sobre
tres exemplars des Sotalia fluviatilis del Lago Maracaibo
(Venezuela) (Cetacea, Delphinidae). Publicaciones del Departamento de Zoologia, Barcelona
7: 93-96.
16)
Charlton-Robb, K., Gershwin, L.-A., Thompson, R.,
Austin, J., Owen, K., McKechnie, S. (2011). A new dolphin species, the Burrunan
dolphin Tursiops australis sp. nov., endemic to Southern Australian coastal waters. PLoS ONE 6 (9): e2404. doi:
10.1371/journal.pone.0024047: 1-17.
17)
Costa, A. P. B., Archer, F. I. & Perrin, W. F. (2023). Tursiops truncates nuuanu, a new subspecies of the common bottlenose
dolphin from the eastern tropical Pacific. Journal
of Mammalian Evolution 30 (in
press): 1-17.
18)
Costa, A. P. B., Mcfee, W., Wilcox, L. A., Archer, F. I. & Rosel, P. E. (2022). The common bottlenose
dolphin (Tursiops truncatus)
ecotypes of the western North Atlantic revisited: an integrative taxonomic
investigation supports the presence of distinct species. Zoological Journal of the Linnean Society 196 (4): 1608-1636.
19)
Dall, W. H. (1873). Descriptions of three species of Cetacea, from the coast of
California. Proceedings of the California
Academy of Sciences 5: 12.
20)
Da Silva,
V. M. F. & Best, R. C. (1994). Tucuxi Sotalia fluviatilis (Gervais, 1853). S. 43-69 in: Ridgway,
S. H. & Harrison, R. J. (Hrsg.) (1994).
Handbook of marine mammals Volume 5: The First Book of Dolphins. Academic Press, London.
21)
Da Silva, V. M. F. & Best, R. C. (1996). Sotalia fluviatilis. Mammalian Species 28 (527): 1-7.
22)
Decker, J. E., Pires, J. C., Conant, G. C., McKay, S.
D., Heaton, M. P., Chen, K., Cooper, A., Vilkki, J.,
Seabury, C. M., Caetano, A. R., Johnson, G. S., Brenneman, R. A., Hanotte, O., Eggert, L. S., Wiener, P., K. J.-J., Kim, K.
S., Sonstegard, T. S., Tassell,
C. P., Neibergs, H. L., McEwan, J. C., Brauning, R., Coutinho, L. L., Babar, M. E., Wilson, G. A.,
McClure, M. C., Rolf, M. M., Kim, JW., Schnabel, R. D. & Taylor, J. F. (2009). Resolving the evolution of
extant and extinct ruminants with high-troughput phylogenomics. Proceedings
of the National Academy of Sciences 106
(44): 18644-18649.
23)
De Bruyn, P. J. N., Tosh, C.
A. & Terauds, A. (2013). Killer whale ecotypes: is there a global
model? Biological Reviews 88 (1): 62-80.
24)
Deconto, L. S.
& Monteiro-Filho, E. L. A. (2019). Differences in the sounds of
Guiana dolphin Sotalia guianensis
(Cetacea: Delphinidae) between two areas of south-eastern and southern Brazil. Bioacoustics: The International Journal of
Animal Sound and its Recording 28
(1): 26-41.
25) De Mello, A.
B., Molina, J. M. B., Kajin, M. & Santos, M. C.
de O. (2019). Abundance estimates of
Guiana dolphins (Sotalia guianensis;
van Bénéden, 1864) inhabiting an estuarine system in
Southeastern Brazil. Aquatic Mammals 45 (1): 56-65.
26)
Dudzinski, K.
M., Danaher-García, N. & Gregg, J. D. (2013).
Pectoral fin contact between
dolphin dyads at Zoo Duisburg, with comparison to other dolphin study
populations. Aquatic Mammals 39 (4): 335-343.
27)
Duffield, D. A., Ridgway, S. H. & Cornell, L. H. (1983). Hematology distinguishes
coastal and offshore forms of dolphin (Tursiops).
Canadian Journal of Zoology 61: 930-933.
28)
Flach, L.,
Alonso, M. B., Marinho, T., van Waerebeek,
K. & van Bressem, M.-F. (2019). Clinical signs in free-ranging Guiana dolphins Sotalia guianensis
during a morbillivirus epidemic: case study in Sepetiba
Bay, Brazil. Diseases of Aquatic
Organisms 133 (3): 175-180.
29)
Frère, C. H., Hale, P. T., Porter, L., Cockcroft, V.
G. & Dalebout, M. L. (2008). Phylogenetic analysis of mtDNA sequences suggests revision of humpback dolphin (Sousa spp.) taxonomy is needed. Marine and Freshwater Research 59: 259-268.
30)
Gervais, P. (1853). Remarques sur les mammifères marins qui frequentent les cotes de la France et plu
particulièremant sur une
nouvelle espèce de Dauphin proper à la Méditerranée. Bulletin
de la Société Cenrale d’Agriculture
et des comices agricoles du
départment de l’Herault
(Montpellier) 40: 140-156.
31) Gervais, P. (1855). Description des trois espèces de dauphins qui vivent dans la region du haut Amazone. S. 89-94 in: Animaux nouveaux ou rares recueillis pendant l’expedition dans les parties centrales de L‘Amerique du Sud, du Rio de Janeiro a Lima et de Lima au Pará: exécutée par ordre du gouvernement Franςais pendant les années 1843 a 1847, sous la direction du comte Francis de Castelnau: Mammifères. P. Bertrand, Libraire-Éditeur, Paris.
32) Gray, J. E. (1856).
Description of a new species of dolphin (Steno)
from the upper parts of the river Amazon. Annals
and Magazine of Natural History, 2nd Series 18 (104): 157-159.
33) Gray, J. E. (1866) Catalogue of seals and whales
in the British Museum, 2nd edition. Order of the
Trustees of the British Museum (Natural History), London.
34) Gray, J. E. (1866).
Notes on the skulls of dolphins or bottlenosed
whales, in the British Museum. Proceedings
of the Zoological Society of London 34
(1): 211-216.
35)
Gubbins, C. (2002). Use of home ranges by
resident bottlenose dolphins (Tursiops truncatus) in a South Carolina Estuary. Journal of Mammalogy 83 (1): 178-187.
36)
Hassanin, A., Delsuc, F., Ropiquet, A., Hammer,
C., van Vuuren, B. J., Matthee, C., Ruiz-Garcia, M., Catzeflis, F., Areskoug, V.,
Nguyen, T. T. & Couloux, A. (2012). Pattern and timing of
diversification of Cetartiodactyla (Mammalia, Laurasiatheria), as revealed by a comprehensive analysis of
mitochondrial genomes. Comptes Rendus Biologies 335
(1): 32-50.
37)
Hastie, G. D., Wilson, B. & Thompson, P. M. (2006). Diving deep in a foraging
hotspot: acoustic insights into bottlenose dolphin dive depths and feeding
behavior. Marine Biology 148 (5): 1181-1188.
38)
Hershkovitz, P. (1963).
Notes on South American dolphins of the genera Inia, Sotalia
and Tursiops. Journal of Mammalogy 44
(1): 98-103.
39)
Hershkovitz, P. (1966).
Catalog of living whales. United States
National Museum Bulletin 246:
1-259.
40)
Hohn, A. A. (1980). Age determination and age related factors in the teeth of Western North Atlantic
bottlenose dolphins. Scientific Reports
of the Whales Research Institute 32:
39-66.
41)
Jefferson, T. A. & Rosenbaum, H. C. (2014). Taxonomic revision of the
humpback dolphins (Sousa spp.), and
description of a new species of Australia. Marine
Mammal Science in press. DOI:
10.111/mms.12152
42)
Kim, M. Y., Choe, J. C., Paeng, D.-G., Kohshima, S. &
Jang, S. (2022). The survival of a flukeless juvenile dolphin (Tursiops aduncus) in the wild. Aquatic Mammals 48 (6): 505-508.
43)
Kita, Y. F., Hosomichi, K.,
Suzuki, S., Inoko, H., Shiina,
T. (2013). Genetic and
family structure in a group of 165 common bottlenose dolphins caught off the
Japanese coast. Marine Mammal Science
29 (3): 474-496.
44)
Leatherwood, S. & Reeves, R. R. (Hrsg.)
(1990). The Bottlenose Dolphin. Academic
Press, New York.
45) Linnaeus, C. (1758).
Systema naturae per regna tria naturae, secundum
classes, ordines, genera, species, cum characteribus,
differentiis, synonymis, locis – Editio decima, reformata – Tomus I. Lars Salvi, Stockholm.
46)
Louis, M., Galimberti, M., Archer, F., Berrow,
S., Brownlow, A., Fallon, R., Nykänen, M., O’Brien,
J., Roberston, K. M., Rosel,
P. E., Simon-Bouhet, B., Wegmann,
D., Fontaine, M. C., Foote, A. D. & Gaggiotti, O.
E. (2021). Selection on ancestral genetic
variation fuels repeated ecotype formation in bottlenose dolphins. Science Advances 7 (44): eabg1245: 1-13.
47)
Lowther-Thieleking, J. L., Archer, F. I., Lang, A. R. & Weller,
D. W. (2015). Genetic differentiation among coastal and offshore common
bottlenose dolphins, Tursiops truncatus, in
the eastern North Pacific Ocean. Marine Mammal Science 31 (1):
1-20.
48)
Louis, M., Viricel,
A., Lucas, T., Peltier, H., Alfonsi, E., Berrow, S., Brownlow,
A., Covelo, P., Dabin, W., Deaville, R., de Stephanis, R., Gally, F., Gauffier, P., Penrose, R., Silva, M. A., Guinet, C. & Simon-Bouhet, B.
(2014). Habitat-driven population
structure of bottlenose dolphins, Tursiops
truncatus, in the North-East Atlantic. Molecular
Ecology 23 (4): 857-874.
49)
Maciel, I. S., Maricato, G., Marqui, L., Alves,
M. A. S. & Tardin, R. H. (2020). Home Alone: solitary rough-toothed dolphin (Steno bredanensis) in residence area of
Guiana dolphins (Sotalia guianensis). Aquatic Mammals 46 (1): 42-48.
50)
Mann, J., Connor, R. C., Tyack, P. L. & Whitehead,
H. (Hrsg.)
(1999). Cetacean Societies: Field Studies of Dolphins and Whales. University of Chicago Press, Chicago.
51)
Mattson, M. C., Mullin, K. D., Ingram Jr., W. &
Hoggard, W. (2006). Age
structure and growth of the bottlenose dolphin (Tursiops truncatus) from strandings in
the Mississippi Sound Region of the North Central Gulf of Mexico from 1986 to
2003. Marine Mammal Science 22 (3): 654-666.
52)
Meester, J.
& Setzer, H. W. (1971). The Mammals of Africaan Identification
Manual. Smithsonian Institution Press,
Washington.
53)
Mikhalev, Y. A. & Ivashin, M.
V., Savusin, V. P. & Zelenaya,
F. E. (1981). The distribution and biology
of killer whales in the Southern Hemisphere. Report of the International Whaling Commission 31: 551-566.
54)
Mitchell, E. (1975). Review
of biology and fisheries for smaller cetaceans. Journal of the Fisheries Research Board of Canada 32 (7): 875-1240.
55) Montagu, G. (1821). Description of a species of Delphinus which appears to be new. Memoirs of the Wernerian Natural History Society 3: 75-82.
56) Moodley, Y & Bruford, M. W. (2008). Molecular biogeography: towards an integrated framework for conserving Pan-African biodiversity. PLoS ONE 2 (5): 1-9.
57)
Morin, P.
A., Archer, F. I., Foote, A. D., Vilstrup,
J., Allen, E. E., Wade, P., Durban, J., Parsons, K., Pitman, R., Li, L., Bouffard, P., Abel Nielsen, S. C., Rasmussen, M., Willerslev, E., Gilbert, M. T. & Harkins,
T. (2010). Complete mitochondrial genome
phylogeographic analysis of killer whales (Orcinus
orca) indicates multiple species. Genome
Research 20 (7): 908-916.
58)
Moura, A. E., Nielsen, S. C. A., Vilstrup,
J. T., Moreno-Mayar, J. V., Gilbert, M. T. P., Gray,
H. W. I., Natoli, A., Möller,
L. & Hoelzel, A. R. (2013). Recent diversification of a marine
genus (Tursiops spp.) tracks habitat
preference and environmental change. Systematic
Biology 62 (6): 865-877.
59)
Neuenhoff, R. D. (2009). Age, growth
and population dynamics of common bottlenose dolphins (Tursiops truncatus) along coastal Texas. MS Thesis, Texas A&M University, 108
pp.
60)
Nowak, R. M. & Paradiso, J. L. (1983). Walker’s mammals of the world, 4th edition. The Johns Hopkins University Press,
Baltimore.
61)
Pavanato, H. J.,
Gomez-Salazar, C., Trujillo, F., Lima, D., Paschoalini,
M., Ristau, N. & Marmontel,
M. (2019). Density, abundance and group size of river dolphins (Inia geoffrensis
and Sotalia fluviatilis)
in central Amazonia, Brazil. Journal of
Cetacean Research and Management 20:
93-100.
62)
Pennino, M. G.,
Mendoza, M., Pira, A., Floris, A. & Rotta, A. (2013). Assessing foraging tradition
in wild bottlenose dolphin (Tursiops truncates). Aquatic Mammals 39 (3):
282-289.
63)
Perrin, W. F., Thieleking,
J. L.,Walker,
W. A., Archer, F. I. & Robertson, K. M. (2011). Common
bottlenose dolphins (Tursiops truncatus) in California waters: cranial
differentiation of coastal and offshore ecotypes. Marine Mammal Science 27
(4): 769-792.
64)
Pitman, R.
L. & Ensor, P. (2003). Three forms of killer whales (Orcinus
orca) in Antarctic waters. Journal of
Cetacean Research and Management 5
(2): 131-139.
65)
Price, S. A., Bininda-Emonds,
O. R. P. & Gittleman, J. L. (2005). A complete phylogeny of the
whales, dolphins and even-toed hoofed mammals (Cetartiodactyla). Biological
Reviews 80 (3): 445-473.
66)
Prothero, D. R. & Foss, S. E. (2007). The evolution of
Artiodactyls. The John Hopkins University
Press, Baltimore.
67)
Reggente, M. A. L., Alves, F., Nicolau,
C., Freitas, L., Cagnazzi, D., Baird, R. W. &
Galli, P. (2016). Nurturant behavior toward
dead conspecifics in free-ranging mammals: New records
for odontocetes and a general review. Journal
of Mammalogy 97 (5): 1428-1434.
68)
Ridgway, S. H. & Harrison, R. J. (Hrsg.)
(1999). Handbook of Marine Mammals – Volume 6 The Second Book of Dolphins and
Porpoises. Academic Press, New York.
69)
Rodrigues, V. L. A., Wedekin, L. L., Marcondes,
M. C. C., Barbosa, L. & Farro, A. P. C. (2020). Diet and foraging opportunism of the Guiana dolphin (Sotalia guianensis)
in the Abrolhos Bank, Brazil. Marine
Mammal Science 36 (2): 436-450.
70)
Ropiquet, A., Li, B. &
Hassanin, A. (2009). SuperTRI:
A new approach based on branch support analyses of multiple independent data
sets for assessing reliability of phylogenetic inferences. Comptes Rendus Biologies
332 (9): 832-847.
71)
Rosel, P.
E., Hansen, L. & Hohn, A. A. (2009). Restricted dispersal in a continuously
distributed marine species: common bottlenose dolphins Tursiops truncatus in coastal waters of
the western North Atlantic. Molecular
Ecology 18 (24): 5030-5045.
72)
Rossman, S.,
Barros, N. B., Ostrom, P. H., Stricker, A., Hohn, A. A., Gandhi, H. &
Wells, R. S. (2013). Retrospective
analysis of bottlenose dolphin foraging: a legacy of anthropogenic ecosystem
disturbance. Marine Mammal Science 29 (4): 705-718.
73)
Sanino, G. P., van
Waerebeek, K., van Bressem,
M.-F. & Pastene, L. A. (2005). A preliminary note on population
structure in eastern South Pacific common bottlenose dolphins, Tursiops truncatus.
Journal of Cetacean Research and
Management 7 (1): 65-70.
74)
Scammon, C. M. (1869). On the cetaceans of the Western
Coast of North America. Proceedings of
the Academy of Natural Sciences of Philadelphia 21: 13-63.
75) Scammon, C.
M. (1874). The marine mammals of the north-western
coast of North America, described and illustrated: together with an account of
the American whale fishery. J. H. Carmany and Company, San Francisco.
76) Secchi, E. (2012). Sotalia fluviatilis. The IUCN Red List of
Threatened Species 2012: e.T19087A17583369.
http://dx.doi.org/10.2305/IUCN.UK.2012.RLTS.T190871A17583369.en. Stand 06. Juni 2020.
77)
Secchi, E., Santos, M. C. de O. & Reeves, R. (2018). Sotalia guianensis. The IUCN Red List of
Threatened Species 2012: e.T181359A144232542.
http://dx.doi.org/10.2305/IUCN.UK.2018-2.RLTS.T181359A144232542.en. Stand 06. Juni 2020.
78)
Stolen, M. K. & Barlow, J. (2003). A model life table for
bottlenose dolphins (Tursiops truncatus) from the Indian River Lagoon System,
Florida, USA. Marine Mammal Science 19 (4): 630-649.
79)
Tannure, N. C.,
Barbosa, F. S., Barcellos, D. D., Mattiuzzo,
B., Martinelli, A., Campos, L. B., Conversani, V. R.
M. & Santos, M. C. de O. (2020). Acoustic description of
beach-hunting Guiana dolphins (Sotalia guianensis) in the Cananéia
Estuary, Southeastern Brazil. Aquatic
Mammals 46 (1): 11-20.
80) Tardin, R. H., Maciel, I. S., Espécie, M. A.,
Melo-Santos, G., Simao, S. M. & Alves, M. A. S. (2020). Modelling habitat use by the Guiana dolphin, Sotalia guianensis, in south-eastern Brazil:
effects of environmental and anthropogenic variables, and the adequacy of
current management measures. Aquatic
Conservation: Marine and Freshwater Ecosystems 30 (4): 775-786.
81)
Tezanos-Pinto, G.,
Baker, C. S., Russell, K., Martien, K., Baird, R. W.,
Hutt, A., Stone, G., Mignucci-Giannoni, A. A.,
Caballero, S., Endo, T., Lavery, S., Oremus, M., Olavarría, C. &
Garrigue, C. (2009). A
worldwide perspective on the population genetic diversity of bottlenose
dolphins (Tursiops truncates) in New
Zealand. Journal of Heredity 100 (1): 11-24.
82)
Torres, L. G., Rosel, P. E.,
d’Agrosa, C. & Read, A. J. (2003): Improving management of overlapping
bottlenose dolphin ecotypes through spatial analysis and genetics. Marine Mammal Science 19 (3): 502-514.
83)
Van Bénéden, E. (1864). Sur un dolphin nouveau et un
ziphiode rare. Mémoires couronnés et autres
mémoires publiés par l’Academie Royale de Sciences, des lettres
et des beaux-arts de Belgique 16
(2): 1-21.
84) Van Bénéden, E. (1875). Memoire sur un dolphin
nouveau de la Baie de Rio de Janeiro, désigné sous le nom de Sotalia brasiliensis. Mémoires de l’Academie Royale de Sciences Belgique
41 (1): 2-44.
85) Van Bénéden, E. & Gervais, P. (1880). Osteographie des cétacés
vivant et fossils, comprenant la description et l’iconographie du squelette et du
système dentaire de ces animaux. Arthur Bertrand, Libraire-Éditeur, Paris.
86) Van Elk, C. & Hartmann, M. G. (2012). Tursiops truncatus (Großer Tümmler) EEP.
87)
Van Waerebeek, K., Reyes, J. C., Read, A. J. & McKinnon, J.
S. (1990). Preliminary observations of bottlenose dolphins
from the Pacific coast of South America. In:
Leatherwood, S. & Reeves, R.
R. (Hrsg.) The Bottlenose Dolphin. Academic
Press, San Diego.
88)
Vidal, L. G., Vannuci-Silva, M., Alonso, M. B., Feo, M. L., Corcellas, C., Bisi, T. L., Flach, L., Fragoso,
A. B. L., Silva, F. J. L., Carvalho, V. L., de Meirelles, A. C. O., Domit, C., Barbosa, L. A., Cremer, M. J., Azvedo, A. F., Torres, J. P. M., Malm,
O., Lailson-Brito, J. & Eljarrat,
E. (2020). Pyrethroid insecticides along the
Southwestern Atlantic coast: Guiana dolphin (Sotalia guianensis) as a bioindicator. Science of The Total Environment 728: 138749.
89)
Waring, G. T., Josephson, E., Maze-Foley, K. & Rosel, P. E. (Hrsg.) (2013). U.S. Atlantic and Gulf of
Mexico Marine Mammal Stock Assessments – 2012. NOAA Tech Memo NMFS NE 223,
419 pp.
90)
Willis, K. (2007). “Life Expectancy of Bottlenose Dolphins in Alliance of Marine
Mammal Parks and Aquariums North American Member Facilities: 1990-present”.
Presented at the 2007 executive meeting of the Alliance of Marine
Mammal Parks and Aquariums.
91)
Willis, K. (2011). How do we know how long Atlantic bottlenose dolphins typically
live in the wild and in human care. Alliance
of Marine Mammal Parks and Aquariums.
92)
Wilson, D.
E. & Mittermeier, R. A. (Hrsg.)
(2014). Handbook of the
Mammals of the World – Volume 4 Sea Mammals. Lynx Edicions, Barcelona.