System der
Lebewesen (Stefan Hintsche
2023)
Scrotifera
> Fereuungulata
> Cetartiodactyla
> Artiofabula
> Cetruminantia
> Ruminantia > Pecora > Bovoidea > Cervidae
|
|
|
|
|
|
Cervidae |
|
|
|
|
|
|
||
|
|
|
|
Familia
Cervidae Goldfuß,
1820 (Familie
Hirsche/Deer):
· 90 Arten, davon eine ausgestorben.
· Literatur: Goldfuß (1820).
Subfamilia Capreolinae Brookes,
1828 (Unterfamilie
Trughirsche/New World Deer):
· Alternative Bezeichnung: Neuwelthirsche
· 31 Arten.
· Synonyme: Telemetacarpalia Brooke, 1878.
· Literatur: Brooke (1878); Brookes (1828).
Subfamilia Cervinae Goldfuß, 1820 (Unterfamilie Echthirsche/Old World Deer):
· Alternative Bezeichnung: Altwelthirsche.
· 59 Arten, davon eine ausgestorben.
· Synonyme: Plesiometacarpalia Brooke, 1878.
· Literatur: Brooke (1878); Goldfuß (1820).
Fereuungulata > Cetartiodactyla
> Artiofabula
> Cetruminantia
> Ruminantia > Pecora > Bovoidea > Cervidae > Capreolinae
|
|
|
|
|
|
|
Capreolinae |
|
|||
|
|
|
|||
|
|
|
|
||
|
|
|
|
||
|
|
|
|
|
Subfamilia Capreolinae Brookes,
1828 (Unterfamilie
Trughirsche/New World Deer):
· Alternative Bezeichnung: Neuwelthirsche.
· 31 Arten.
· Synonyme: Telemetacarpalia Brooke, 1878.
· Literatur: Brooke (1878); Brookes (1828).
Tribus Odocoileini Pocock, 1923 (Gattungsgruppe Echte Neuwelthirsche/American Deer):
· 26 Arten
Tribus Alceini Brookes, 1828 (Gattungsgruppe Elchhirsche/Camel Deer):
· 2 Arten.
Tribus Capreolini Brookes, 1828 (Gattungsgruppe Rehe/Roe Deer):
· 3 Arten.
Cetartiodactyla > Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Capreolinae > Odocoileini
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
||||||
|
Odocoileini |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
Tribus Odocoileini Pocock, 1923 (Gattungsgruppe Echte Neuwelthirsche/American Deer):
· 26 Arten
Subtribus Rangiferina Brookes, 1828 (Gattungsuntergruppe Renhirsche/Reindeer):
· 6 Arten.
Genus
Rangifer C. H. Smith, 1827 (Gattung Rentiere/Caribou):
· 6 Arten; Generotypus Rangifer tarandus (Linnaeus, 1758); Stammbaum orientiert sich an den Ergebnissen von Harding (2022).
· Synonyme: Tarandus Gmelin, 1788 (das Artepitheton wurde in einigen Schriften fälschlicherweise als Gattungsname zitiert); Procerus de Serres, 1832; Procervus de Blainville, 1840; Achlis Reichenbach, 1845.
· Literatur: Boulet et al. (2007); De Blainville (1840); De Serres (1832); Gmelin (1788); Linnaeus (1758); Reichenbach (1845); Smith (1827).
Subtribus Odocoileina Pocock, 1923 (Gattungsuntergruppe Neotropische Hirsche/Neotropical Deer):
· 20 Arten
Genus Mazama Rafinesque, 1817 (Gattung Rote Spießhirsche):
· 7 Arten
Genus Odocoileus Rafinesque, 1832 (Gattung Weißwedelhirsche):
· 4 Arten.
Genus Passalites Gloger, 1841 (Gattung Amazonien-Spießhirsche):
·
1 Art; Generotypus Passalites nemorivagus (F. Cuvier, 1817).
·
Literatur: Gloger
(1841).
Genus Pudu Gray, 1852 (Gattung Puduhirsche):
· 2 Arten
Genus Ozotocerus Ameghino, 1891 (Gattung Pampashirsche):
·
1 Art
Genus Blastocerus Wagner, 1844 (Gattung Sumpfhirsche):
· 1 Art
Genus Hippocamelus Leuckart, 1816 (Gattung Andenhirsche):
· 2 Arten
Genus Subulo C. H. Smith, 1827 (Gattung Graue Spießhirsche/Gray Brockets):
·
2 Arten; Generotypus ursprünglich
Subulo simplicicornis
C. H. Smith, 1827, wird aber u.a. nach
genetischen Analysen (Sandoval et al.,
2023) als Synonym von Subulo gouazoubira (G. Fischer
von Waldheim, 1814) betrachtet.
·
Taxonomie: Ursprünglich als Untergattung von Cervus eingeführt,
nutzten Fitzinger
(1873) und Pelzeln
(1883) Subulo
im Rang einer Gattung. Danach betrachteten die meisten Autoren Subulo als Synonym von Mazama. Bernegossi
et al. (2023) belebten
Subulo aber wieder als vollwertige Gattung, nachdem
genetische Analysen zeigte, dass die in der Gattung Mazama eingeordneten Arten keine
monophyletische Gruppe bilden.
·
Synonyme: Coassus J. E. Gray, 1843; Doryceros Fitzinger,
1879; Nanelaphus Fitzinger, 1879; Azarina Larrañaga, 1923.
·
Literatur: Bernegossi et al. (2023); Fischer (1814); Fitzinger (1873, 1879); Gray (1843); Larrañaga (1923); Pelzeln (1883); Sandoval et al. (2023);
Smith (1827).
Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Capreolinae > Odocoileini > Rangifer
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
Rangifer |
|
|
|
||
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
||
|
|
|
|
|
||
|
|
|
|
|
||
|
|
|
|
|
|
Genus
Rangifer C. H. Smith, 1827 (Gattung Rentiere/Caribou):
· 6 Arten; Generotypus Rangifer tarandus (Linnaeus, 1758); Stammbaum orientiert sich an den Ergebnissen von Harding (2022).
· Synonyme: Tarandus Gmelin, 1788 (das Artepitheton wurde in einigen Schriften fälschlicherweise als Gattungsname zitiert); Procerus de Serres, 1832; Procervus de Blainville, 1840; Achlis Reichenbach, 1845.
· Literatur: Boulet et al. (2007); De Blainville (1840); De Serres (1832); Gmelin (1788); Harding (2022); Linnaeus (1758); Reichenbach (1845); Smith (1827).
Rangifer groenlandicus
(Borowski, 1780) (Grönland-Karibu/Greenland
Caribou):
· Neotypus/Terra typica: Ursprünglicher Holotypus unbekannt, M2625 (Zoologisches Museum der Universität Oslo), Spitzbergen.
· Taxonomie: Ursprünglich als Cervus grönlandicus beschrieben, korrigierte Gmelin (1788) das Artepitheton zu groenlandicus.
· Verbreitung: Europa (Grönland), Nordamerika (Kanada: Nugsuak-Halbinsel).
· Literatur: Borowski (1780); Gmelin (1788); Gunn (2016); Harding (2022).
Rangifer arcticus (Richardson, 1829) (Tundrakaribu/Arctic Caribou):
· Taxonomie: Ursprünglich als Cervus tarandus var. arctica beschrieben.
· Unterarten:
1. Rangifer arcticus arcticus (Richardson, 1829) (Barrenground-Karibu/Barren-ground Caribou).
2. †Rangifer arcticus dawsoni Seton-Thompson, 1899 (Queen-Charlotte-Karibu/Dawson’s Caribou).
3. Rangifer arcticus fortidens Hollister, 1912 (Rocky-Mountains-Karibu/Rocky Mountain Caribou).
4. Rangifer arcticus granti Allen, 1902 (Grant-Karibu/Grant’s Caribou).
5. Rangifer arcticus montanus Seton-Thompson, 1899 (Selkirk-Karibu/Mountain Caribou).
6. Rangifer arcticus osborni Allen, 1902 (Osborn-Karibu/Osborn’s Caribou).
7. Rangifer arcticus pearyi Allen, 1908 (Peary-Karibu/Ellesmere Land Caribou).
8. Rangifer arcticus stonei Allen, 1901 (Stone-Karibu/Stone’s Caribou).
· Verbreitung: Nordamerika (Kanada; Vereinigte Staaten).
· Literatur: Allen (1900, 1901, 1902, 1908); Byun, Koop & Reimchen (2002); Gunn (2016); Harding (2022); Hollister (1912); Richardson (1829); Seton-Thompson (1899).
Rangifer caribou (Gmelin, 1788) (Waldkaribu/Woodland
Caribou):
· Taxonomie: Ursprünglich als Cervus tarandus caribou beschrieben.
· Unterarten:
1. Rangifer caribou caribou (Gmelin, 1788) (Kanadisches Waldkaribu/Boreal Woodland Caribou).
2. Rangifer caribou caboti Allen, 1914 (Labrador-Karibu/Labrador Caribou).
3. Rangifer caribou terraenovae Allen, 1896 (Neufundland-Karibu/Newfoundland Caribou).
· Verbreitung: Nordamerika (Kanada; Vereinigte Staaten).
· Literatur: Allen (1896, 1914); Gmelin (1788); Gunn (2016); Harding (2022).
Rangifer platyrhynchus
(Vrolik, 1829) (Spitzbergen-Ren/Svalbard Reindeer):
· Neotypus/Terra typica: Ursprünglicher Holotypus unbekannt, M2625 (Zoologisches Museum der Universität Oslo), Spitzbergen, Norwegen (Banfield, 1963).
· Taxonomie: Ursprünglich als Cervus (Tarandus) platyrhynchus beschrieben und von Miller Jr. (1912) der Gattung Rangifer zugeordnet. Lydekker (1915) ordnete platyrhynchus als Unterart von Rangifer tarandus ein. Dieser Unterartenstatus findet sich auch in den meisten aktuellen Publikationen noch (Mattioli, 2011). Sokolov (1932) und Harding (2022) stufen platyrhynchus hingegen als eigenständige Art ein. Morphologische Unterschiede am Schädel (Skolov, 1937, 1963) sowie genetische Unterschiede (Kvie et al., 2016; Yannic et al., 2014) gegenüber den anderen Rentierarten, die sich auf eine eigenständige Entwicklung seit der Kolonisierung vor 6.700-5.000 Jahren aufgrund der isolierten Lage von Spitzbergen zurückführen lassen, stützen den Artstatus.
· Synonyme: Cervus tarandus f. spetsbergensis Andersén, 1862 (Terra typica: Spitzbergen, Norwegen); Rangifer arcticus var. spitzbergensis Murray, 1866 (Terra typica: Spitzbergen, Norwegen; von Lydekker (1898) als Unterart Rangifer tarandus spitzbergensis gelistet und von Camerano (1902) als separate Art Rangifer spitzbergensis geführt).
· Verbreitung: Europa (Norwegen: Spitzbergen).
· Literatur: Andersén (1862); Banfield (1961, 1963); Camerano (1902); Gunn (2016); Harding (2022); Kvie et al. (2016); Lydekker (1898, 1915); Mattioli (2011); Miller (1912); Murray (1866); Sokolov (1932, 1937, 1963); Vrolik (1829); Yannic et al. (2014).
Rangifer fennicus Lönnberg, 1909 (Waldren/Forest Reindeer):
·
Unterarten:
1. Rangifer fennicus fennicus Lönnberg, 1909 (Finnisches Waldren/Finnish Forest Reindeer).
2. Rangifer fennicus angustirostris Flerov, 1932 (Schmalnasen-Waldren/Narrow-nosed Reindeer).
3. Rangifer fennicus phylarchus Hollister, 1912 (Kamtschatka-Waldren/Kamchatka Reindeer); Terra typica: Südöstliches Kamtschatka, Russland.
4. Rangifer fennicus valentinae Flerov, 1933 (Sibirisches Waldren/Altai Forest Reindeer).
· Verbreitung: Eurasien (Finnland; Russland).
· Literatur: Flerov (1932, 1933); Gunn (2016); Harding (2022); Hollister (1912); Lönnberg (1909).
Rangifer tarandus (Linnaeus, 1758) (Tundraren/Eurasian Tundra Reindeer):
· Holotypus/Terra typica: Typusexemplar unbekannt. Schweden, Einschränkung durch Lönnberg (1909) auf Berge im Nordwesten Schwedens.
· Taxonomie: Ursprünglich als Cervus tarandus beschrieben, wurde die Art von Grey (1843) erstmals in der Gattung Rangifer gelistet.
· Unterarten:
1. Rangifer tarandus tarandus (Linnaeus, 1758) (Europäisches Tundraren/Mountain Reindeer).
2. †Ranigfer tarandus eogroenlandicus Degerbøl, 1957 (Ostgrönland-Tundraren/East Greenland Reindeer).
3. †Rangifer tarandus pearsoni Lydekker, 1902 (Novaya-Zemlya-Tundraren/Novaya Zemlya Reindeer); Terra typica: Novaya Zemlya, Russland.
4. †Rangifer tarandus setoni Flerov, 1933 (Seton-Tundraren/Saghalien Reindeer); Terra typica: Sachalin, Russland.
5. Rangifer tarandus sibiricus (von Schreber, 1784) (Sibirisches Tundraren/Siberian Reindeer).
· Synonyme: Cervus tarandus rangifer Gmelin, 1788 (oft fälschlicherweise als Tarandus rangifer Gmelin, 1788 zitiert); Cerv tarandus rangifer Kerr, 1792; Tarandus lapponum Billberg, 1827; Tarandus borealsi Rüppell, 1842; Tarandus rangifer Gray, 1852; Tarandus furcifer Baird, 1852.
· Bestand: Gefährdet; Population abnehmend; ca. 2,9 Mio. Tiere.
· Verbreitung: Eurasien (Finnland; Norwegen; Russland; Schweden; in Grönland ausgestorben).
· Literatur: Baird (1852); Baranova et al. (2012); Billberg (1827); Degerbøl (1957); Flerov (1933); Gmelin (1788); Gray (1852); Grey (1843); Gunn (2016); Harding (2022); Kerr (1792); Linnaeus (1758); Lönnberg (1909); Lydekker (1902); Rüppell (1842); Schreber (1784).
Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Capreolinae > Odocoileini > Mazama
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
Mazama |
|
|
|
|||
|
|
|
|
||||
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Genus Mazama Rafinesque,
1817 (Gattung
Rote Spießhirsche):
· 7 Arten.
Mazama tienhoveni van Roosmalen & van Hooft, 2015 (Tienhoven-Mazama/Van
Tienhoven’s Fair Brocket):
· Holotypus/Terra typica: INPA4273 (Säugetiersammlung des Nationalinstituts für Amazonas-Forschung Manaus), adultes Weibchen, gesammelt am 12. Mai 2006 von lokalen Jägern am linken Ufer des Aripuanã-Flusses, Brasilien.
· Taxonomie: Da keine weiteren Paratypen gesammelt wurden, liegen nur wenige Daten vor, weshalb die meisten Autoren die Art bisher nicht anerkennen. Eine Analyse der mitochondriellen DNA (cytochrome b) stellt tienhoveni in einen separaten Zweig.
· Bestand: Nicht bewertet; wahrscheinlich vom Aussterben bedroht.
·
Literatur: Van Roosmalen (2015).
Mazama bricenii O. Thomas, 1898 (Nördlicher Zwergmazama/Merida Brocket):
· Taxonomie: Von einigen Autoren wird bricenii als Synonym von rufina betrachtet.
· Bestand: Gefährdet; Population abnehmend.
·
Literatur: Thomas
(1898).
Mazama rufina (Pucheran, 1852)
(Roter Kleinmazama/Little
Red Brocket):
· Taxonomie: Ursprünglich als Cervus rufinus beschrieben. Das Taxon bricenii wird teilweise als Synonym betrachtet.
· Bestand: Gefährdet; Population abnehmend.
·
Literatur: Pucheran (1852).
Mazama americana
(Erxleben, 1777) (Gemeiner Großmazama/Common
Red Brocket):
· Bestand: Daten defizitär; Populationsentwicklung unbekannt.
·
Literatur: Erxleben
(1777).
Mazama temama (Kerr, 1792) (Mexikanischer Großmazama/Mexican Red Brocket):
· Terra typica: Mirador, Veracruz, Mexiko.
· Synonyme: Mazama tema Rafinesque, 1817; Mazama sartorii (Saussure, 1860); Mazama reperticia E. A. Goldman (1913); Mazama cerasina Hollister, 1914.
· Bestand: Daten defizitär; Population abnehmend.
· Verbreitung: Mittelamerika (Belize; Costa Rica; El Salvador; Guatemala; Honduras; Kolumbien; Mexiko; Nicaragua; Panama).
· Literatur: Goldman (1913); Hollister (1914); Kerr (1792); Rafinesque (1817); Saussure (1860).
Mazama jucunda O. Thomas, 1913 (Küstenwald-Mazama/Small
Red Brocket):
· Terra typica: Roça Nova, Serra do Mar im Staat Paraná, Brasilien.
· Synonyme: Mazama bororo A. Miranda-Ribeiro (1919); Mazama bororo Duarte, 1996.
· Bestand: Gefährdet; Population abnehmend.
· Literatur: Duarte (1996); Miranda-Ribeiro (1919); Thomas (1913).
Mazama nana (Lesson, 1842)
(Gemeiner Kleinmazama/Lesser
Red Brocket):
· Terra typica: Rio Grande do Sul, Brasilien.
· Bestand: Gefährdet; Populationsentwicklung unbekannt.
· Verbreitung: Südamerika (Argentinien; Brasilien; Paraguay).
· Literatur: Lesson (1842).
Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Capreolinae > Odocoileini > Odocoileus
Genus Odocoileus Rafinesque, 1832 (Gattung Weißwedelhirsche):
· 4 Arten.
· Literatur: Rafinesque (1832).
Odocoileus pandora (Merriam, 1901) (Yucatán-Spießhirsch/Yucatan
Brown Brocket):
· Holotypus/Terra typica: USNM 108273 (Vereinigte Staaten Nationalmuseum für Naturgeschichte Washington), gesammelt bei Tunkas, Yucatán, Mexiko.
· Taxonomie: Ursprünglich als Mazama pandora beschrieben, wird hier den Ergebnissen der genetischen Analysen von Gutiérrez et al. (2017) und Heckeberg et al. (2016) gefolgt und die Art in der Gattung Odocoileus eingeordnet.
· Bestand: Gefährdet; Population abnehmend.
·
Verbreitung: Mittelamerika (Belize; Guatemala; Mexiko)
·
Literatur: Gutiérrez et al. (2017);
Heckeberg et al.
(2016); Merriam
(1901); Weber, de Grammont
& Cuarón (2016).
Odocoileus virginianus
(Zimmermann, 1780) (Weißwedelhirsch/White-tailed Deer):
· Taxonomie: Vermutlich handelt es sich bei O. virginianus um einen Artkomplex.
· Bestand: nicht gefährdet
· Verbreitung: Nord-, Mittel- und Südamerika (südliches Kanada, USA, Mexiko bis Kolumbien, Ecuador, Peru, Nordbolivien)
· Paarungszeit: November bis Januar, in den Tropen ganzjährig
· Tragzeit: 196-224 Tage
Odocoileus columbianus (Richardson, 1829) (Schwarzwedelhirsch/Black-tailed
Deer):
·
Unterarten: British-Columbia-Schwarzwedelhirsch
(O. columbianus
columbianus), Alaska-Schwarzwedelhirsch
(O. columbianus
sitkensis)
· Bestand: nicht gefährdet
· Verbreitung: Westliches Nordamerika (Südalaska, Westkanada)
· Paarungszeit: Oktober bis Dezember
· Tragzeit: 196-210 Tage
· Geschlechtsreife: bei beiden Geschlechtern mit 18 Monaten; erste Paarung der Männchen aber meist mit 2-3 Jahre
Odocoileus hemionus (Rafinesque, 1817) (Maultierhirsch/Mule Deer):
· Vermutlich Artkomplex
· Unterarten: Felsengebirgs-Maultierhirsch (O. hemionus hemionus), Kalifornischer Maultierhirsch (O. hemionus californicus), Cedros-Maultierhirsch (O. hemionus cerrosensis), Arizona-Maultierhirsch (O. hemionus eremicus), Nördlicher Baja-California-Maultierhirsch (O. hemionus fuliginatus), Südlicher Baja-California-Maultierhirsch (O. hemionus peninsulae)
· Bestand: nicht gefährdet
· Verbreitung: Westliches Nordamerika (Westliche USA, Nordwestmexiko)
· Paarungszeit: Oktober bis Dezember
· Tragzeit: 196-210 Tage
· Geschlechtsreife: bei beiden Geschlechtern mit 18 Monaten; erste Paarung der Männchen aber meist mit 2-3 Jahre
Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Capreolinae > Odocoileini > Passalites
|
Passalites |
|
|
|
|
Genus Passalites Gloger, 1841 (Gattung Amazonien-Spießhirsche):
·
5 Arten; Generotypus Passalites nemorivagus (F. Cuvier, 1817).
·
Literatur: Gloger
(1841).
Passalites nemorivagus (F. Cuvier, 1817) (Amazonien-Mazama/Amazonian
Brown Brocket):
·
Taxonomie: Ursprünglich als Cervus nemorivagus beschrieben. Fischer (1814) betrachtete nemorivagus als
Synonym von Subulo gouazoubira,
doch molekularbiologische und cytogenetische Studien
stützen den Status als separate Art (Duarte, Gonzáles
& Maldonado, 2008;
Fiorillo
et al., 2013). Alle
Spießhirsche bzw. Mazamas wurden lange Zeit in die
Gattung Mazama
gestellt. Da es sich aber nach genetischen Analysen um keine monophyletische
Gruppe handelt, überführten Morales-Donoso et
al. (2023) nemorivagus in
die wiederbelebte Gattung Passalites.
·
Bestand: Nicht
gefährdet; Population abnehmend.
·
Verbreitung: Südamerika (Brasilien; Ekuador;
Französisch-Guyana; Guyana; Kolumbien; Panama; Peru; Venezuela).
·
Literatur: Cuvier
(1817); Duarte, González & Maldonado (2008); Fiorillo et al. (2013);
Fischer (1814); Morales-Donoso et al. (2023);
Rossi & Duarte (2016).
Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Capreolinae > Odocoileini > Pudu
Genus Pudu Gray, 1852 (Gattung Puduhirsche):
· 2 Arten
Pudu mephistophiles (de Winton, 1896) (Nordpudu/Northern
Pudu):
· Bestand: gefährdet
Pudu puda
(Molina, 1782) (Südpudu/Southern
Pudu):
· Bestand: gefährdet
Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Capreolinae > Odocoileini > Ozotoceros
|
Ozotoceros |
|
|
|
|
Genus
Ozotoceros
Ameghino, 1891 (Gattung Pampashirsche):
·
1 Arten
Ozotoceros bezoarticus (Linnaeus, 1758) (Pampashirsch/Pampas
Deer):
·
Bestand: gering gefährdet (Vorwarnliste)
Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Capreolinae > Odocoileini > Blastocerus
|
Blastocerus |
|
|
|
|
Genus Blastocerus Wagner, 1844 (Gattung Sumpfhirsche):
· 1 Art
Blastocerus dichotomus
(Illiger, 1815) (Sumpfhirsch/Marsh Deer):
· Bestand: gefährdet
Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Capreolinae > Odocoileini > Hippocamelus
|
|
|
|
|
|
Hippocamelus |
|
|
|
|
|
|
||
|
|
|
|
Genus Hippocamelus Leuckart, 1816 (Gattung Andenhirsche):
· 2 Arten
Hippocamelus antisensis
(d’Orbigny,
1834) (Nördlicher
Andenhirsch/North Andean Huemul):
· Bestand: gefährdet
Hippocamelus bisulcus (Molina, 1782) (Südlicher Andenhirsch/South Andean Huemul):
· Bestand: stark gefährdet
Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Capreolinae > Odocoileini > Subulo
|
|
|
|
|
|
Subulo |
|
|
|
|
|
|
||
|
|
|
|
Genus Subulo C. H. Smith, 1827 (Gattung Graue Spießhirsche/Gray Brockets):
·
5 Arten; Generotypus ursprünglich
Subulo simplicicornis
C. H. Smith, 1827, wird aber u.a. nach
genetischen Analysen (Sandoval et al.,
2023) als Synonym von Subulo gouazoubira (G. Fischer
von Waldheim, 1814) betrachtet.
· Taxonomie: Ursprünglich als Untergattung von Cervus eingeführt, nutzten Fitzinger (1873) und Pelzeln (1883) Subulo im Rang einer Gattung. Danach betrachteten die meisten Autoren Subulo als Synonym von Mazama. Bernegossi et al. (2023) belebten Subulo aber wieder als vollwertige Gattung, nachdem genetische Analysen zeigte, dass die in der Gattung Mazama eingeordneten Arten keine monophyletische Gruppe bilden.
· Synonyme: Coassus J. E. Gray, 1843; Doryceros Fitzinger, 1879; Nanelaphus Fitzinger, 1879; Azarina Larrañaga, 1923.
·
Literatur: Bernegossi et al. (2023); Fischer (1814); Fitzinger (1873, 1879); Gray (1843); Larrañaga (1923); Pelzeln (1883); Sandoval et al. (2023);
Smith (1827).
Subulo chunyi (Hershkovitz, 1959) (Südlicher Zwergmazama/Peruvian Dwarf Brocket):
·
Holotypus/Terra typica:
AMNH 73098 (Amerikanisches Museum für Naturgeschichte New York), gesammelt bei Cocapunco, Königskordillere,
Bolivien.
·
Taxonomie: Genetische Analysen deuten auf eine nähere
Verwandtschaft mit gouazoubira hin (Gutiérrez et al.,
2017; Heckeberg et al., 2016).
·
Bestand: Gefährdet;
Population abnehmend.
·
Verbreitung: Südamerika (Bolivien; Peru).
·
Literatur: Gutiérrez et al. (2017);
Heckeberg et al.
(2016); Hershkovitz
(1959); Rumiz & Barrio (2016).
Subulo gouazoubira (Fischer, 1814) (Graumazama/Common
Brown Brocket):
· Neotypus/Terra typica: Ursprünglich Paraguay, von Cabrera (1961) auf die Asunción-Region eingeschränkt. Der Neotypus wurde an der Staatsstraße 12, km 20 Puerto Galileo, José-Falcón-Distrikt, Asunción-Region, Paraguay, gesammelt.
· Taxonomie: Zunächst mit einem Schreibfehler als Cervus gouazoupira beschrieben und später in gouazoubira korrigiert. Hershkovitz (1951) überführte die Art in die Gattung Mazama. Da die Mazamas aber nach genetischen Analysen keine monophyletische Gruppe darstellen, ordneten Bernegossi et al. (2023) gouazoubira in die wiederbelebte Gattung Subulo ein.
· Synonyme: Cervus simplicicornis Illiger, 1815 (Terra typica: Brasilien); Mazama bira Rafinesque, 1817; Coassus superciliaris J. E. Gray, 1852; Nanelaphus namby Fitzinger, 1879; Mazama simplicicornis argentina Lönnberg, 1919; Mazama simplicicornis var. konzeritzi A. Miranda-Ribeiro, 1919; Azarina fusca Larrañaga, 1923.
· Bestand: Nicht gefährdet; Population abnehmend.
· Verbreitung: Südamerika (Argentinien; Bolivien; Brasilien; Paraguay; Uruguay).
·
Literatur: Bernegossi et al. (2023); Black-Decima & Vogliotti (2016); Fischer
(1814); Fitzinger
(1879); Gray (1852); Hershkovitz (1951);
Illiger (1815); Larrañaga (1923); Lönnberg
(1919); Miranda-Ribeiro
(1919); Rafinesque (1817); Sandoval et al. (2023).
Cetartiodactyla > Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Capreolinae > Alceini > Alces
|
|
|
|
|
|
|
|
Alceini |
|
Alces |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
Tribus Alceini Brookes, 1828 (Gattungsgruppe Elchhirsche/Camel Deer):
· 2 Arten.
· Literatur: Brookes (1828).
Genus Alces Gray, 1821 (Gattung Elche/Moose):
· 2 Arten; Generotypus Alces alces (Linnaeus, 1758).
· Literatur: Linnaeus (1758).
Alces alces (Linnaeus, 1758)
(Eurasischer Elch/Eurasian
Moose):
· Holotypus/Terra typica: Typusexemplar unbekannt, Vänersborg, Schweden.
· Taxonomie: Ursprünglich als Cervus alces beschrieben. Häufig werden Eurasischer und Amerikanischer Elch auch nur als Unterarten einer einzigen Elchart betrachtet. Die Grenze zwischen beiden Taxa verläuft am Fluss Jenissei (Boeskorov, 2003), wo es auch zu Hybriden zwischen beiden genetischen Linien kommt.
·
Unterarten:
1. Alces alces alces (Linnaeus, 1758) (Nordelch/European
Moose). Synonyme: Alces machlis uralensis Matschie,
1913; Alces machlis meridionalis Matschie,
1913; Alces alces tymensis Zykowsky, 1915; Alces alces alces Lydekker,
1915.
2. †Alces alces caucasicus Vereshchagin, 1955 (Kaukasischer Elche/Caucasian Moose). Lektotypus/Terra typica: ZIN 23615 (Zoologisches Museum Sankt Petersburg), Männchen, gesammelt am Fluss Urukh, Makhchet-Distrikt, Nordossetien, Russland. Synonyme: Alces alces caucasicus Naniev, 1956.
· Synonyme: Alces machlis Ogilby, 1837; Alces palmatus Gray, 1843; Alces jubata Fitzinger, 1860; Cervus coronatus Lesson, 1827
· Identifizierung/Beschreibung: 68 Chromosomen.
· Bestand: Nicht gefährdet; Population zunehmend; Unterart Kaukasischer Elch ausgestorben.
· Verbreitung: Eurasien (Deutschland; Estland; Finnland; Kasachstan; Kroatien; Lettland; Litauen; Moldawien; Norwegen; Polen; Rumänien; Russland; Slowakei; Tschechien; Ukraine; Ungarn; Weißrussland; in Österreich ausgestorben).
· Literatur: Boeskorov (2003); Fitzinger (1860); Gray (1843); Hundertmark (2016); Lesson (1827); Linnaeus (1758); Lydekker (1915); Matschie (1913); Naniev (1956); Ogilby (1837); Vereshchagin (1955); Zykowsky (1915).
Alces americanus (Clinton, 1822) (Amerikanischer Elch/American Moose):
· Holotypus/Terra typica: Typusexemplar unbekannt, vermutlich nördliche Adirondack-Region (nördlich Whitestone), New York, Vereinigte Staaten.
· Taxonomie: Ursprünglich als Cervus americanus beschrieben. Häufig werden Eurasischer und Amerikanischer Elch auch nur als Unterarten einer einzigen Elchart betrachtet. Die Grenze zwischen beiden Taxa verläuft am Fluss Jenissei (Boeskorov, 2003), wo es auch zu Hybriden zwischen beiden genetischen Linien kommt. Es werden anhand morphologischer Merkmale sechs Unterarten unterschieden (Boeskorov, 2003).
· Unterarten:
1. Alces americanus americanus (Clinton, 1822) (Ostkanadischer Elch/Eastern Moose). Synonyme: Alces alces americana Peterson, 1952; Alces americana americana Miller, 1924; Alces machlis americanus Lydekker, 1901.
2. Alces americanus andersoni Peterson, 1950 (Westkanadischer Elch/Northwestern Moose). Holotypus/Terra typica: ROM 20068 (Königliches Ontario-Museum für Zoologie und Paläontologie), Männchen, gesammelt im Sprucewood-Waldreservat, Provinz Manitoba, Kanada. Synonyme: Alces columbae Lydekker, 1907; Alces alces andersoni Peterson, 1952.
3. Alces americanus cameloides (Milne-Edwards, 1867) (Ussurischer Elch/Ussurain Moose). Holotypus/Terra typica: Typusexmplar ungekannt, Heilonjiang (Mandschurei), China. Ursprünglich als eigene Art Cervus cameloides beschrieben, aber inzwischen als Unterart oder Synonym von Alces americanus oder Alces alces gelistet. Synonyme: Alces alces bedfordi Bobrinskoi, 1928; Alces alces cameloides Allen, 1940.
4. Alces americanus gigas Miller, 1899 (Alaska-Elch/Alaskan Moose). Holotypus/Terra typica: USNM 86166 (Nationalmuseum der Vereinigten Staaten Washington), Männchen, gesammelt an der Nordseite des Tustumena-Sees, Kenai-Halbinsel, Alaska, Vereinigte Staaten. Ursprünglich als eigene Art Alces gigas beschrieben, aber inzwischen als Unterart oder Synonym von Alces americanus oder Alces alces gelistet. Synonyme: Alces americanus gigas Osgood, 1904; Alces alces buturlini Chernyavski & Zhelesnov, 1982; Alces alces gigas Lydekker, 1915.
5. Alces americanus pfitzenmayeri Zykowsky, 1910 (Ostsibirischer Elch/Yakutin Moose). Holotypus/Terra typica: Typusexemplar unbekannt, Becken des Aldan-Flusses, Yakutia, Ostsibirien, Russland. Ursprünglich als eigene Art Alces pfitzenmayeri beschrieben, aber inzwischen als Unterart oder Synonym von Alces americanus oder Alces alces gelistet. Synonyme: Alces machlis yakutensis Millais, 1911.
6. Alces americanus shirasi Nelson, 1914 (Yellowstone-Elch/Yellowstone Moose). Holotypus/Terra typica: USNM 202975 (Nationalmuseum der Vereinigten Staaten Washington), gesammelt am Fluss Snake-River, Lincoln-Bezirk, Wyoming, Vereinigte Staaten. Synonyme: Alces alces shirasi Peterson, 1952.
· Synonyme: Alces americanus Jardine, 1835; Alces bedfordiae Lydekker, 1902.
·
Identifizierung/Beschreibung: 2n = 70
Chromosomen.
·
Bestand: Nicht bewertet; IUCN führt americanus nicht
getrennt von alces.
·
Verbreitung: Asien (China; Mongolei; Russland),
Nordamerika (Kanada; Vereinigte Staaten).
·
Literatur: Allen
(1940); Bobrinskoi
(1928); Boeskorov
(2003); Chernyavski & Zhelesnov
(1982); Clinton (1822); Jardine (1835); Lydekker (1901, 1902, 1907,
1915); Miller (1899, 1924); Milne-Edwards (1867); Nelson (1914); Osgood (1904); Peterson
(1950, 1952); Zykowsky
(1910).
Cetartiodactyla > Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Capreolinae > Capreolini
|
|
|
|
|
|
Capreolini |
|
|
|
|
|
|
||
|
|
|
|
Tribus Capreolini Brookes, 1828 (Gattungsgruppe Rehe/Roe Deer):
· 3 Arten.
Genus Capreolus Gray, 1821 (Gattungs Eigentliche Rehe/Common Roe Deer):
· 2 Arten.
Genus Hydropotes Swinhoe, 1870 (Gattung Wasserrehe/Water Deer):
· 1 Art.
Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Capreolinae > Capreolini > Capreolus
|
|
|
|
|
|
Capreolus |
|
|
|
|
|
|
||
|
|
|
|
Genus Capreolus Gray, 1821 (Gattungs Eigentliche Rehe/Roe Deer):
· 2 Arten.
Capreolus capreolus (Linnaeus, 1758) (Europäisches Reh/Western Roe Deer):
· 70 Chromosomen, keine B-Chromosomen
· Bestand: nicht gefährdet
Capreolus pygargus (Pallas, 1771) (Sibirisches Reh/Eastern Roe Deer):
· 70 Chromosomen, variierende Zahl von B-Chromosomen
· Unterarten: Westsibirisches Reh (C. pygargus pygargus), Ostsibirisches Reh (C. pygargus tianschanicus)
· Bestand: nicht gefährdet
Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Capreolinae > Capreolini > Hydropotes
|
Hydropotes |
|
|
|
|
Genus Hydropotes Swinhoe, 1870 (Gattung Wasserrehe/Water Deer):
· 1 Arten
Hydropotes inermis Swinhoe, 1870 (Chinesisches Wasserreh/Chinese Water Deer):
· Unterarten: Ostchinesisches Wasserreh (H. inermis inermis), Koreanisches Wasserreh (H. inermis argyropus)
· Bestand: gefährdet
Fereuungulata > Cetartiodactyla
> Artiofabula
> Cetruminantia
> Ruminantia > Pecora > Bovoidea > Cervidae > Cervinae
|
|
|
|
|
|
Cervinae |
|
|
|
|
|
|
||
|
|
|
|
Subfamilia Cervinae Goldfuß, 1820 (Unterfamilie Echthirsche/Old World Deer):
· Alternative Bezeichnung: Altwelthirsche.
· 59 Arten, davon eine ausgestorben.
· Synonyme: Plesiometacarpalia Brooke, 1878.
· Literatur: Brooke (1878); Goldfuß (1820).
Tribus Cervini Goldfuß, 1820 (Gattungsgruppe Echte Altwelthirsche/True Deer):
· 42 Arten, davon eine ausgestorben.
· Literatur: Goldfuß (1820).
Tribus Muntiacini Pocock, 1923 (Gattungsgruppe Muntjakhirsche/Barking Deer):
· 17 Arten.
· Literatur: Pocock (1923).
Cetartiodactyla > Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Cervinae > Cervini
Tribus Cervini Goldfuss, 1820 (Gattungsgruppe Echte Altwelthirsche/True Deer):
· 42 Arten, davon eine ausgestorben
Genus Axis C. H. Smith, 1827 (Gattung Axishirsche/Axis Deer):
· 5 Arten.
Genus Rucervus Hodgson, 1838 (Gattung Barasinghahirsche/Swamp Deer):
· 4 Arten, davon eine ausgestorben.
Genus Dama Frisch, 1775 (Gattung Damhirsche/Fallow Deer):
· 2 Arten.
Genus
Cervus Linnaeus, 1758 (Gattung Edelhirsche/Red Deer):
· 27 Arten.
Genus Panolia Gray, 1843 (Gattung Leierhirsche/Eld’s Deer):
· 3 Arten.
Genus Elaphurus Milne-Edwards,
1866 (Gattung
Davidshirsche/Père David’s Deer):
· 1 Art.
Cetartiodactyla > Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Cervinae > Cervini > Axis
Genus Axis C. H. Smith, 1827 (Gattung Axishirsche/Axis Deer):
· 5 Arten. Stammbaum basierend auf den Ergebnissen von Gupta et al. (2018).
Axis axis (Erxleben, 1777) (Axishirsch/Chital):
· Taxonomie: Zunächst als Cervus axis beschrieben.
· Bestand: Nicht gefährdet; aktuelle Entwicklung der Population nicht bekannt.
· Verbreitung: Südasien (Sri Lanka; Indien; Nepal; Bangladesch; Bhutan).
· Literatur: Duckworth et al. (2015).
Axis annamiticus (Heude, 1888) (Hinterindischer Schweinshirsch/Indochina Hog Deer):
· Bestand: Vom Aussterben bedroht; Klassifizierung nach Brook, Nasak & Channa (2015), von der IUCN aktuell noch zusammen mit A. porcinus gelistet.
· Verbreitung: Südost-Asien (Kambodscha).
·
Literatur: Brook, Chanta & Phan (2015); Mattioli (2011, 2020); Groves &
Grubb (2011); Timmins
et al. (2015).
Axis porcinus (Zimmermann, 1780) (Indischer Schweinshirsch/Indian Hog Deer):
· Bestand: Stark gefährdet; Population abnehmend.
· Literatur: Groves & Grubb (2011); Mattioli (2011, 2020); Timmins et al. (2015).
Axis calamianensis (Heude,
1888) (Calamian-Schweinshirsch/Bawean Deer):
· Taxonomie: Ursprünglich von Heude als Unterart Axis porcinus calamianensis beschrieben, wurde die Form von Groves & Grubb (1987) später in den Artstatus erhoben.
· Bestand: Stark gefährdet; Population abnehmend.
· Verbreitung: Ostasien (Philippinen).
· Literatur: Groves & Grubb (1987, 2011); Mattioli (2011, 2020); Widmann & Lastica (2015).
Axis kuhlii (Müller & Schlegel, 1845) (Bawean-Schweinshirsch/Bawean Deer):
· Taxonomie: Zunächst als Cervus kuhlii beschrieben.
· Bestand: Vom Aussterben bedroht.
· Verbreitung: Südost-Asien (Indonesien: Java).
·
Literatur: Mattioli
(2011, 2020); Semiadi, Duckworth & Timmins (2015).
Cetartiodactyla > Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Cervinae > Cervini > Rucervus
Genus
Rucervus
Hodgson, 1838 (Gattung Barasinghahirsche/Swamp
Deer):
· 4 Arten, davon eine ausgestorben. Stammbaum orientiert sich an den Ergebnissen von Kumar et al. (2016, 2017) und Pitra et al. (2004).
· Literatur: Groves (1983); Groves & Grubb (2011); Kumar et al. (2016, 2017); Pitra et al. (2004).
†Rucervus schomburgki (Blyth, 1863) (Schomburgk-Hirsch/Schomburgk’s Deer):
· Bestand: Ausgestorben (seit ca. 1932 in der Natur und seit ca. 1938 in Haltung).
· Verbreitung: Südasien (ehemals Thailand, möglicherweise auch Laos).
·
Literatur: Duckworth,
Robichaud & Timmins (2015); Groves (1983);
Groves &
Grubb (2011).
Rucervus branderi Pocock, 1943 (Hochland-Barasinghahirsch/Hard-ground Barasingha):
· Bestand: Gefährdet (ranjitsinhi, branderi und duvaucelii von IUCN gemeinsam bewertet).
·
Verbreitung: Südasien (Indien).
·
Literatur: Duckworth
et al. (2015); Groves (1983);
Groves &
Grubb (2011); Kumar et al. (2016,
2017); Mattioli (2011, 2020).
Rucervus duvaucelii (G. Cuvier, 1823) (Westlicher Barasinghahirsch/Western Barasingha):
· Bestand: Gefährdet (ranjitsinhi, branderi und duvaucelii von IUCN gemeinsam bewertet).
· Verbreitung: Südasien (Nepal; Indien; in Pakistan ausgestorben).
·
Literatur: Duckworth
et al. (2015); Groves (1983);
Groves &
Grubb (2011); Kumar et al. (2016,
2017); Mattioli (2011, 2020).
Rucervus ranjitsinhi (Groves, 1983) (Östlicher Barasinghahirsch/Eastern Barasingha):
· Taxonomie: Zunächst als Unterart Cervus duvauceli ranjitsinhi beschrieben, wird der Östliche Barasinghahirsch auch aktuell meist noch als Unterart von Rucervus duvaucelii geführt. Groves & Grubb (2011) erhoben das Taxon aber anhand von morphologischen Merkmalen in den Artstatus. Genetische Untersuchungen von Kumar et al. (2016, 2017) bestätigen auch eine genetische Isolierung der drei Barasingha-Formen mit geringem Austausch in der jüngeren Vergangenheit.
· Bestand: Gefährdet (ranjitsinhi, branderi und duvaucelii von IUCN gemeinsam bewertet).
· Verbreitung: Südasien (Indien; in Bangladesch ausgestorben).
·
Literatur: Duckworth
et al. (2015); Groves (1983);
Groves &
Grubb (2011); Mattioli (2011, 2020).
Cetartiodactyla > Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Cervinae > Cervini > Dama
Genus Dama Frisch, 1775 (Gattung Damhirsche/Fallow Deer):
· 2 Arten
Dama dama (Linnaeus, 1758) (Europäischer Damhirsch/Common Fallow Deer):
· Bestand: Nicht gefährdet; aktuelle Entwicklung der Population nicht bekannt.
· Verbreitung: Südwest-Asien (Türkei), Europa (bei den Populationen in den Ländern Italien, Slowenien, Bosnien-Herzegowina, Serbien, Montenegro, Kroatien, Bulgarien, Mazedonien, Griechenland und Zypern ist unklar, ob es sich um natürliche Vorkommen oder Einbürgerungen handelt), in zahlreichen weiteren Ländern eingebürgert.
· Literatur: Bubenik (1959); Feldhamer, Farris-Renner & Barker (1988); Ferguson, Porath & Paley (1985); Geist (1998); Haltenorth (1959); Harrison & Bates (1991); Kraft (1959); Masseti & Mertzanidou (2008); Mattioli (2011, 2020); Pitra et al. (2004); Randi et al. (2006); Uerpmann (1987).
Dama mesopotamica (Brooke, 1875) (Mesopotamischer Damhirsch/Persian Fallow Deer):
· Taxonomie: Während der Mesopotamische Damhirsch von Feldhamer et al. (1988) und Geist (1998) als Unterart von Dama dama betrachtet wurde, zählten Haltenorth (1959), Ferguson et al. (1985), Uerpmann (1987) und Harrison & Bates (1991) ihn als separate Art. Inzwischen wird der Artstatus durch zahlreiche phylogenetische Studien gestützt.
· Bestand: Stark gefährdet; Population zunehmend.
· Verbreitung: Südwest-Asien (Iran; in Israel wieder eingeführt; in den Ländern Irak, Jordanien, Libanon, Syrien, Palästina und der Türkei ausgestorben).
· Literatur: Bubenik (1959); Feldhamer, Farris-Renner & Barker (1988); Ferguson, Porath & Paley (1985); Geist (1998); Haltenorth (1959); Harrison & Bates (1991); Kraft (1959); Mattioli (2011, 2020); Pitra et al. (2004); Randi et al. (2001); Steinhauf (1959); Uerpmann (1987); Werner et al. (2015).
Cetartiodactyla > Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Cervinae > Cervini > Cervus
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
|
Cervus |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Genus
Cervus Linnaeus, 1758 (Gattung Edelhirsche/Red Deer):
· 28 Arten; Generotypus Cervus elaphus Linnaeus, 1758. Der Stammbaum orientiert sich an den Ergebnissen von Mackiewicz et al. (2022), Pitra et al. (2004).
· Taxonomie: Nach Kumar et al. (2017) steht in der Tarim-Gruppe yarkandensis an der Basis, von der sich bactrianus vor ca. 1 Mio. Jahren und hanglu vor ca. 2 Mio. Jahren abspaltete.
· Literatur: Kumar et al. (2017); Linnaeus (1758).
Cervus
alfredi (P.
L. Sclater, 1870) (Prinz-Alfred-Hirsch/Philippine
Spotted Deer):
· Taxonomie: Ursprünglich als Rusa alfredi beschrieben. Nach genetischen Analysen wäre die Gattung Rusa paraphyletisch, weshalb der Prinz-Alfred-Hirsch hier der Gattung Cervus zugeordnet wird.
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge ca. 130 cm; Schwanzlänge ca. 12 cm; Gewicht ca. 40 kg.
· Bestand: Stark gefährdet; Population abnehmend; ca. 1.100 Tiere.
· Verbreitung: Ostasien (Philippinen: Panay, Negros).
· Literatur: Brook (2016); Sclater (1870).
Cervus nigellus (Hollister, 1913 (Mindanao-Berghirsch/Mindanao
Mountain Deer):
· Taxonomie: Ursprünglich als Rusa nigellus beschrieben. Nach genetischen Analysen wäre die Gattung Rusa paraphyletisch, weshalb der Mindanao-Berghirsch hier der Gattung Cervus zugeordnet wird. Das Taxon nigellus wird oft als Unterart von mariannus gelistet, hier Groves & Grubb (2011) folgend aufgrund der deutlich geringeren Größe jedoch als separate Art gelistet. Es sind jedoch für ein genaues Verständnis der Phylogenie zwischen den verschiedenen Hirschformen auf den Philippinen noch umfangreiche genetische Analysen notwendig.
· Bestand: Nicht bewertet; IUCN führt nigellus nicht von mariannus getrennt.
·
Verbreitung: Ostasien (Philippinen: Mindanao).
·
Literatur: Groves & Grubb
(2011); Hollister (1913).
Cervus barandanus (Heude, 1888) (Mindoro-Hirsch/Mindoro
Deer):
· Taxonomie: Ursprünglich als Ussa barandanus beschrieben, wird die Form oft als Unterart von mariannus gelistet, hier Groves & Grubb (2011) folgend jedoch aufgrund morphologischer Unterschiede als separate Art gelistet. Es sind jedoch für ein genaues Verständnis der Phylogenie zwischen den verschiedenen Hirschformen auf den Philippinen noch umfangreiche genetische Analysen notwendig.
· Bestand: Nicht bewertet; IUCN führt barandanus nicht von mariannus getrennt; Population abnehmend.
·
Verbreitung: Ostasien (Philippinen: Mindoro).
·
Literatur: Groves & Grubb
(2011); Heude (1888).
Cervus
mariannus Desmarest, 1822 (Philippinen-Hirsch/Philippine Deer):
· Taxonomie: Die Art wird oft in der Gattung Rusa C. H. Smith, 1827 geführt, die nach genetischen Analysen aber ein paraphyletisches Taxon darstellt, weshalb mariannus hier der Gattung Cervus zugeordnet wird. In der Vergangenheit wurde der Philippinen-Hirsch lange auch als regionale Variante von unicolor betrachtet. Haltenorth (1963) sowie Grubb & Groves (1983) klassifizierten mariannus jedoch als eigenständige Art. Die Taxa nigellus und barandanus werden oft als Unterarten geführt, hier jedoch als separate Arten betrachtet. Die Tieflandform auf Mindanao wird teilweise auch als Unterart nigricans geführt, hier aber als Synonym zu mariannus geführt. Es sind jedoch für ein genaues Verständnis der Phylogenie zwischen den verschiedenen Hirschformen auf den Philippinen noch umfangreiche genetische Analysen notwendig.
· Synonyme: Cervus nigricans Brooke, 1876.
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge ca. 140 cm; Schwanzlänge 8-12 cm; Gewicht 40-60 kg; 65 Chromosomen.
·
Bestand: Gefährdet; Population abnehmend.
·
Verbreitung: Ostasien (Philippinen: Luzon, Polillo, Catanduanes,
Samar, Leyte, Mindanao, Basilan, auf Bohol und Marinduque möglicherweise
ausgestorben, auf Biliran ausgestorben).
·
Literatur: Desmarest (1822); Grubb &
Groves (1983); Haltenorth
(1963); MacKinnon, Ong & Gonzales
(2015).
Cervus timorensis de Blainville, 1822 (Mähnenhirsch/Rusa Deer):
· Terra typica: Timor, Kleine Sunda-Inseln, Indonesien. Dort aber vermutlich vom Menschen eingeführt.
· Taxonomie/Etymologie: Die Zahl der Unterarten ist sehr umstritten, da viele Inselpopulationen wohl auf durch den Menschen verschleppte Tiere zurückzuführen sind. Die Taxa moluccensis und russa werden meist als Unterarten akzeptiert, da sie sich unter anderem auch bei den Fortpflanzungszeiten unterscheiden. Die Art wird oft in der Gattung Rusa C. H. Smith, 1827 geführt, die nach genetischen Analysen aber ein paraphyletisches Taxon darstellt, weshalb der Mähnenhirsch hier der Gattung Cervus zugeordnet wird. Das Artepitheton timorensis leitet sich von der Insel Timor ab, von der die Art als erstes beschrieben wurde.
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge ♂ 150-180 cm, ♀ 140-170; Schwanzlänge ca. 25 cm; Gewicht ♂ 70-135 kg, ♀ 50-90 kg. 60 Chromosomen.
·
Unterarten:
1. Cervus timorensis timorensis de Blainville, 1822 (Timor-Mähnenhirsch/Timor Deer).
2. Cervus timorensis djonga Van Bemmel, 1949 (Muna-Mähnenhirsch/Muna Deer).
3. Cervus timorensis floresiensis Heude, 1897 (Flores-Mähnenhirsch/Flores Deer).
4. Cervus timorensis macassarica Heude, 1896 (Sulawesi-Mähnenhirsch/Celebes Deer).
5. Cervus timorensis moluccensis Quoy & Gaimard, 1830 (Molukken-Mähnenhirsch/Moluccan Deer).
6. Cervus timorensis renschi Sody, 1932 (Bali-Mähnenhirsch/Bali Deer).
7. Cervus timorensis russa Müller & Schlegel, 1845(Java-Mähnenhirsch/Javan Deer).
· Bestand: Gefährdet; Population abnehmend.
· Verbreitung: Südost-Asien (Indonesien: Bali, Java, auf Alor, Ambon, Banda, Batjan, Buru, Butung, Flores, Halmahera, Komodo, Lembeh, Lombok, Mangole, Muna, Papua, Sanana, Saparua, Seram, Sulawesi, Sumba, Sumbawa, Taliabu, Ternate, Timor und Wetar vermutlich eingeführt).
· Literatur: Dahlan (2009); De Blainville (1822); Hedges et al. (2015); Hill, Thomas & Mackenzie (1987); Woodford (1994).
Cervus
equinus (G.
Cuvier, 1823) (Südostasiatischer Sambarhirsch/Southeast
Asian Sambar):
·
Unterarten:
1. Cervus equinus equinus
(G. Cuvier, 1823) (Sumatra-Sambarhirsch/Sumatran Sambar).
2. Cervus equinus brookei
(Borneo-Sambarhirsch/Bornean Sambar).
3. Cervus equinus cambojensis
(Yunnan-Sambarhirsch/Yunnan Sambar).
4. Cervus equinus swinhoii
Sclater, 1862 (Taiwan-Sambarhirsch/Formosan Sambar).
· Identifizierung/Beschreibung: 62 Chromosomen.
· Bestand: Nicht bewertet; IUCN führt equinus nicht von unicolor getrennt; Population abnehmend.
· Verbreitung: Asien (Bhutan; Brunei; China; Indonesien: Sumatra; Kambodscha; Laos; Malaysia; Myanmar; Taiwan; Thailand; Vietnam).
Cervus
unicolor Kerr, 1792 (Indischer Sambarhirsch/Indian Sambar):
·
Terra
typica: Sri Lanka.
·
Taxonomie: Zunächst als Unterart Cervus axis unicolor beschrieben. Die Art
wird derzeit noch häufig in der Gattung Rusa C. H. Smith,
1827 gelistet, die aber nach genetischen Analysen paraphyletisch ist. Folglich wird
hier unicolor wieder der Gattung Cervus zugeordnet.
·
Identifizierung/Beschreibung:
Kopf-Rumpf-Länge 160-250 cm; Schwanzlänge
25-33 cm; Gewicht ♂ 180-350 kg, ♀ 130-230 kg. 60 Chromosomen.
·
Bestand: Gefährdet; Population abnehmend.
·
Verbreitung: Südasien (Bangladesch; Indien; Nepal; Sri
Lanka).
·
Literatur: Kerr (1792);
Smith (1827); Timmins et al. (2015).
Cervus yarkandensis
Blanford, 1892 (Yarkand-Rothirsch/Yarkand
Stag):
· Taxonomie: Der Yarkand-Rothirsch wurde lange als Unterart von elaphus geführt. Genetische und morphologische Analysen zeigen aber, dass es sich bei den Rothirschen östliche des Kaspischen Meeres (Tarim-Gruppe) um eine separate Entwicklungslinie handelt, die sich vom elaphus-Komplex vor ca. 1,9 Mio. Jahren abspaltete (Mackiewicz et al., 2022). Während anhand morphologischer Merkmale yarkandensis auch von bactrianus und hanglu zu unterscheiden ist (Groves & Grubb, 2011), besteht auf genetischer Ebene noch Unsicherheit über Status und Verhältnis der drei Taxa untereinander, weshalb oft alle drei Formen der Tarim-Gruppe unter hanglu vereint werden. Nach Kumar et al. (2017) spaltete sich innerhalb der Tarim-Gruppe yarkandensis vor ca. 1,05 Mio. Jahren von bactrianus bzw. vor 2 Mio. Jahren von hanglu ab.
· Bestand: Nicht gefährdet; Population abnehmend; Von IUCN als Bestandteil von hanglu bewertet.
· Verbreitung: Asien (China: Xinjiang).
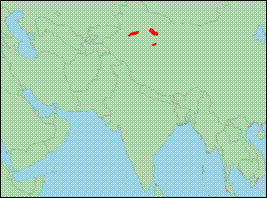
· Literatur: Blanford (1892); Groves & Grubb (2011); Kumar et al. (2017); Mackiewicz et al. (2022).
Cervus
bactrianus Lydekker, 1900 (Buchara-Hirsch/Bactrian Stag):
· Taxonomie: Der Buchara-Hirsch wurde lange als Unterart von elaphus geführt. Genetische und morphologische Analysen zeigen aber, dass es sich bei den Rothirschen östliche des Kaspischen Meeres (Tarim-Gruppe) um eine separate Entwicklungslinie handelt, die sich vom elaphus-Komplex vor ca. 1,9 Mio. Jahren abspaltete (Mackiewicz et al., 2022). Während anhand morphologischer Merkmale bactrianus auch von hanglu und yarkandensis zu unterscheiden ist (Groves & Grubb, 2011), besteht auf genetischer Ebene noch Unsicherheit über Status und Verhältnis der drei Taxa untereinander, weshalb oft alle drei unter hanglu vereint werden. Nach Kumar et al. (2017) ist bactrianus das Schwestertaxon bzw. vermutlich sogar Vorfahre von hanglu. Die Trennung der beiden Arten erfolgte vor ca. 1,2 Mio. Jahren.
· Bestand: Nicht gefährdet; Population zunehmend; durch Schutz- und Auswilderungsprojekte (WWF, Minnesota Zoo, Disney Fund) konnte von 2000-2011 der Bestand von 350 auf ca. 2.700 Tiere erhöht werden. Von IUCN als Bestandteil von hanglu bewertet.
· Verbreitung: Asien (Afghanistan; Kasachstan; Tadschikistan; Turkmenistan; Usbekistan).
·
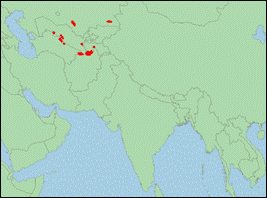
· Literatur: Brook et al. (2017); Groves & Grubb (2011); Kumar et al. (2017); Lydekker (1900); Mackiewicz et al. (2022).
Cervus hanglu Wagner, 1844 (Kaschmir-Rothirsch/Kashmir Stag):
· Taxonomie: Der Kaschmir-Rothirsch wurde lange als Unterart von elaphus geführt. Genetische und morphologische Analysen zeigen aber, dass es sich bei den Rothirschen östliche des Kaspischen Meeres (Tarim-Gruppe) um eine separate Entwicklungslinie handelt, die sich vom elaphus-Komplex vor ca. 1,9 Mio. Jahren abspaltete (Mackiewicz et al., 2022). Während anhand morphologischer Merkmale hanglu auch von bactrianus und yarkandensis zu unterscheiden ist (Groves & Grubb, 2011), besteht auf genetischer Ebene noch Unsicherheit über Status und Verhältnis der drei Taxa untereinander, weshalb oft alle drei unter hanglu vereint werden. Nach Kumar et al. (2017) ist bactrianus das Schwestertaxon bzw. vermutlich sogar Vorfahre von hanglu. Die Trennung der beiden Arten erfolgte vor ca. 1,2 Mio. Jahren.
· Bestand: Vom Aussterben bedroht; Population abnehmend; ca. 100-150 geschlechtsreife Tiere.
· Verbreitung: Südasien (Indien: Jammu-Kaschmir).
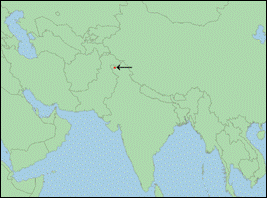
· Literatur: Brook et al. (2017); Groves & Grubb (2011); Kumar et al. (2017); Mackiewicz et al. (2022); Wagner (1844).
Cervus
maral Gray,
1850 (Kaukasusmaral/Persian
Red Deer):
·
Taxonomie: Die genaue Stellung von Cervus maral innerhalb der Gattung ist noch
nicht völlig geklärt. Während in einigen Untersuchungen der Maral
dem gesamten Europa-Nordafrika-Zweig
der Rothirsche gegenübersteht
(Kumar et
al., 2017; Pitra et al., 2004), sehen
ihn andere Analysen als Schwesterart
des Osteuropäischen Rothirsches
(Lorenzini & Garofalo, 2015; Mackiewicz
et al., 2022).
· Bestand: Nicht bewertet; IUCN führt maral nicht von elaphus getrennt.
·
Literatur: Gray
(1850); Kumar
et al. (2017); Lorenzini & Garofalo (2015);
Mackiewicz et al. (2022); Pitra et al.
(2004).
Cervus corsicanus Erxleben, 1777 (Nordafrikanischer Rothirsch/North African Red
Deer):
· Taxonomie: Häufig werden barbarus und corsicanus noch als Unterarten von elaphus geführt. Nach genetischen Analysen trennte sich der Nordafrikanische Rothirsch inklusive seiner auf Korsika und Sardinien vorkommenden Unterart aber schon vor mehr als 700.000 Jahren von seinen Verwandten auf dem europäischen Festland (Mackiewicz et al., 2022). Auch nach morphologischen Merkmalen lässt sich Cervus corsicanus von den europäischen Arten elaphus, italicus und pannonienses gut differenzieren (Groves & Grubb, 2011).
· Unterarten:
1. Cervus corsicanus corsicanus Erxleben, 1777 (Korsischer Rothirsch/Tyrrhenian Red Deer).
2. Cervus corsicanus barbarus Bennett, 1833 (Atlashirsch/Atlas Deer).
· Synonyme: Cervus corsiniacus Gervais, 1848.
· Bestand: Nicht bewertet; IUCN führt corsicanus nicht von elaphus getrennt; ca. 10.000 Tiere.
· Verbreitung: Europas (Frankreich: Korsika; Italien: Sardinien), Afrika (Algerien; Tunesien; in Marokko ausgestorben).
· Literatur: Bennett (1833); Erxleben (1777); Groves & Grubb (2011); Mackiewicz et al. (2022).
Cervus
elaphus Linnaeus, 1758
(Westeuropäischer
Rothirsch/West European Red Deer):
· Terra typica: Schweden.
· Unterarten:
1. Cervus elaphus elaphus Linnaeus, 1758 (Nordeuropäischer Rothirsch/North European Red Deer).
2. Cervus elaphus hippelaphus Erxleben, 1777 (Mitteleuropäischer Rothirsch/Central European Red Deer).
3. Cervus elaphus hispanicus Hilzheimer, 1909 (Iberischer Rothirsch/Spanish Red Deer). Synonyme: Cervus bolivari Cabrera, 1911.
· Synonyme: Cervus albicus Matschie, 1907; Cervus albifrons Reichenbach, 1845; Cervus albus Desmarest, 1822; Cervus bajovaricus Matschie, 1907; Cervus balticus Matschie, 1907; Cervus debilis Matschie, 1912; Cervus germanicus Desmarest, 1822; Cervus montanus Botezat, 1903 (Name war bereits als Synonym von Odocoileus hemionus vergeben); Cervus neglectus 1912; Cervus rhenanus Matschie, 1907; Cervus saxonicus Matschie, 1912; Cervus typicus Lydekker, 1898; Cervus varius Fitzinger, 1874; Cervus visurgensis Matschie, 1912; Cervus vulgaris Botezat, 1903.
· Bestand: Nicht gefährdet; Population zunehmend.
· Literatur: Erxleben (1777); Linnaeus (1758).
Cervus
italicus Zachos,
Mattioli, Ferretti & Lorenzini, 2014 (Mesola-Rothirsch/Mesola Red Deer):
·
Holotypus/Terra typica: NMW 68166 (Naturhistorisches
Museum Wien), adultes Männchen,
gesammelt im September 2012
von Giovanni Nobili vom Staatlichen Forstwirtschaftsamt, Ortsbüro für
Biodiversität in Punta Marina (Ravenna), Naturschutzgebiet Bosco della Mesola, Provinz Ferrara, Italien.
·
Taxonomie: Ursprünglich als Unterart von elaphus beschrieben.
Es handelt sich vsl. nur noch
um eine kleine Reliktpopulation, die mit den Rothirschen in Osteuropa verwandt ist.
· Bestand: Nicht bewertet; IUCN führt italicus nicht von elaphus getrennt.
·
Verbreitung: Europa (Italien). Beschränkt auf das Naturschutzgebiet
Bosco della Mesola in der italienischen Provinz Ferrara.
·
Literatur: Zachos et al.
(2014).
Cervus
pannonienses Banwell,
1997 (Osteuropäischer
Rothirsch/East European Red Deer):
·
Synonyme: Cervus
campestris Botezat, 1903; Cervus carpathicus
Tatarinov, 1956.
·
Literatur: Banwell
(1997).
Cervus
albirostris Przewalski, 1883 (Weißlippenhirsch/White-lipped Deer):
· Taxonomie: Der Weißlippenhirsch wurde zeitweise in eine eigene Gattung Przewalskium Flerov, 1930 gestellt. Genetische Analysen stellen ihn aber in die Gattung Cervus und identifizieren ihn als Schwestertaxon zum Wapiti-Sika-Artenkomplex, von dem er sich vor 1,7-2,5 Millionen Jahren trennte (Mackiewicz et al., 2022; Pitra et al., 2004).
· Bestand: Gefährdet; Populationsentwicklung unbekannt; ca. 7.000 Tiere.
· Verbreitung: Asien (China: Gansu, Qinghai, Tibet, Yunnan).
· Literatur: Flerov (1930); Harris (2015); Mackiewicz et al. (2022); Pitra et al. (2004); Przewalski (1883).
Cervus
canadensis Erxleben, 1777 (Wapiti/Wapiti):
· Taxonomie: Probleme bereiten auch die Taxa sibiricus und songaricus, da hier bei genetischen Analysen nicht alle morphologisch diesen Formen zugeschriebenen Tiere in canadensis landen, sondern teils auch in xanthopygus oder macneilli.
· Unterarten:
1. Cervus canadensis canadensis Erxleben, 1777 (Östlicher Wapiti/North American Wapiti).
2. Cervus canadensis nannodes Merriam, 1905 (Zwergwapiti/Tule Wapiti).
3. Cervus canadensis roosevelti Merriam, 1897 (Roosevelt-Wapiti/Roosevelt’s Wapiti).
4. Cervus canadensis sibiricus Schreber, 1784 (Sibirischer Wapiti/Siberian Wapiti).
5.
· Bestand: Nicht gefährdet; Population zunehmend; über 1 Million Tiere.
· Verbreitung: Nordamerika (Kanada; Vereinigte Staaten; in Mexiko ausgestorben); Asien (China; Kasachstan; Mongolei; Russland).
· Literatur: Broughton et al. (2013); Erxleben (1777); Meiri et al. (2018); Merriam (1897, 1905); Schreber (1784); Severtzov (1873).
Cervus alashanicus Bobrinskii & Flerov, 1935
(Alaschan-Rothirsch/Alashan Red Deer):
· Literatur: Bobrinskii & Flerov (1935).
Cervus
xanthopygus Milne-Edwards,
1867 (Goldsteißhirsch/Manchurian Red Deer):
· Taxonomie: Nach genetischen Analysen ist xanthopygus eng mit macneilli und wallichii verwandt und spaltete sich von diesen vor 250.000 Jahren (Mackiewicz et al., 2022) bis 1 Mio. Jahren ab (Pitra et al., 2004).
· Synonyme: Cervus bedfordianus Lydekker, 1896.
· Literatur: Lydekker (1896, 1898); Mackiewicz et al. (2022); Milne-Edwards (1867); Pitra et al. (2004).
Cervus songaricus Severtzov, 1873 (Tienshan-Rothirsch/Tienshan
Red Deer):
· Taxonomie: Das Taxon songaricus bereitet aktuell noch Probleme, da hier bei genetischen Analysen nicht alle morphologisch dieser Form zugeschriebenen Tiere in einer Gruppe (nahe den hier zu wallichii gehörenden Unterarten) landen, sondern teils auch bei xanthopygus oder canadensis/sibiricus. Nach Xiao et al. (2023) und Mackiewicz et al. (2022) steht songaricus genetisch der Form kansuensis nah, die hier als Unterart von wallichii gelistet wird (Pitra et al., 2004).
· Identifizierung/Beschreibung: Chromosomen 2n = 68.
· Literatur: Mackiewicz et al. (2022); Pitra et al. (2004); Xiao et al. (2023).
Cervus
wallichii G.
Cuvier, 1823 (Chinesischer
Rothirsch/Central Asian Red Deer):
· Taxonomie: Nach Pitra et al. (2004) sind die Taxa wallichii, kansuensis und macneilli genetisch eng verwandt, weshalb sie hier zu einer Art zusammengefasst werden, die das Schwestertaxon zu songaricus bildet.
·
Unterarten:
1. Cervus wallichii wallichii G. Cuvier, 1823 (Tibetischer Rothirsch/Tibetan Red Deer).
2. Cervus wallichii kansuensis Pocock, 1912 (Gansu-Rothirsch/Gansu Red Deer). Synonyme: Cervus wardi Lydekker, 1910.
3. Cervus wallichii macneilli Lydekker, 1909 (Sichuan-Rothirsch/Sichuan Red Deer).
· Literatur: Cuvier (1823); Lydekker (1909); Pitra et al. (2004); Pocock (1912).
Cervus aplodontus (Heude, 1884) (Nordjapanischer Sikahirsch/Northern Japanese Sika Deer):
· Taxonomie: Ursprünglich als Sika aplodontus beschrieben. Häufig findet sich in der Literatur für die Unterart auf Honshu auch der wissenschaftliche Name centralis. Dieser wird hier aber als Synonym von aplodontus betrachtet. C. aplodontus splittete sich vermutlich vor ca. 800.000 Jahren vom Zweig der Arten nippon und keramae ab (Mackiewicz et al., 2022). Innerhalb aplodontus existieren zwei Unterarten, die sich vor ca. 150.00 Jahren trennten.
·
Unterarten:
1. Cervus aplodontus aplodontus (Heude, 1884) (Nördlicher Honshu-Sikahirsch/Northern
Honshu Sika Deer).
2. Cervus aplodontus yesoensis (Heude, 1884) (Hokkaido-Sikahirsch/Hokkaido Sika Deer).
· Synonyme: Cervus nippon centralis Kishida, 1936.
· Literatur: Heude (1884); Mackiewicz et al. (2022).
Cervus nippon Temminck, 1836 (Südlicher Honshu-Sikahirsch/Southern Honshu Sika Deer):
· Terra typica: Nagasaki, Kyushu, Japan.
· Taxonomie: Die unter dem Taxon nippon laufenden Sikahirsche im südlichen Teil von Honshu und auf Kyushu sind genetisch enger mit den Formen auf den südlich davon liegenden japanischen Inseln verwandt als mit den Sikahirschen im nördlichen Teil der Insel Honshu. Die Taxa keramae, mageshimae und yakushimae werden häufig als Unterarten gelistet, stehen nach Analysen von Pitra et al. (2004) Cervus pulchellus genetisch näher, weshalb diese Formen hier mit pulchellus unter der Art Cervus keramae zusammengefasst werden, welche die Schwesterlinie zu C. nippon bildet.
· Bestand: nicht gefährdet.
· Literatur: Pitra et al. (2004); Temminck (1836).
Cervus keramae Kuroda, 1924 (Insel-Sikahirsch/Island Sika Deer):
· Taxonomie: Während das Taxon pulchellus öfters als eigene Art gelistet wird, werden die Formen keramae, mageshimae und yakushimae meist als Unterarten von nippon gelistet werden. Nach genetischen Untersuchungen von Pitra et al. (2004) stehen keramae und mageshimae in näherer Verwandtschaft zu pulchellus, weshalb sie hier als Insel-Art keramae zusammengefasst werden. Das Taxon yakushimae wird aufgrund der geographischen Nähe ebenfalls hier eingeordnet. Der Insel-Sikahirsch stellt das Schwestertaxon zum Japanischen Sikahirsch dar.
·
Unterarten:
1. Cervus keramae keramae Kuroda,
1924 (Kerama-Sikahirsch/Kerama
Sika Deer).
2. Cervus keramae mageshimae Kuroda & Okada, 1951 (Mageshima-Sikahirsch/Mageshima Sika Deer).
3. Cervus keramae pulchellus Imaizumi, 1970 (Tsushima-Sikahirsch/Tsushima Sika Deer).
4. Cervus keramae yakushimae Kuroda & Okada, 1951 (Yakushima-Sikahirsch/Yakushima Sika Deer).
· Literatur: Imaizumi (1970); Kuroda (1924); Kuroda & Okada (1951); Pitra et al. (2004).
Cervus taiouanus Blyth, 1860 (Taiwan-Sikahirsch/Formosan Sika Deer):
· Literatur: Blyth (1860).
Cervus hortulorum Swinhoe, 1864 (Dybowski-Hirsch/Dybowski’s Deer):
·
Unterarten:
1. Cervus hortulorum hortulorum Swinhoe, 1864 (Ussuri-Sikahirsch/Ussuri Sika Deer).
2. †Cervus hortulorum grassianus Heude, 1884 (Shanxi-Sikahirsch/Shanxi Sika Deer).
3. Cervus hortulorum mantchuricus Swinhoe, 1864 (Mantschu-Sikahirsch/Manchuria Sika Deer).
· Literatur: Heude (1884); Swinhoe (1864).
Cervus pseudaxis Gervais, 1841 (Vietnam-Sikahirsch/Vietnamese Sika Deer):
· Unterarten: Nordvietnamesischer Sikahirsch (C. pseudaxis pseudaxis), Hebei-Sikahirsch (C. pseudaxis mandarinus), Südanhui-Sikahirsch (C. pseudaxis kopschi).
· Literatur: Gervais (1841).
Cervus sichuanicus Guo,
Chen & Wang, 1978 (Sichuan-Sikahirsch/Sichuan
Sika Deer):
· Literatur: Guo, Chen & Wang (1978).
Cetartiodactyla > Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Cervinae > Cervini > Elaphurus
|
Elaphurus |
|
|
|
|
Genus
Elaphurus
Milne-Edwards, 1866 (Gattung Davidshirsche/Père David’s Deer):
· 1 Art
Elaphurus davidianus
Milne-Edwards, 1866 (Davidshirsch/Père
David’s Deer):
· Bestand: in freier Wildbahn ausgestorben; alle heute lebenden Tiere in zoologischen Einrichtungen und Naturreservaten
· Verbreitung: Ostasien (China)
Cetartiodactyla > Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Cervinae > Cervini > Panolia
Genus Panolia Gray, 1843 (Gattung Leierhirsche/Eld’s Deer):
· 3 Arten; Stammbaum nach Balakrishnan et al. (2003) und Pitra et al. (2004).
Panolia siamensis (Lydekker, 1915) (Siamesischer Leierhirsch/Eastern Eld’s Deer):
· Bestand: Stark gefährdet; (siamensis, eldii und thamin von IUCN gemeinsam bewertet).
· Verbreitung: Südasien (China; Kambodscha; Laos; in Thailand und Vietnam möglicherweise ausgestorben).
· Literatur: Balakrishnan et al. (2003); Gray et al. (2015); Groves & Grubb (2011); Mattioli (2011, 2020); Pitra et al. (2004).
Panolia eldii (McClelland, 1842) (Manipur-Leierhirsch/Manipur Eld’s Deer):
· Bestand: Stark gefährdet; (siamensis, eldii und thamin von IUCN gemeinsam bewertet).
· Verbreitung: Südasien (Indien).
· Literatur: Balakrishnan et al. (2003); Gray et al. (2015); Groves & Grubb (2011); Mattioli (2011, 2020); Pitra et al. (2004).
Panolia thamin Thomas,
1918 (Burma-Leierhirsch/Thamin):
· Bestand: Stark gefährdet; (siamensis, eldii und thamin von IUCN gemeinsam bewertet).
· Verbreitung: Südasien (Myanmar; in Thailand möglicherweise ausgestorben).
· Literatur: Balakrishnan et al. (2003); Gray et al. (2015); Groves & Grubb (2011); Mattioli (2011, 2020); Pitra et al. (2004).
Cetartiodactyla > Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Cervinae > Muntiacini
Tribus Muntiacini Pocock, 1923 (Gattungsgruppe Muntjakhirsche/Barking Deer):
· 17 Arten.
Genus Elaphodus Milne-Edwards, 1872 (Gattung Schopfhirsche/Tufted Deer):
· 1 Art.
Genus
Muntiacus
Rafinesque, 1815 (Gattung Muntjaks/Muntjacs):
· 16 Arten.
Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Cervinae > Muntiacini
> Elaphodus
|
Elaphodus |
|
|
|
|
Genus Elaphodus Milne-Edwards, 1872 (Gattung Schopfhirsche/Tufted Deer):
· 1 Art.
Elaphodus cephalophus
Milne-Edwards, 1872 (Schopfhirsch/Tufted
Deer):
·
Unterarten:
1. Elaphodus cephalophus cephalophus
Milne-Edwards, 1872 (Westchinesischer Schopfhirsch/Western
Tufted Deer).
2. Elaphodus cephalophus ichangensis
(Ichang-Schopfhirsch/Ichang
Tufted Deer).
3. Elaphodus cephalophus michianus
(Ostchinesischer Schopfhirsch/Michie’s
Tufted Deer).
· Bestand: Potenziell gefährdet (Vorwarnliste); Population abnehmend.
· Literatur: Groves & Grubb (2011); Harris & Jiang (2015).
Artiofabula > Cetruminantia > Ruminantia > Pecora
> Bovoidea
> Cervidae > Cervinae > Muntiacini
> Muntiacus
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
Muntiacus |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Genus
Muntiacus
Rafinesque, 1815 (Gattung Muntjaks/Muntjacs):
· 16 Arten.
Muntiacus reevesi (Ogilby, 1839) (Chinesischer Muntjak/Reeves’s
Muntjac):
·
Terra
typica: Nahe Canton, Guangdong, China.
·
Unterarten:
1. Muntiacus reevesi reevesi
(Ogilby, 1839) (Zwergmuntjak/Chinese Muntjac).
2. Muntiacus reevesi micrurus (P.
L. Sclater, 1875) (Formosa-Muntjak/Formosan Muntjac)
· Synonyme: Muntiacus lachrymans (Milne-Edwards, 1871); Muntiacus sclateri (Swinhoe, 1873); Muntiacus sinensis (Hilzheimer, 1903); Muntiacus pingshiangicus (Hilzheimer, 1906), Muntiacus bridgemani (Lydekker, 1910); Muntiacus teesdalei Lydekker, 1915; Muntiacus jiangkouensis Gu & Xu, 1998.
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge 70-80 cm; Schwanzlänge 12-13 cm; Gewicht 12-15 kg.
· Bestand: Nicht gefährdet; Population abnehmend.
·
Verbreitung: Ostasien (China;
Taiwan)
·
Literatur: Groves & Grubb (2011);
Mattioli (2011, 2020); Ogilby
(1839); Sclater (1875); Timmins & Chan (2016).
Muntiacus vuquangensis
(Tuoc, Dung, Dawson, Arctander & Mackinnon, 1994) (Riesenmuntjak/Giant
Muntjac):
· Terra typica: Vũ Quang-Naturreservat in der Provinz Hà Tĩnh, Vietnam.
· Taxonomie/Etymologie: Ursprünglich als Megamuntiacus vuquangensis in einer eigenen Gattung beschrieben, wurde die Art von McKenna & Bell (1997) in die Gattung Muntiacus überführt. Der wissenschaftliche Artname vuquangensis leitet sich vom Nationalpark Vũ Quang ab, wo die Art entdeckt wurde.
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge 110-115 cm; Schwanzlänge ca. 17 cm; Gewicht ca. 34 kg.
· Bestand: Vom Aussterben bedroht; Population abnehmend.
· Verbreitung: Südost-Asien (Kambodscha; Laos; Vietnam).
· Literatur: Groves & Grubb (2011); McKenna & Bell (1997); Timmins et al. (2016); Tuoc et al. (1994).
Muntiacus rooseveltorum Osgood, 1932 (Roosevelt-Muntjak/Roosevelts’
Muntjac):
· Taxonomie: Ursprünglich als Unterart Muntiacus feae rooseveltorum beschrieben. Genetische und morphologische Untersuchungen des Holotypus von Amato et al. (1999) und Le et al. (2014a, b) unterstützen jedoch den Artstatus.
· Bestand: Daten defizitär; Population abnehmend.
·
Verbreitung: Südost-Asien
(Laos).
·
Literatur: Amato, Egan & Rabinowitz (1999);
Amato et al. (1999); Groves & Grubb
(2011); Le et al. (2014a,
b); Mattioli
(2011, 2020); Timmins
& Duckworth (2016).
Muntiacus puhoatensis
Trai in Chau,
1997 (Vietnamesischer Muntjak/Puhoat Muntjac):
· Bestand: Daten defizitär; aktuelle Entwicklung der Population nicht bekannt.
· Verbreitung: Südost-Asien (Vietnam).
· Literatur: Chau (1997); Groves & Grubb (2011); Mattioli (2011, 2020); Timmins & Duckworth (2016).
Muntiacus truongsonensis
(Giao et al., 1997) (Annam-Muntjak/Annamite
Muntjac):
· Identifizierung/Beschreibung: Gewicht ca. 15 kg.
· Bestand: Daten defizitär; Population abnehmend.
· Literatur: Groves & Grubb (2011); Mattioli (2011, 2020).
Muntiacus putaoensis
Amato, Egan & Rabinowitz, 1999 (Burma-Muntjak/Leaf Muntjac):
· Identifizierung/Beschreibung: Gewicht ca. 12 kg.
· Bestand: Daten defizitär; Population abnehmend.
· Verbreitung: Südasien (Indien; Myanmar).
·
Literatur: Amato, Egan & Rabinowitz (1999);
Groves &
Grubb (2011); Mattioli (2011, 2020); Rabinowitz et al. (1999);
Timmins & Duckworth (2016).
Muntiacus atherodes
Groves & Grubb, 1982 (Borneo-Muntjak/Bornean Yellow Muntjac):
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge 85-90 cm; Schwanzlänge 15-19 cm; Gewicht 14-18 kg.
· Bestand: Potenziell gefährdet (Vorwarnliste); Population abnehmend.
· Verbreitung: Südost-Asien (Brunei; Indonesien: Kalimantan; Malaysia: Sabah, Sarawak).
·
Literatur: Groves
& Grubb (1982, 2011); Mattioli
(2011, 2020); Timmins
et al. (2016).
Muntiacus feae (Thomas & Doria, 1889) (Tenasserim-Muntjak/Fea’s Muntjac):
· Taxonomie: Die Art gilt als monotypisch.
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge 90-100 cm; Schwanzlänge 10-17 cm; Gewicht 20-22 kg.
· Bestand: Daten defizitär; aktuelle Entwicklung der Population nicht bekannt.
· Literatur: Groves & Grubb (2011); Mattioli (2011, 2020).
Muntiacus crinifrons
(Sclater, 1885) (Schwarzer Muntjak/Black
Muntjac):
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge 90-110 cm; Schwanzlänge ca. 20 cm; Gewicht 20-25 kg.
· Bestand: Gefährdet; Population abnehmend.
· Verbreitung: Ostasien (China).
·
Literatur: Groves & Grubb (2011);
Mattioli (2011, 2020); Timmins
& Chan (2016).
Muntiacus gonghanensis
Ma in
Ma, Wang & Shi, 1990 (Gongshan-Muntjak/Gongshan
Muntjac):
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge 90-110 cm; Schwanzlänge ca. 20 cm; Gewicht 20-25 kg.
· Bestand: Daten defizitär; Population abnehmend.
· Literatur: Südasien (Myanmar; China).
· Literatur: Groves & Grubb (2011); Ma, Wang & Shi (1990); Mattioli (2011, 2020); Timmins & Duckworth (2016).
Muntiacus malabaricus Lydekker, 1915 (Malabar-Muntjak/Malabar Red Muntjac):
· Bestand: Nicht bewertet (von IUCN unter M. vaginalis geführt).
·
Literatur: Groves & Grubb (2011);
Mattioli
(2011, 2020).
Muntiacus muntjak (Zimmermann, 1780) (Java-Muntjak/Javan Red Muntjac):
· Identifizierung/Beschreibung: Kopf-Rumpf-Länge 90-120 cm; Schwanzlänge 17-19 cm; Gewicht ca. 35 kg.
· Bestand: Nicht gefährdet; Population abnehmend.
· Verbreitung: Südost-Asien (Thailand; Malaysia; Brunei; Indonesien; in Singapur ausgestorben).
·
Literatur: Groves & Grubb (2011);
Mattioli (2011, 2020); Timmins,
Duckworth & Hedges (2016).
Muntiacus montanus Robinson & Kloss, 1918
(Sumatra-Muntjak/Sumatran
Mountain Muntjac):
· Bestand: Daten defizitär; aktuelle Entwicklung der Population nicht bekannt.
· Verbreitung: Südost-Asien (Indonesien: Sumatra).
·
Literatur: Groves & Grubb (2011);
Mattioli (2011, 2020); Timmins,
Duckworth & Groves (2016).
Muntiacus aureus (C.
H. Smith, 1826) (Zentralindischer Muntjak/Indian
Red Muntjac):
· Bestand: Nicht bewertet (von IUCN unter M. vaginalis geführt).
· Verbreitung: Südasien (Pakistan; Indien).
·
Literatur: Groves & Grubb (2011);
Mattioli
(2011, 2020); Timmins et
al. (2016).
Muntiacus nigripes G. M. Allen, 1930) (Schwarzfuß-Muntjak/Black-footed Muntjac):
· Unterarten:
1. Muntiacus nigripes nigripes G. M. Allen, 1930 (Hainan-Muntjak/Hainan Muntjac),
2. Muntiacus nigripes yunnanensis Ma & Wang, 1988 (Yunnan-Muntjak/Yunnan Muntjac).
· Bestand: Nicht bewertet (von IUCN unter M. vaginalis geführt).
· Verbreitung: Ostasien (China).
·
Literatur: Groves & Grubb (2011);
Mattioli
(2011, 2020); Timmins et
al. (2016).
Muntiacus vaginalis (Boddaert, 1785) (Nordindischer Muntjak/Northern
Red Muntjac):
·
Unterarten:
1. Muntiacus vaginalis vaginalis (Boddaert, 1785) (Bengalischer
Muntjak/Bengal Muntjac).
2. Muntiacus vaginalis annamensis Kloss, 1928 (Kambodscha-Muntjak/Cambodia
Muntjac).
3. Muntiacus vaginalis menglalis Wang & Groves, 1988 (Laos-Muntjak/Lao Muntjac).
4. Muntiacus vaginalis curvostylis (Gray, 1872) (Thailand-Muntjak/Thai Muntjac).
· Bestand: Nicht gefährdet; Population abnehmend.
·
Verbreitung: Südostasien
(Pakistan; Indien; Sri Lanka; Nepal; Bangladesch; Bhutan; Myanmar; Thailand; Laos; Kambodscha; Vietnam; China)
·
Literatur: Groves & Grubb (2011);
Mattioli
(2011, 2020); Timmins et
al. (2016).
Referenzen:
1)
Agnarsson, I. & May-Collado, L. J. (2008). The phylogeny of Cetartiodactyla: the importance of dense taxon sampling,
missing data, and the remarkable promise of cytochrombe
b to provide reliable species-level phylogenies. Molecular Phylogenetics and Evolution 48 (): 964-985.
2)
Allen, J. A. (1896). Description of new North American mammals. Bulletin of the American Museum of Natural History 8 (14): 233-240.
3)
Allen, J. A. (1900). The mountain caribou of
northern British Columbia. Bulletin of
the American Museum of Natural History 13
(1): 1-18.
4)
Allen, J. A. (1902). Description of a new caribou
from northern British Columbia and remarks on Rangifer montanus. Bulletin of American Museum of Natural History 16 (15): 149-158.
5)
Allen, J. A. (1908).
The Peary caribou (Rangifer pearyi Allen).
Bulletin of the American Museum of
Natural History 24 (22):
487-504.
6)
Allen, J. A. (1914). The barren-ground caribou of
Labrador. Proceedings of the New England Zoölogical Club 4:
103-107.
7)
Amato, G., Egan, M. G. & Rabinowitz, A. (1999). A new species of muntjac, Muntiacus putaoensis (Artiodactyla:
Cervidae) from northern Myanmar. Animal
Conservation 2 (1): 1-7.
8) Amato, G.,
Egan, M. G., Schaller, G. B., Baker, R. H., Rosenbaum, H. C., Robichaud, W. G.
& DeSalle, R. (1999). Rediscovery of Roosevelt’s
barking deer (Muntiacus rooseveltorum).
Journal of Mammalogy 80 (2): 639-643.
9)
Balakrishnan, C. N., Monfort, S. L., Gaur, A., Singh,
L. & Sorenson, M. D. (2003). Phylogeography and conservation genetics of Eld’s deer (Cervus eldi). Molecular Ecology 12 (1): 1-10.
10)
Banfield, A. W. F. (1961). A revision of the reindeer and caribou, genus Rangifer. National Museum of Canada Bulletin 177 (66): 1-137.
11) Banfield, A.
W. F. (1963). A selection of neotypes for
subspecies of Rangifer tarandus (Linné)
(Mammalia-Cervidae). Contributions to
Zoology 185: 60-71.
12)
Baranova, A. I., Kholodova,
M. V., Davydov, A. V. & Rozhkov, Y. I. (2012). Polymorphism of the mtDNA control region in wild reindeer Rangifer tarandus (Mammalia: Artiodactyla)
from the European part of Russia. Russian
Journal of Genetics 48 (9):
939-944.
13) Bernegossi, A. M., Borges, C. H. S., Sandoval,
E. D. P., Cartes, J. L., Cernohorska, H., Kubickova, S., Vozdova, M., Caparroz, R., Gonzáles, S. & Duarte, J. M. B. (2023). Resurrection of the genus Subulo Smith, 1827 for the gray brocket deer,
with designation of a neotype. Journal of
Mammalogy 104 (3): 619-633.
14) Black-Decima, P. A. & Vogliotti, A. (2016). Mazama gouazoubira. The IUCN Red
List of Threatened Species 2016:
e.T29620A22154584. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T29620A22154584.en.
Stand 05. August 2023.
15) Boeskorov, G. G. (1996). On taxonomic structure of the genus Alces (Artiodactyla, Cervidae). Vestnik Zoologii 30 (6): 70-78.
16) Boeskorov, G. G. (1997). Chromosomal differences in moose (Mammalia, Artiodactyla,
Alces alces
L.). Genetika
33 (7): 974-978.
17)
Boeskorov, G. G. (2003). The genetics of modern moose
and a review of its taxonomy. Cranium
20 (2): 31-45.
18)
Boulet, M., Couturier, S., Côté, S. D., Otto, R. D.
& Bernatchez, L. (2007). Integrative use of spatial, genetic, and demographic analyses
for investigating genetic connectivity between migratory, montane, and
sedentary caribou herds. Molecular
Ecology 16 (20): 4223-4240.
19) Brook, S. M. (2016). Rusa alfredi. The IUCN Red
List of Threatened Species 2016:
e.T4273A22168782. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T4273A22168782.en.
Stand 05. August 2023.
20) Brook, S.
M., Chanta, N. & Phan, C. (2015). Indochinese hog deer Axis porcinus annamiticus on the brink of extinction. Deer Specialist Group 27: 14-31.
21) Brook, S. M., Pluháček, J., Lorenzini, R., Lovari, S., Masseti, M., Pereladova, O. &
Mattioli, S. (2018). Cervus canadensis. The IUCN Red List of Threatened Species 2018:
e.T55997823A142396828.
http://dx.doi.org/10.2305/IUCN.UK.2018-2.RLTS.T55997823A142396828.en. Stand 11.
März 2023.
22) Brook, S. M., Thakur, M.,
Ranjitsinh, M. K., Donnithorne-Tait, D. & Ahmad, K. (2017). Cervus hangul ssp. hanglu. The IUCN Red List of Threatened Species 2017:
e.T113259123A113281791.
http://dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T113259123A113281791.en. Stand
11. März 2023.
23) Broughton,
J. M., Beck, R. K., Coltrain, J. B., O’Rourke, D. H. & Rogers, A. R. (2013). A late Holocene population bottleneck in California tule elk (Cervus elaphus nannodes):
Provisional support from ancient DNA. Journal
of Archaeological Method and Theory 20
(3): 495-524.
24)
Brown, D. M., Brenneman, R. A., Koepfli,
K.-P., Pollinger, J. P., Milá, B., Georgiadis, N. J.,
Louis Jr., E. E., Grether, G. F., Jacobs, D. K. & Wayne, R. K. (2007). Extensive population genetic
structure in the giraffe. BMC Biology
5 (57): 1-13.
25) Bubenik, A. (1959). Der Feinbau der Geweihe von Cervus (Dama) dama Linné, 1758 und mesopotamicus Brooke, 1875, und ihre Entwicklungsstufe. Säugetierkundliche Mitteilungen 7 (S): 90-95.
26) Byun, S. A.,
Koop, B. F. & Reimchen, T. E. (2002). Evolution of the Dawson caribou (Rangifer tarandus dawsoni). Canadian Journal of Zoology 80 (5): 956-960.
27)
Camerano, L. (1902). Ricerche intorno alle renne delle isole
Spitzberghe. Mémoires de l’Académie Royale des Sciences de Torino, 2e
Série 51: 159-240.
28)
Cap, H., Deleporte, P.,
Joachim, J. & Reby, D. (2008). Male vocal behavior and phylogeny in deer. Cladistics 24 (6):
917-931.
29)
Chau, B. (1997). Another new discovery
in Vietnam. Vietnam Economic News 47: 46-47.
30)
Dahlan, I. (2009). Characteristics and
cutability of farmed rusa deer (Cervus timorensis) carcasses for
marketing of venison. Asian-Australasian
Journal of Animal Science 22
(5): 740-746.
31)
Decker, J. E., Pires, J. C., Conant, G. C., McKay, S.
D., Heaton, M. P., Chen, K., Cooper, A., Vilkki, J.,
Seabury, C. M., Caetano, A. R., Johnson, G. S., Brenneman, R. A., Hanotte, O., Eggert, L. S., Wiener, P., K. J.-J., Kim, K.
S., Sonstegard, T. S., Tassell, C. P., Neibergs, H.
L., McEwan, J. C., Brauning, R., Coutinho, L. L., Babar, M. E., Wilson, G. A.,
McClure, M. C., Rolf, M. M., Kim, JW., Schnabel, R. D. & Taylor, J. F. (2009). Resolving the evolution of
extant and extinct ruminants with high-troughput phylogenomics. Proceedings
of the National Academy of Sciences 106
(44): 18644-18649.
32)
Desmarest, A. G. (1822). Encyclopèdie
Méthodique 127: Mammalogie ou description des espèce de mammifères. Seconde Partie. Druck und Buchhandlung Veuve Agasse,
Paris.
33) Doan, K., Niedziałkowska, M., Stefaniak, K., Sykut,
M., Jedrzejewska, B., Ratajczak-Skrzatek,
U., Piotrowska, N., Ridush, B., Zachos, F. E.,
Popović, D., Baca, M., Mackiewicz, P., Kosintsev,
P., Makowiecki, D., Charniauski, M., Boeskorov, G., Bondarev, A. A., Danila, G., Kusak, J.,
Rannamäe, E., Saarma, U., Arakelyan, M., Manaseryan,
N., Krasnodebski, D., Titov, V., Hulva,
P., Bălăşescu, A., Trantalidou,
K., Dimitrijević, V., Shpansky, A., Kovalchuk,
O., Klementiev, A. M., Foronova, I., Malikov, D. G.,
Juras, A., Nikolskiy, P., Grigoriev, S. E., Cheprasov, M. Y., Novgorodov, G.
P., Sorokin, A. D., Wilczyński, J., Protopopov, A. V., Lipecki, G.
& Stankovic, A. (2022). Phylogenetic and
phylogeography of red deer mtDNA lineages during the
last 50 000 years in Eurasia. Zoological
Journal of Linnean Society 194
(2): 431-456.
34)
Doan, K., Zachos, F. E., Wilkens, B., Vigne, J.-D.,
Piotrowska, N., Stanković, A., Jedrzejewska, B., Stefaniak, K. & Niedziałkowska,
M. (2017). Phylogeography of the Tyrrhenian red
deer (Cervus elaphus corsicanus)
resolved using ancient DNA of radiocarbon-dated subfossils. Scientific Reports 7: 2331: 1-9.
35) Duarte, J.
M. B., González, S. & Maldonado, J. E. (2008).
The surprising evolutionary history of South American deer. Molecular Phylogenetics and Evolution 49 (1): 17-22.
36) Duckworth, J. W., Kumar, N.
S., Anwarul Islam, M., Sagar Baral, H. & Timmins, R. (2015). Axis axis. The IUCN Red
List of Threatened Species 2015:
e.T41783A22158006.
http://dx.doi.org/10.2305/IUCN.UK.2015-4.RLTS.T41783A22158006.en. Stand 25.
Oktober 2020.
37) Duckworth, J. W., Kumar, N.
S., Pokharel, C. P., Sagar Baral, H. & Timmins, R. (2015). Rucervus duvaucelii. The IUCN Red
List of Threatened Species 2015:
e.T4257A22167675.
http://dx.doi.org/10.2305/IUCN.UK.2015-4.RLTS.T4257A22167675.en. Stand 25.
Oktober 2020.
38) Duckworth, J. W., Robichaud,
W. & Timmins, R. (2015). Rucervus schomburgki. The IUCN Red
List of Threatened Species 2015:
e.T4288A79818502. http://dx.doi.org/10.2305/IUCN.UK.2015-3.RLTS.T4288A79818502.en.
Stand 25. Oktober 2020.
39) Feldhamer, G. A., Farris-Renner, K. C. & Barker, C. M. (1988). Dama dama. Mammalian Species 20 (317):1-8.
40) Ferguson, W.
W., Porath, Y. & Paley, S. (1985). Late Bronze period yields
first osteological evidence of Dama dama (Artiodactyla; Cervidae)
from Israel and Arabia. Mammalia 49 (2): 209-214.
41)
Fiorillo, B. F., Sarria-Perea, J. A., Abril, V. V.
& Duarte, J. M. B. (2013).
Cytogenetic description of the Amazonian brown brocket Mazama nemorivaga (Artiodactyla,
Cervidae). Comparative Cytogenetics 7 (1): 25-31.
42) Geist,
V. (1998). Deer of the World: Their Evolution, Behaviour,
and Ecology. Stackpole Books,
Mechanicsburg.
43)
Gilbert, C., Ropiquet, A.
& Hassanin, A. (2006). Mitochondrial and nuclear phylogenies of Cervidae (Mammalia, Ruminantia): systematic, morphology, and biogeography. Molecular Phylogenetics and Evolution 40 (1): 101-117.
44) Gmelin, J. F. (1788). Caroli a Linné Systema naturae per regna tria
naturae, secundum classes, ordines, genera, species, cum characteribus,
differentiis, synonymis, locis. Tomus I. Pars I. Editio
decima tertia, aucta, reformata.
Georg Emanuel Beer, Leipzig.
45) Goldfuß, G. A. (1820).
Handbuch der Naturgeschichte
zum Gebrauch bei Vorlesungen. Dritter Theil. Zweite Abteilung. Handbuch der Zoologie. Johann Leonhard Schrag, Nürnberg.
46) Gray, T. N. E., Brook, S. M.,
McShea, W. J., Mahood, S., Ranjitsingh, M. K., Miyunt, A., Hussain, S. A. & Timmins, R. (2015). Rucervus eldii. The IUCN Red
List of Threatened Species 2015:
e.T4265A22166803.
http://dx.doi.org/10.2305/IUCN.UK.2015-2.RLTS.T4265A22166803.en. Stand 25.
Oktober 2020.
47) Groves, C. P. (1983). Geographic variation
in the barasingha or swamp deer (Cervus duvaucelii). Journal of the Bombay Natural History Society 79 (3): 620-629.
48)
Groves, C. P. & Grubb, P. (1982). The species of muntjac
(genus Muntiacus)
in Borneo: unrecognized sympatry in tropical deer. Zoologische Mededelingen 56 (1): 203-216.
49) Groves, C. P. & Grubb, P. (1987). Relationships of living deer. S. 21-59 in: Wemmer, C. M. (Hrsg.) (1987). Biology and Management of Cervidae. Smithonian Instituion Press, Washington.
50)
Groves, C. P. & Grubb, P. (2011). Ungulate Taxonomy. The
Johns Hopkins University Press,
Baltimore.
51) Gunn, A. (2016).
Rangifer tarandus. The IUCN Red
List of Threatened Species 2016:
e.T29742A22167140.
http://dx.doi.org/10.2305/IUCN.UK.2016-1.RLTS.T29742A22167140.en. Stand 11.
März 2023.
52) Guo, Z.-P., Chen, E.-Y. & Wang, Y.-Z. (1978). A new subspecies of sika deer from
Sichuan – Cervus nippon sichuanicus subsp. nov. Acta Zoologica Sinica 24 (2): 187-192.
53) Gutiérrez, E. E., Helge, K. M., McDonough, M. M.,
Bauer, F., Hawkins, M. T. R., Escobedo-Morales, L. A., Patterson, B. D. &
Maldonado, J. E. (2017). A gene-tree
test of the
traditional taxonomy of
American deer: The importance
of voucher specimens, geographic data, and dense sampling. ZooKeys 697:
87-131.
54) Haltenorth, T. (1959). Beitrag zur Kenntnis des Mesopotamischen Damhirsches
– Cervus (Dama) mesopotamicus Brooke, 1875 – und zur Stammes- und
Verbreitungsgeschichte der Damhirsche allgemein. Säugetierkundliche Mitteilungen 7 (S): 1-89.
55) Harding, L. E. (2022).
Available names for Rangifer
(Mammalia, Artiodactyla, Cervidae) species and
subspecies. ZooKeys
1119: 117-151.
56) Harris, R. B. (2015). Cervus albirostris. The IUCN Red List of Threatened Species 2015:
e.T4256A61976756.
http://dx.doi.org/10.2305/IUCN.UK.2015-2.RLTS.T4256A61976756.en. Stand 11. März
2023.
57) Harris, R. B. & Jiang, Z. (2015). Elaphodus cephalophus. The IUCN Red List of
Threatened Species 2015: e.T7112A22159620.
http://dx.doi.org/10.2305/IUCN.UK.2015-2.RLTS.T7112A22159620.en. Stand 25.
Oktober 2020.
58)
Harrison, D. L. & Bates, P. J. J. (1991). The Mammals of Arabia. Harrison
Zoological Museum, Sevenoaks.
59)
Hassanin, A. & Douery,
E. J. P. (2003).
Molecular and morphological phylogenies of Ruminantia
and the alternative position of the Moschidae. Systematic Biology 52 (2): 206-228.
60) Heckeberg, N. S., Erpenbeck, D., Wörheide, G. & Rössner, G. E. (2016). Systematic
relationships of five newly sequenced cervid species. PeerJ 4: e2307: 1-31. Doi: 10.7717/peerj.2307.
61) Hedges, S., Duckworth, J. W.,
Timmins, R., Semiadi, G. & Dryden, G. (2015). Russa timorensis. The IUCN Red List of Threatened Species 2015:
e.T41789A22156866.
http://dx.doi.org/10.2305/IUCN.UK.2015-2.RLTS.T41789A22156866.en. Stand 05.
August 2023.
62)
Hernández-Fernández,
M. & Vrba, E. S. (2005). A complete estimate of the phylogenetic relationships in Ruminantia: a dated species-level supertree
of the extant ruminants. Biological
Reviews 80 (2): 269-302.
63) Heude, P. (1888). Etudes sur les Ruminants de l’Asie orientale. Cerfs des Philippines et de l’Indo-Chine. Ibidem 2 (1): 1-50.
64) Hill, B. D., Thomas, R. J. & Mackenzie, A. R. (1987). Campylobacter hyointestinalis-associated enteritis in Moluccan rusa deer (Cervus timorensis subsp. moluccensis). Journal of Comparative Pathology 97 (6): 687-694.
65) Hu, P., Shao, Y., Xu, J., Wang, T., Li, Y., Liu, H., Rong, M., Su, W., Chen, B., Cui, S., Cui, X., Yang, F., Tamate, H. & Xing, X. (2019). Genome-wide study on genetic diversity and phylogeny of five species in the genus Cervus. BMC Genomics 20: 384: 1-13.
66) Hundertmark, K. (2016). Alces alces.
The IUCN Red List of
Threatened Species 2016:
e.T56003281A22157381.
http://dx.doi.org/10.2305/IUCN.UK.2016-1.RLTS.T56003281A22157381.en. Stand 12.
März 2023.
67) Kerr, R. (1792). The Animal Kingdom, or Zoological System, of the celebrated Sir Charles Linnaeus. Class I. Mammalia: Containing a complete systematic description, arrangement, and nomenclature, of all the known species and varieties of the Mammalia, or animals which give suck to their young. W. Creech, Edinburg.
68) Kraft, H. (1959). Der Nasenspiegel der Damhirsche Cervus (Dama) mesopotamicus Brooke, 1875, und dama Linné, 1758. Säugetierkundliche Mitteilungen 7 (S): 95-98.
69)
Kumar, A.,
Ghazi, M. G. U., Hussain, S. A., Bhatt,
D. & Gupta, S. K. (2016). Mitochondrial and nuclear DNA based
genetic assessment indicated distinct variation and low genetic exchange among
the three subspecies of swamp deer (Rucervus duvaucelii). Evolutionary
Biology 44 (1): 31-42.
70)
Kumar, V. P., Shrivastwa, A., Nigam, P., Kumar, D. & Goyal, S.
P. (2017). Genetic characterization of wild swamp
deer populations: ex situ conservation and forensics implications. Mitochondrial DNA Part A 28 (6): 965-970.
71)
Kumar, V. P., Thakur, M., Rajpoot, A., Joshi, B. D.,
Nigam, P., Ahmad, K., Kumar, D. & Goyal, S. P. (2017). Resolving the phylogenetic status and taxonomic relationships of
the hangul (Cervus elaphus hangul) in
the family Cervidae. Mitochondrial DNA
Part A 28 (6): 835-842.
72)
Kuznetsova, M. V., Kholodova,
M. V. & Danilkin, A. A. (2005). Molecular phylogeny of deer (Cervidae: Artiodactyla). Russian
Journal of Genetics 41 (7):
742-749.
73)
Kvie, K. S., Heggenes, J., Anderson, D. G., Kholodova,
M. V., Sipko, T. Mizin, I. & Røed, K. H. (2016). Colonizing the High Arctic:
Mitochondrial DNA reveals common origin of Eurasian Archipelagic reindeer (Rangifer tarandus). PLoS ONE 11 (11): e0165237:
1-15. Doi: 10.1371/journal.pone.0165237.
74) Le, M.,
Nguyen, T. V., Duong, H. T., Nguyen, H. M., Dinh, L. D., Do. T., Nguyen, H. D.
& Amato, G. (2014). Discovery of the Roosevelt’s
barking deer (Muntiacus rooseveltorum)
in Vietnam. Conservation Genetics 15 (4): 993-999.
75)
Le, M., Nguyen, T. V., Duong, H. T., Nguyen, H. M.,
Nguyen, V. T. H., Nguyen, H. D., Pham, T. A. & Do, H. T. (2014). Genetic diversity of muntjacs (Cervidae: Muntiacus) in Xuan Lien Nature
Reserve. Journal of Natural Science 30: 117-123.
76)
Li, M., Tamate, H. B., Wei, F.-W., Wang, X.-M., Masuda,
R., Sheng, H.-L. & Ohtaishi (2003). Phylogenetic relationships among
deer in China derived from mitochondrial DNA cytochrome b sequences. Acta Theriologica
48 (2): 207-219.
77) Linnaeus, C. (1758). Systema naturae per regna tria naturae, secundum classes, ordines, genera, species,
cum characteribus, differentiis,
synonymis, locis – Editio decima, reformata – Tomus
I. Lars Salvi, Stockholm.
78) Lister, A. M. (2005). Subspecies differentiation among moose (Alces alces
(L.)): Geographical variation in cranial morphology. Quaternaire Supplement 2: 31-37.
79) Lorenzini, R. & Garofalo,
L. (2015). Insights into the evolutionary history
of Cervus (Cervidae, tribe Cervini)
based on Bayesian analysis of mitochondrial marker sequences, with first
indications for a new species. Journal of
Zoological Systematics and Evolutionary Research 53 (4): 340-349.
80) Lovari, S., Lorenzini, R., Masseti, M., Pereladova, O.,
Carden, R. F., Brook, S. M. & Mattioli, S. (2018). Cervus elaphus. The IUCN Red List of
Threatened Species 2018: e.T55997072A142404453.
http://dx.doi.org/10.2305/IUCN.UK.2018-2.RLTS.T55997072A142404453.en. Stand 11.
März 2023.
81)
Ludt, C. J.,
Schroeder, W., Rottmann, O. & Kuehn, R. (2004). Mitochondrial DNA phylogeography of red deer (Cervus elaphus). Molecular Phylogenetics and Evolution 31 (3): 1064-1083.
82) Lydekker, R. (1898). The Deer of All Lands – A History of the Family
Cervidae Living and Extinct. Rowland Ward,
London.
83) Ma, S.-L., Wang, Y.-X. & Shi, L.-M. (1990). A new
species of the genus Muntiacus
from Yunnan, China. Zoological Research
11 (1): 47-53.
84) Mackiewicz, P., Matosiuk, M., Świsłocka, M., Zachos, F. E.,
Hajji, G. M., Saveljev, A. P., Seryodkin,
I. V., Farahvash, T., Rezaei, H. R., Torshizi, R. V., Mattioli, S. & Ratkiewicz, M. (2022). Phylogeny
and evolution of the genus Cervus
(Cervidae, Mammalia) as revealed by complete mitochondrial genomes. Scientific Reports 12: 16381: 1-17.
85) MacKinnon, J. R., Ong, P.
& Gonzales, J. (2015). Rusa marianna. The IUCN Red
List of Threatened Species 2015:
e.T4274A22168586. http://dx.doi.org/10.2305/IUCN.UK.2015-2.RLTS.T4274A22168586.en.
Stand 11. März 2023.
86) Masseti, M. & Mertzanidou, D. (2008).
Dama dama.
The IUCN Red List of Threatened Species 2008:
e.T42188A10656554.
http://dx.doi.org/10.2305/IUCN.UK.2008.RLTS.T42188A10656554.en. Stand 25.
Oktober 2020.
87)
Mattioli, S. (2011). Family Cervidae (Deer). S.
350-443 in: Wilson, D. E. &
Mittermeier, R. A. (Hrsg.) (2011). Handbook of the Mammals of
the World Volume 2 – Hoofed Mammals. Lynx
Edicions, Barcelona.
88)
Mattioli, S. (2020). Family
Cervidae (Deer). S.308-321 in: Burgin, C. J., Wilson, D. E., Mittermeier, R. A., Rylands,
A. B., Lacher, T. E. & Sechrest, W.
(Hrsg.) (2020). Illustrated Checklist of the Mammals of
the World Volume 2 – Eulipotyphla to Carnivora. Lynx
Edicions, Barcelona.
89)
Meijaard, E. &
Groves, C. P. (2004).
Morphometrical relationships between South-east Asian deer (Cervidae, tribe
Cervini: evolutionary and biogeographic implications. Journal of Zoology 263
(2): 179-196.
90)
Meiri, M., Kosintsev, P., Conroy, K., Meiri, S., Barnes, I.
& Lister, A. (2018). Subspecies dynamics in space
and time: A study of the red deer complex using ancient and modern DNA and
morphology. Journal of Biogeography 45 (2): 367-380.
91)
Milne-Edwards, A. (1867).
Observations sur quelques mammifères
du nord de la Chine. Annales des Sciences
Naturelles Zoologie et Paléontologie, 5e Série 8: 374-376.
92) Morales-Donoso,
J. A., Vacri, G. Q., Bernegossi, A. M., Sandoval, E. D. P., Peres, P. H. F.,
Galindo, D. J., de Thoisy, B., Vozdova, M., Kubickova, S. & Duarte, J. M. B. (2023). Revalidation of Passalites Gloger, 1841 for the Amazon brown
brocket deer P. nemorivagus (Cuvier, 1817)
(Mammalia, Artiodactyla, Cervidae). ZooKeys 1167: 241-264.
93)
Pereladova, O. (2013). Restoration of Bukhara deer
(Cervus elaphus bactrianus
Lydd.) in Central Asia in 2000-2011. DSG
Newsletter 25: 19-30.
94)
Pitra, C., Fickel, J., Meijaard, E. & Groves, P. C. (2004). Evolution and phylogeny of old world
deer. Molecular Phylogenetics and
Evolution 33 (3): 880-895.
95)
Price, S. A., Bininda-Emonds,
O. R. P. & Gittleman, J. L. (2005). A complete phylogeny of the whales, dolphins
and even-toed hoofed mammals (Cetartiodactyla). Biological Reviews 80 (3): 445-473.
96)
Prothero, D. R. & Foss, S. E. (2007). The evolution of
Artiodactyls. The John Hopkins University
Press, Baltimore.
97)
Rabinowitz, A., Myint, T., Khaing, S. T. &
Rabinowitz, S. (1999). Description of the leaf deer (Muntiacus putaoensis), a new species of muntjac
from northern Myanmar. Journal of Zoology
249 (4): 427-435.
98) Randi, E.,
Mucci, N., Claro-Hergueta, F., Bonnet, A. & Douzery, E. J. P. (2006). A
mitochondrial DNA control region phylogeny of the Cervinae:
speciation in Cervus and implications
for conservation. Animal Conservation
4 (1): 1-12.
99)
Ropiquet, A., Li, B.
& Hassanin, A.
(2009). SuperTRI: A new approach based on branch
support analyses of multiple independent data sets for assessing reliability of
phylogenetic inferences. Comptes Rendus Biologies 332 (9):
832-847.
100)
Rossi, R. V. & Duarte, J. M. B. (2016). Mazama nemorivaga. The IUCN Red List of
Threatened Species 2016: e.T136708A22158407.
http://dx.doi.org/10.2305/IUCN.UK.2016-1.RLTS.T136708A22158407.en. Stand 06. August
2023.
101)
Sandoval, E. D. P., Vacari, G. Q., Juliá, J. P., González, S., Vozdova, M., Cernohorska, H., Kubickova, S., Kalthoff, D. C. & Duarte, J. M. B.
(2023). Assessing the taxonomic status of the gray
brocket Mazama simplicicornis
argentina Lönnberg, 1919 (Artiodactyla: Cervidae). Zoologcial Studies 62: 30: 1-11.
Doi: 10.6620/ZS.2023.62-30.
102)
Semiadi, G., Duckworth, J. W. &
Timmins, R. (2015). Axis kuhlii. The IUCN Red List of Threatened Species 2015:
e.T2447A73071875. http://dx.doi.org/10.2305/IUCN.UK.2015-2.RLTS.T2447A73071875.en.
Stand 25. Oktober 2020.
103)
Smith-Jones, C. (2023).
A Guide tot he Deer of the World. Stackpole Books, Lanham.
104)
Sokolov, I. I. (1937). Sexual,
age and racial variation of the skull of wild
and domestic reindeer. Soviet Reindeer Industry
9: 1-102.
105)
Sokolov, I. I. (1963). Artiodactyla. S. 1008-1012 in: Sokolov, I. I. (Hrsg.) (1963). The mammals
of the USSR fauna. Publishing House of the AS USSR, Moskau.
106)
Steinhauf, D. (1959). Beobachtungen am Mesopotamischen Damwild Cervus (Dama) mesopotamicus Brooke, 1875, in Gefangenschaft. Säugetierkundliche Mitteilungen 7 (S): 99-103.
107)
Timmins, J., Belden, G., Brodie, J., Ross, J., Wilting, A. & Duckworth,
J. W. (2016). Muntiacus atherodes. The IUCN Red List of
Threatened Species 2016: e.T42189A22166396.
http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T42189A22166396.en. Stand 25.
Oktober 2020.
108)
Timmins, J. & Chan, B. (2016). Muntiacus crinifrons. The IUCN Red List of
Threatened Species 2016: e.T13924A22160753.
http://dx.doi.org/10.2305/IUCN.UK.2016-1.RLTS.T13924A22160753.en. Stand 25.
Oktober 2020.
109)
Timmins, J. & Chan, B. (2016). Muntiacus reevesi. The IUCN Red List of
Threatened Species 2016: e.T42191A170905827. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T42191A170905827.en.
Stand 25. Oktober 2020.
110)
Timmins, R. J. & Duckworth, J. W. (2016). Muntiacus gongshanensis. The IUCN Red List of Threatened Species 2016:
e.T13926A22160596. http://dx.doi.org/10.2305/IUCN.UK.2016-1.RLTS.T13926A22160596.en.
Stand 25. Oktober 2020.
111)
Timmins, R. J. & Duckworth, J. W. (2016). Muntiacus puhoatensis. The IUCN Red List of Threatened Species 2016:
e.T136293A22164930.
http://dx.doi.org/10.2305/IUCN.UK.2016-1.RLTS.T136293A22164930.en. Stand 25.
Oktober 2020.
112)
Timmins, R. J. & Duckworth, J. W. (2016). Muntiacus putaoensis. The IUCN Red List of Threatened Species 2015:
e.T136479A22159478.
http://dx.doi.org/10.2305/IUCN.UK.2016-1.RLTS.T136479A22159478.en. Stand 25.
Oktober 2020.
113)
Timmins, R. J. & Duckworth, J. W. (2016). Muntiacus rooseveltorum. The IUCN Red List of Threatened Species 2016:
e.T13928A22160435. http://dx.doi.org/10.2305/IUCN.UK.2016-1.RLTS.T13928A22160435.en.
Stand 25. Oktober 2020.
114)
Timmins, R. J., Duckworth, J. W. & Groves, C. P. (2016). Muntiacus montanus. The IUCN Red List of
Threatened Species 2016: e.T136831A22168363.
http://dx.doi.org/10.2305/IUCN.UK.2016-1.RLTS.T136831A22168363.en. Stand 25.
Oktober 2020.
115)
Timmins, R. J., Duckworth, J. W. & Hedges, S. (2016). Muntiacus muntjak. The IUCN Red List of Threatened Species 2016:
e.T42190A56005589. http://dx.doi.org/10.2305/IUCN.UK.2016-1.RLTS.T42190A56005589.en.
Stand 25. Oktober 2020.
116)
Timmins, R. J., Duckworth, J. W., Robichaud, W., Long, B., Gray, T. N. E.
& Tilker, A. (2016). Muntiacus vuquangensis. The IUCN Red List of Threatened Species 2016:
e.T44703A22153828. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T44703A22153828.en.
Stand 25. Oktober 2020.
117)
Timmins, R. J., Duckworth, J. W., Samba Kumar, S., Anwarul Islam, M., Sagar
Baral, H., Long, B. & Maxwell, A. (2015). Axis porcinus. The IUCN Red List of Threatened Species 2015:
e.T41784A22157664. http://dx.doi.org/10.2305/IUCN.UK.2015-4.RLTS.T41784A22157664.en.
Stand 25. Oktober 2020.
118)
Timmins, R. J., Kawanishi, K., Giman, B., Lynam, A., Chan, B.,
Steinmetz, R., Sagar Baral, H. & Samba Kumar, N. (2015). Rusa unicolor. The IUCN Red
List of Threatened Species 2015:
e.T41790A85628124.
http://dx.doi.org/10.2305/IUCN.UK.2015-2.RLTS.T41790A22156247.en. Stand 04.
August 2023.
119)
Timmins, R. J., Steinmetz, R., Samba
Kumar, N., Anwarul Islam, M. & Sagar Baral, H. (2016). Muntiacus vaginalis. The IUCN Red
List of Threatened Species 2016:
e.T136551A22165292.
http://dx.doi.org/10.2305/IUCN.UK.2016-1.RLTS.T136551A22165292.en. Stand 25.
Oktober 2020.
120)
Tuoc,
D., Dung, V., Dawson, S., Arctander, P. &
MacKinnon, J. (1994). Introduction of a new large mammal species in
Viet Nam. Forest Inventory and Planning
Institute, Hanoi.
121)
Uerpmann, H.-P. (1987). The ancient distribution of
ungulate mammals in the Middle East. Dr.
Ludwig Reichert Verlag, Wiesbaden.
122)
Van Roosmalen, M. G. M. (2015). Hotspot of new megafauna found in the Central Amazon (Brazil):
the lower Rio Aripuanã Basin. Biodiversity Journal 6
(1): 219-244.
123)
Vereshchagin, N. K. (1955). Caucasian elk Alces
alces caucasicus N. Ver. subsp. nova and information on the
history of the elk in the Caucasus. Zoologicheskii Zhurnal 34
(2): 460-463.
124)
Vrolik, W. (1829). Over
eene vermoedelijk tweede sort van rendier. Nieuwe Verhandlingen der
Eerste Klasse van het Koninkliik-Nederlandsche
Instituut van Wetenschappen,
Letterkunde en Schoone Kunsten te Amsterdam 2: 153-160.
125)
Wagner, J. A. (1844). Die Säugthiere
in Abbildungen nach der
Natur mit Beschreibungen
von Dr. Johann Christian Daniel von Schreber. Supplementband Vierte Abteilung: Die Nager (zweiter Abschnitt, Zahnlücker, Einhufer, Dickhäuter und Wiederkäuer. Expedition des Schreber’schen
Säugthier- und des Esper’schen
Schmetterlingswerkes, Erlangen.
126)
Widmann, P. & Lastica, E. (2015). Axis calamianensis. The IUCN Red List of Threatened Species 2015:
e.T2446A22156678.
http://dx.doi.org/10.2305/IUCN.UK.2015-2.RLTS.T2446A22156678.en. Stand 25.
Oktober 2020.
127)
Werner, N. Y., Rabiei, A., Saltz, D., Daujat, J. & Baker, K. (2015). Dama mesopotamica. The IUCN Red List of
Threatened Species 2015: e.T6232A97672550.
http://dx.doi.org/10.2305/IUCN.UK.2015-4.RLTS.T6232A22164332.en. Stand 25.
Oktober 2020.
128)
Xiao, B., Wang, T., Lister, A. M., Yuan, J., Hu, J., Song, S., Lin, H.,
Wang, S., Wang, C., Wei, D., Lai, X., Xing, X. & Sheng, G. (2023).
Ancient and modern mitogenomes of red deer reveal its evolutionary history in
northern China. Quaternary Science
Reviews 301: 107924: 1-8.
129)
Yannic, G., Pellissier, L., Ortego, J., Lecomte, N., Couturier, S., Cuyler,
C., Dussault, C., Hundertmark, K. J., Irvine, R. J., Jenkins, D. A., Kolpashikov, L., Mager, K., Musiani, M., Parker, K. L., Røed, K. H., Sipko, T., Þórisson, S. G., Weckworth,
B. V., Guisan, A., Bernatchez, L. & Côtè, S. D. (2014). Genetic diversity in caribou linked to past
and future climate change. Nature Climate
Change 4 (2): 132-137.
130)
Zachos, F. E., Mattioli, S., Ferretti, F. & Lorenzini, R. (2014). The unique Mesola
red deer of Italy: Taxonomic recognition (Cervus
elaphus italicus nova ssp., Cervidae) would
endorse conservation. Italian Journal of
Zoology 81 (1): 136-143.